1. AM:有機余輝納米組裝體用于腫瘤診療
癌癥診療是目前精準醫療領域的研究熱點。然而,目前大多數現有的診療納米材料都是通過將治療劑和顯影劑摻雜到一個粒子實體中而實現的,因此無論其在體內的位置如何,都具有永久的藥物效應和成像信號。新加坡南洋理工大學浦侃裔教授團隊報道了一種具有診療功能的有機余輝納米組裝體(APtN)的開發,該納米組裝在腫瘤相關的H2O2作用下,其藥物效應和診斷信號會被特異性地激活。APtN是由一種兩親性高分子和一種近紅外(NIR)染料組成,二者分別作為對H2O2響應的余輝前藥和余輝引發劑。這種分子結構使得APtN能夠被動地靶向小鼠腫瘤,并在腫瘤中特異性釋放抗癌藥物同時也自發地生成余輝底物。在近紅外光預輻照后,余輝引發劑可以產生單線態氧并將余輝底物轉變為可自發光的形式。因此,該過程產生的余輝發光強度與藥物釋放狀態息息相關,可以對體內前藥的激活情況進行實時監測。
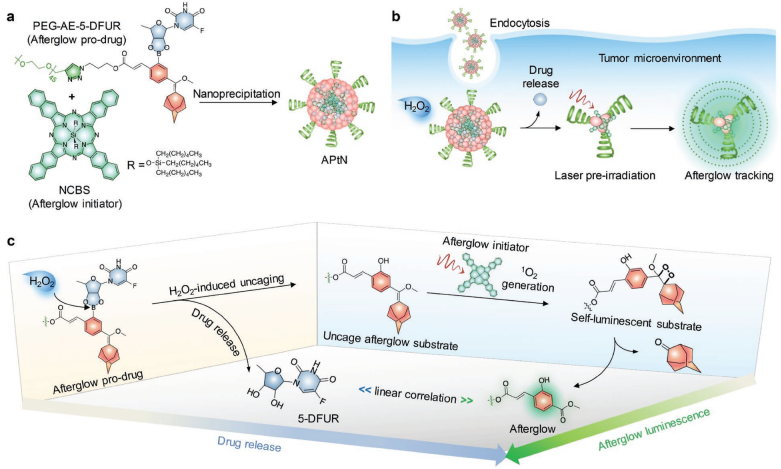
Shasha He, Kanyi Pu. et al. An Organic Afterglow Protheranostic Nanoassembly. Advanced Materials. 2019
DOI: 10.1002/adma.201902672
https://doi.org/10.1002/adma.201902672
2. Nano Lett.:響應近紅外光的多肽納米復合材料用于治療耐多藥癌癥
腫瘤耐多藥(MDR)的特性是由P糖蛋白(P-gp)轉運體過度表達引起的,它是造成化療(CT)失敗的主要原因之一,也嚴重阻礙了多肽納米藥物的臨床轉化。上海交大董常明教授團隊制備了一種新型的多肽納米復合材料PNOC-PDA,它可以將NO遞送與光熱相結合,進而有效克服MDR的缺點以實現CT的效果最大化,并且被增強的CT可以和細胞內高濃度NO氣體去輔助溫和的光熱療法(PTT)來有效地根除癌細胞。多種實驗結果表明,三種治療方法的結合在克服MDR、殺傷MCF-7/ADR等方面均有較好的協同作用,P-gp表達下調至46%。實驗通過一次靜脈注射PNOC-PDA/DOX和一次近紅外光照射,可以同時進行PTT、NO氣體治療和CT,因此在30天內可以實現MCF-7/ADR腫瘤治愈,且不會造成皮膚損傷、形成瘢痕和腫瘤復發。

Yue Ding, Chang-Ming Dong. et al. NIR-Responsive Polypeptide Nanocomposite Generates NO Gas, Mild Photothermia, and Chemotherapy to Reverse Multidrug-Resistant Cancer. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00975
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b00975
3. 劉斌ACS Nano:基于Cu(II)的MOF用于腫瘤細胞激活的光動力治療
設計開發在靶點被激活的光敏劑(PSs)和減少內源性抗氧化劑對活性氧(ROS)的消耗有望實現具有最低非特異性光毒性的成像指導的光動力治療(PDT)。新加坡國立大學劉斌教授團隊選用基于羧酸Cu(II)的MOF-199作為惰性載體來遞送PSs,并且在遞送過程中負載的PSs不會被光激活。在材料被細胞攝取后,MOFs中的Cu(II)能有效清除內源性谷胱甘肽,同時誘導MOF-199分解去釋放PSs,恢復其產生ROS的能力。體內外實驗結果證明,該平臺可以實現高效的腫瘤,PDT,并且大大降低對正常細胞的光毒性。
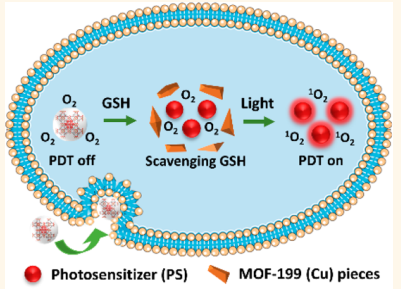
Yuanbo Wang, Bin Liu. et al. Cancer-Cell-Activated Photodynamic Therapy Assisted by Cu(II)-Based Metal?Organic Framework. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01665
https://pubs.acs.org/doi/10.1021/acsnano.9b01665
4. AM綜述:仿生納米技術用于構建個性化疫苗
雖然現代醫學為治療很多傳統疾病帶來了新的希望,但在目前的現狀基礎上還可以有很大的改進空間。例如一些傳染病,具有抗生素耐藥性的超級病原體對大多數目前臨床批準的藥物已經沒有反應。而在癌癥治療領域,設計“靈丹妙藥”的想法也早已被人們拋棄。因此,越來越多的人提倡個性化治療,即根據患者的具體情況制定醫療保健計劃。而開發針對細菌和腫瘤的疫苗則是一種很好的體現個性化治療的方案。接種有效的疫苗可以幫助解決許多具有挑戰性的疾病,但目前的疫苗仍受到效力不足和抗原廣度等因素的限制。最近,一些研究人員開始使用仿生納米技術來解決這些障礙。加州大學圣地亞哥分校Ronnie H. Fang教授和張良方教授合作綜述了近年來仿生納米疫苗在抗菌和抗癌方面的研究進展,并著重介紹了其在個體化治療方面的應用潛力。
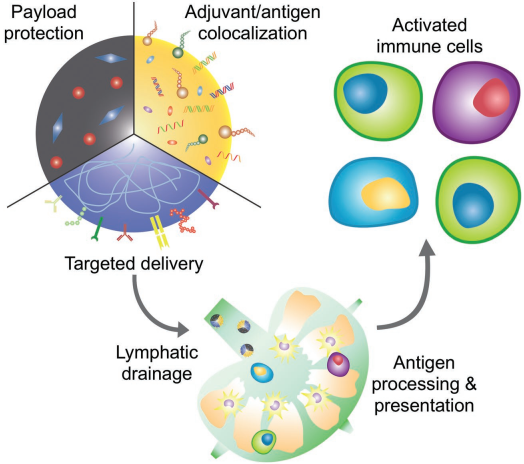
Jiarong Zhou, Ronnie H. Fang, Liangfang Zhang. et al. Biomimetic Nanotechnology toward Personalized Vaccines. Advanced Materials. 2019
DOI: 10.1002/adma.201901255
https://doi.org/10.1002/adma.201901255
5. Adv. Sci.:多功能納米調節器可重塑免疫微環境以增強腫瘤免疫治療的免疫記憶
乏氧會導致PD-L1上調并降低T淋巴細胞的浸潤,從而增強腫瘤對免疫治療抵抗力。此外,髓樣來源的抑制細胞(MDSCs)也與腫瘤部位的免疫抑制活性和對免疫檢查點阻斷(ICB)的抵抗有關。中山大學沈君教授和帥心濤教授合作制備了一種結合MnO2納米粒子和小分子IPI549的多功能納米調制器,它可以重塑腫瘤免疫微環境(TME)來解放免疫系統。實驗通過靜脈注射該納米材料后發行其可以有效地在腫瘤積累并通過MnO2緩解乏氧,隨后可通過在TME釋放IPI549來抑制MDSCs上的PI3Kγ,進而下調PD-L1的表達并將腫瘤相關巨噬細胞(TAM)極化為類M1表型(腫瘤抑制型)。由此可以增強CD4+輔助T淋巴細胞(Th細胞),和細胞毒性CD8+T淋巴細胞(Tc細胞)的浸潤,同時也抑制調節性T淋巴細胞(Treg細胞)的滲透,從而增強腫瘤的免疫治療。此外,TME中生成的Mn2+也可用于進行腫瘤特異性磁共振成像(MRI)。
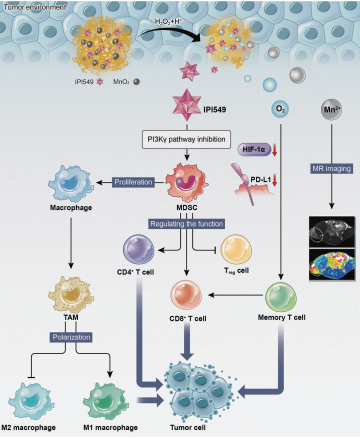
Meng Yu, Jun Shen, Xintao Shuai. et al. Multifunctional Nanoregulator Reshapes Immune Microenvironment and Enhances Immune Memory for Tumor Immunotherapy. Advanced Science. 2019
DOI: 10.1002/advs.201900037
https://doi.org/10.1002/advs.201900037
6. ACS Nano:通過三功能無機納米顆粒提高干細胞治療的效果
干細胞治療心臟疾病目前仍存在注射不當、存活率低和細胞保留率低等問題。加州大學Jesse V. Jokerst教授團隊制備了一種具有良好生物相容性的多功能二氧化硅-氧化鐵納米顆粒來幫助解決上述問題。實驗通過在介孔泡沫二氧化硅納米顆粒的外表面和孔壁上原位生長Fe3O4納米顆粒制備了該納米材料。與以前的工作不同的是,這種方法在多孔硅結構的孔隙中也建立了一個磁性的部分。這一材料具有三種功能:藥物遞送、磁性控制和成像。在二氧化硅納米顆粒中引入的Fe3O4可以提高其膠體穩定性、T2磁共振成像的對比度和超順磁性。實驗進一步將該混合型材料作為胰島素樣生長因子的緩釋載體,這種促生存因子可以提高細胞的生存能力。體內實驗表明,用這種納米顆粒標記后可以顯著提高干細胞治療的效果。在第30天和第60天,納米顆粒標記的細胞分別使左心室射血平均分數增加11和21%,并使整體縱向應變分別增加了24和34%。
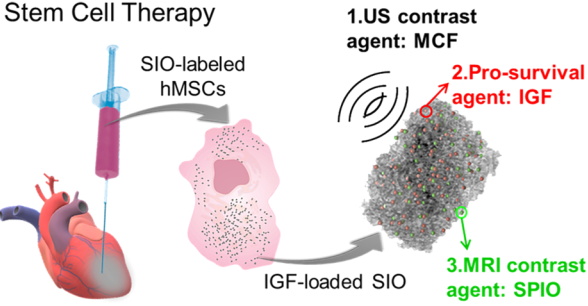
Fang Chen, Jesse V. Jokerst. et al. Increasing the Efficacy of Stem Cell Therapy via Triple-Function Inorganic Nanoparticles. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00653
https://pubs.acs.org/doi/10.1021/acsnano.9b00653
7. Angew:對乳腺癌干細胞具有細胞毒性的三角形鉑(II)多核復合物
制備多核金屬配合物的開發新型抗癌藥物和藥物遞送系統提供了一條新的途徑。印度高哈蒂大學Sushobhan Ghosh團隊和英國萊斯特大學Kogularamanan Suntharalingam團隊合作報道了一種新型的三角形多核鉑復合物Pt-3,它對乳腺癌干細胞具有顯著的抑制作用。實驗發現,相對于對其他乳腺癌細胞和非致瘤性乳腺癌細胞來說,Pt-3對乳腺癌干細胞具有選擇性的毒性。并且其對乳腺球的形成和生存也有抑制作用,效果比目前臨床使用的鉑類藥物來說更好。機制研究表明,Pt-3能有效進入乳腺CSCs并穿透細胞核,進而誘導基因組DNA損傷來促進細胞凋亡。
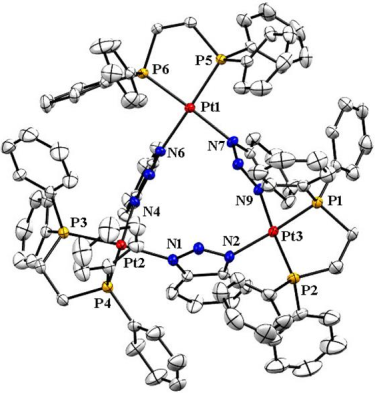
Arvin Eskandari, Sushobhan Ghosh, Kogularamanan Suntharalingam. et al. A Triangular Platinum(II) Multi-nuclear Complex with Cytotoxicity Towards Breast Cancer Stem Cells. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201905389
http://dx.doi.org/10.1002/anie.201905389
8. AFM:多孔酶膜構建的汗液葡萄糖傳感器用于無創的健康監測
開發穩定性高的葡萄糖傳感器對于糖尿病診斷和無創的健康監測來說是非常重要的。加州大學Ali Javey教授團隊和香港科技大學范志勇教授團隊合作合成了一種可以固定酶的多孔膜,并將其牢牢固定在改性的納米電極觸點上,進而構建了具有良好的穩定性和機械魯棒性的葡萄糖傳感器。這也是首次有研究開發出基于納米多孔膜的電化學傳感器,它可以解決酶的逃逸并為分子/離子的擴散和交互提供了一個充足的表面,從而確保其可以進行持續的催化活動進而實現非侵入式的健康監測傳感。研究結果表明,該葡萄糖傳感器可以進行長期的穩定監測,響應漂移也非常小。此外,它還可以被集成到微流控傳感貼片中用于進行無創的汗液葡萄糖監測。因此其在并臨床診斷、個性化醫療監控和慢性病管理等領域具有廣闊的應用前景。
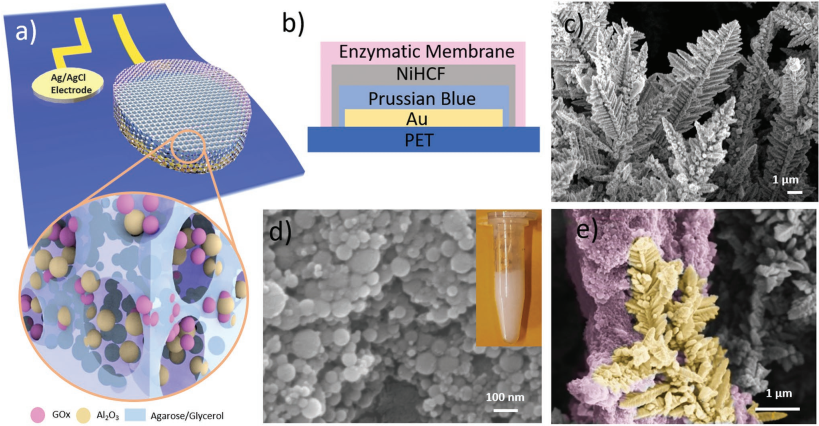
Yuanjing Lin, Zhiyong Fan, Ali Javey. et al. Porous Enzymatic Membrane for Nanotextured Glucose Sweat Sensors with High Stability toward Reliable Noninvasive Health Monitoring. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201902521
https://doi.org/10.1002/adfm.201902521
9. Chem. Sci.:核-雙殼上轉換納米枝晶的合成及其在生物成像中的應用
通過對摻雜稀土的、基于NaYF4的上轉換納米粒子(UCNPs)形貌進行調控,可以有效地調整其上轉換發光 (UCLE) 的特性。中科院長春應化所王振新團隊合成了一類新的上轉換核-雙殼結構的納米枝晶(UCNDs),它包括核(NaYF4: Yb, Er, Ca)、過渡層(NaYF4: Yb, Ca)和殼(NaNdF4: Yb, Ca)。高濃度的Nd3+敏化劑存在于外殼中,可以有效增強材料的發光強度,而富含Yb3+的過渡層則可作為外殼與內核之間的高效的能量遷移網絡,進行防止Nd3+造成的猝滅效應。實驗結果表明,這一獨特的結構和成分優勢使得該納米材料在980 nm光的激發下的UCLE提高了5倍和15倍。因此,進一步包覆SiO2-COOH層后得到的UCND@SiO2-COOH可作為高效的熒光探針用于體內外生物成像,且生物毒性非常低。
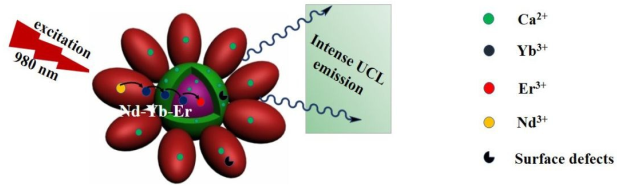
Murad M.A, Zhenxin Wang. et al. Rational Synthesis of Spatial Core-double Shell Upconversion Nanodendrites with Ultrabright Luminescence for Bioimaging Application. Chemical Science. 2019
DOI:10.1039/C9SC01586H
https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc01586h#!divAbstract
10. Chem. Soc. Rev.:用于選擇性靶向和多種分析物檢測成像的功能性探針
與傳統的靶向單一分析物的單結合位點探針不同,具有多個相互作用位點或可以靶向一種或多種分析物進行串聯反應的探針受到越來越多的研究者關注,它們可以被用于解決在結構相似的化合物或復雜基質中存在的選擇性靶向以及分析物在體內的相互作用可視化等難題。有鑒于此,山西大學陰彩霞教授團隊和波特蘭州立大學Robert M. Strongin團隊合作綜述了近年來設計用于選擇性靶向和多種分析物檢測成像的功能性探針的研究,包括對其中的檢測機制和生物過程的研究進展;旨在促進該類探針的發展以幫助人們去更深入地了解具有生物活性的分析物的生理學機制。
Yongkang Yue, Robert M. Strongin, Caixia Yin. et al. Functional synthetic probes for selective targeting and multi-analyte detection and imaging. Chemical Society Reviews. 2019
DOI: 10.1039/c8cs01006d
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c8cs01006d#!divAbstract
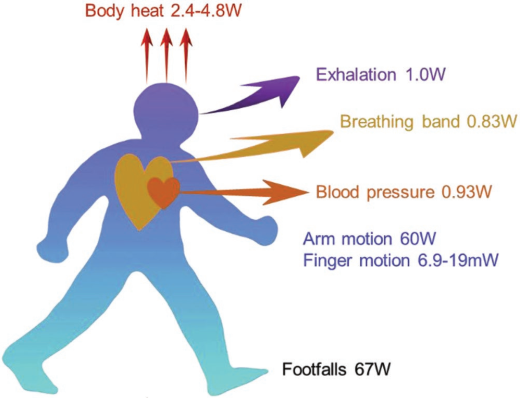
11. AM綜述:用于收集人體能量的纖維基能量轉換設備
隨著輕便柔性智能電子產品的迅速發展,如何為這些電子產品提供能量也成為了一個熱門的研究課題。人體在日常活動中會產生大量的機械能和熱能,這些能量往往可以用來為大多數可穿戴電子產品供能。纖維基能量轉換設備(FBECD)可以有效地將人體能量轉換為電能,從而為可穿戴電子設備提供動力。華中科技大學周軍教授團隊綜述了基于壓電、摩擦電、靜電、熱電等技術的纖維基功能材料的制造以及設計不同類型FBECD器件的策略;概述了纖維基自供電系統和傳感器的研究現狀、優點及成本效益;最后對纖維基能量轉換設備這一領域所面臨的挑戰和未來機遇進行了討論。
Liang Huang, Jun Zhou. et al. Fiber-Based Energy Conversion Devices for Human-Body Energy Harvesting. Advanced Materials. 2019
DOI: 10.1002/adma.201902034
https://doi.org/10.1002/adma.201902034
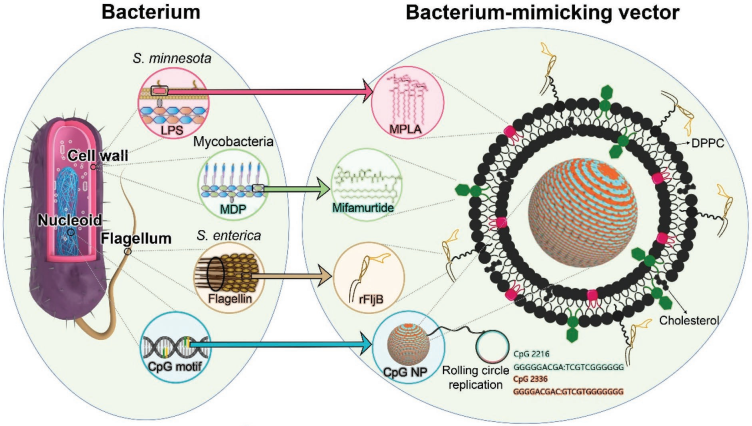
12. AFM:模擬細菌的低毒性載體可輔助增強癌癥免疫治療
細菌可以被作為抗癌免疫治療的佐劑。然而由于存在一定的毒性,細菌或其提取物在免疫治療中的應用是十分有限的。復旦大學陸偉教授團隊和上海交大肖澤宇團隊合作設計了一種模擬細菌形態的輔助載體,該載體由細菌的細胞壁、鞭毛和類核等成分組合而成。模擬細菌的載體(BMVs)可以協同觸發多種PRRs信號通路,其效果要優于目前報道的人工合成的或細菌衍生的抗腫瘤治療佐劑。實驗發現,BMVs可以提高光熱治療的效率,進而在可小鼠模型中根除50%的較大型腫瘤并完全防止腫瘤復發,且其自身毒性也非常低。因此,這種模擬細菌的策略為設計工程化載體用于輔助增強癌癥免疫治療提供了一種有前途的新選擇。
Binbin Zheng, Zeyu Xiao, Wei Lu. et al. Bacterium-Mimicking Vector with Enhanced Adjuvanticity for Cancer Immunotherapy and Minimized Toxicity. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901437
https://doi.org/10.1002/adfm.201901437
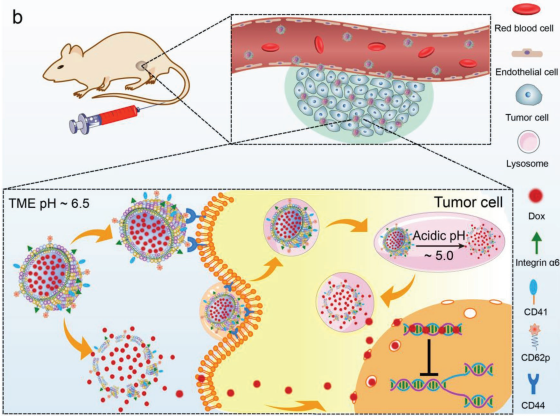
13. AM:設計對pH響應的藥物遞送仿生系統用于增強的腫瘤治療
仿生偽裝給藥,即利用天然的細胞膜進行藥物遞送具有很好的藥代動力學和生物相容性等優勢,它也為開發安全的納米藥物提供了一個很有前景的解決方案。國家納米科學中心張銀龍、王靜和聶廣軍合作設計了一種對pH響應的仿生平臺,并將其用于腫瘤藥物的特異性遞送和腫瘤微環境引發的藥物釋放。這種基于血小板的納米載體是通過將血小板膜與功能化脂質體相結合而構建的。由于其具有血小板膜的偽裝,因此其對腫瘤的親和性較強,并可以通過響應溶酶體的酸性微環境來選擇性地釋放藥物。小鼠腫瘤模型實驗結果表明,該仿生平臺比無pH響應的材料或傳統的pH敏感性脂質體有著更好的抗腫瘤效果。這一工作通過介紹了一種將刺激響應特性融入仿生納米顆粒的簡便方法,證明了細胞膜可以為納米載體提供高效的仿生偽裝。
Guangna Liu, Jing Wang, Guangjun Nie. et al. Engineering Biomimetic Platesomes for pH-Responsive Drug Delivery and Enhanced Antitumor Activity. Advanced Materials. 2019
DOI: 10.1002/adma.201900795
https://doi.org/10.1002/adma.201900795
14. AM綜述:用于精準醫學的可口服生物制劑
得益于基因組圖譜和分子診斷技術的進步,精準醫學領域也得到了迅速的發展。目前,精準治療往往依賴于使用生物大分子。然而由于其復雜的結構和克服生物屏障的能力有限,這些大分子需要通過注射的方式給藥。因此,開發設計可口服的大分子藥物成為了一項熱門的研究領域。西班牙圣地亞哥·德·孔波斯特拉大學José Alonso團隊綜述了利用口服生物制劑進行給藥的研究現狀和未來發展前景;介紹了在臨床實驗中的使用的相關技術以及實現特異性靶向胃腸道細胞群和進一步內化的策略;最后對該領域的臨床轉化所面臨的挑戰和未來的發展方向進行了討論。
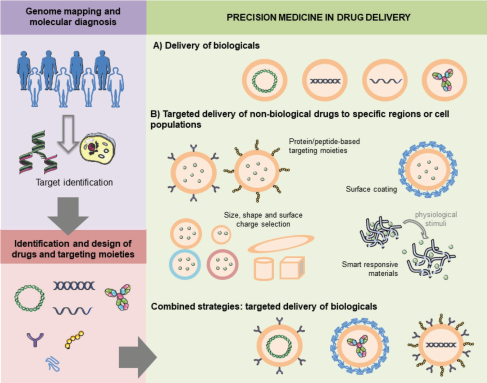
Matilde Durán-Lobato, María José Alonso. et al. Oral Delivery of Biologics for Precision Medicine. Advanced Materials. 2019
DOI: 10.1002/adma.201901935
https://doi.org/10.1002/adma.201901935
15. AM:酸性微環境驅動的DNA納米機器可在腫瘤細胞外環境中成像ATP
細胞外環境中的ATP是腫瘤治療的一個新興靶點,它也是形成腫瘤微環境(TME)和調控腫瘤進展的關鍵信使之一。然而,開發用于在TME的細胞外進行ATP靶向成像的探針仍是一個很大的挑戰。國家納米科學中心李樂樂團隊報道了一種TME驅動的DNA納米機器(Apt-LIP),它可以在超高的信號-背景比條件下對腫瘤細胞外環境中的ATP進行空間控制成像。該探針可通過pHLIP模塊對TME中的偏酸微環境進行響應,從而使結構轉換信號適配體單元特異性錨定到腫瘤細胞膜上,從而對細胞外的ATP進行“on-off”熒光成像。因此,Apt-LIP可以在酸性TME的驅動下對不同細胞外的ATP濃度進行可視化,并可以對細胞釋放的內源性ATP進行監測。研究結果表明,Apt-LIP可以對原發性和轉移性腫瘤的細胞外ATP進行特異性成像,因此具有非常廣闊的應用前景。
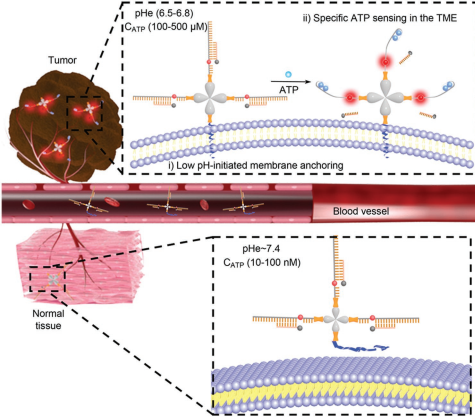
Zhenghan Di, Lele Li. et al. An Acidic-Microenvironment-Driven DNA Nanomachine Enables Specific ATP Imaging in the Extracellular Milieu of Tumor. Advanced Materials. 2019
DOI: 10.1002/adma.201901885
https://doi.org/10.1002/adma.201901885
16. AM綜述:靶向癌癥的納米顆粒用于組合式核酸遞送
核酸是一種很有前途的治療方法,可以治療包括癌癥在內的多種疾病。而為了有效和安全的將核酸遞送給癌細胞,通常需要使用載體對核酸進行包裝使其被靶細胞吸收并發揮作用。與其他類型的治療方法一樣,核酸載體的設計也必須避免不必要的副作用;因此,這類載體將貨物瞄準癌細胞的能力至關重要。約翰霍普金斯大學醫學院Jordan J. Green教授和Stephany Y. Tzeng博士合作綜述討論了用于治療應用的核酸種類和其在細胞內進行有效遞送時所必須克服的障礙;介紹了對作為核酸遞送載體的非病毒納米材料的類型以及針對特定腫瘤細胞的不同靶向策略;最后對設計用于核酸遞送的納米顆粒載體的研究進行了總結。
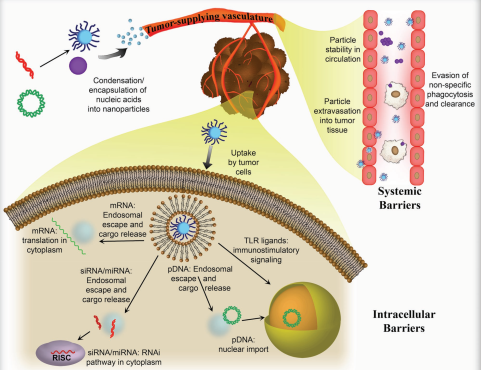
Hannah J. Vaughan, Jordan J. Green, Stephany Y. Tzeng. et al. Cancer Targeting Nanoparticles for Combinatorial Nucleic Acid Delivery. Advanced Materials. 2019
DOI: 10.1002/adma.201901081
https://doi.org/10.1002/adma.201901081
17. ACS Nano:磁-光納米平臺用于對小鼠腫瘤進行多模態成像
多模態成像可以使用更多的成像模式來對活體對象進行成像,目前在癌癥診療領域受到了人們的普遍關注。斯坦福大學醫學院饒江宏教授團隊制備了一種納米粒子MMPF NPs,它可以對異種移植的腫瘤活體小鼠進行磁粒子成像(MPI)、磁共振(MRI),光聲和熒光成像(MPI)。MMPF NPs可通過MPI來對體內的NPs進行長期、動態、準確的實時定量,并可以對腫瘤進行超敏感的MPI成像。此外,該納米顆粒也具有較長的血液循環 (半衰期為49小時)和較高的腫瘤攝取效果(18% ID/g)。研究結果表明,MMPF NPs可通過同時進行MPI、MRI、熒光和光聲成像來實現對小鼠腫瘤的多模態成像,其在小鼠皮下和原位腫瘤模型中都有著突出的成像效果。
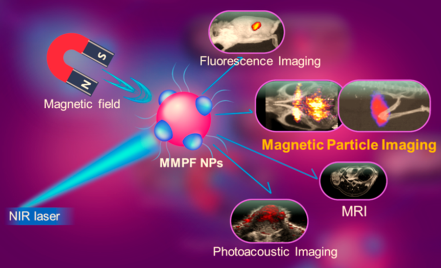
Guosheng Song, Jianghong Rao. et al. A Magneto-Optical Nanoplatform for Multimodality Imaging of Tumors in Mice. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01436
https://pubs.acs.org/doi/10.1021/acsnano.9b01436
18. Nano Lett.:碳源納米酶對創傷性腦損傷具有極高的活性氮選擇性
活性氧和活性氮(RONS)(尤其是活性氮(RNS))是神經系統疾病發生的中間產物。天津大學張曉東教授團隊開發了一種碳源納米酶,其抗氧化活性是抗壞血酸(AA)的12倍,并具有多種的酶活性。該納米酶對?NO、ONOO?等高活性RNS以及O2??、H2O2、?OH等活性氧(ROS)具有超高的清除效率(是AA的16倍)。體外實驗表明,被H2O2或脂多糖損傷的神經元細胞在經碳源納米酶處理后可明顯恢復,。此外,該碳源納米酶也可用于消除小鼠體內有害的過氧化氫和谷胱甘肽二硫鍵,具有很好的治療急性腦外傷的潛力。
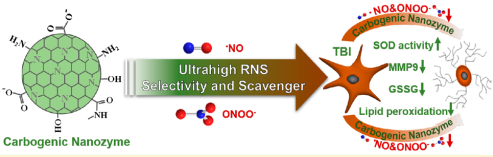
Xiaoyu Mu, Xiao-Dong Zhang. et al. Carbogenic Nanozyme with Ultrahigh Reactive Nitrogen Species Selectivity for Traumatic Brain Injury. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01333
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01333
19. AFM:靶向骨肉瘤循環腫瘤細胞上的CXCR1進行納米給藥的精確治療
轉移性和化療耐藥性是影響骨肉瘤(OS)治療效果的關鍵因素。在高轉移的OS細胞亞型中,CXCR1過表達與化療耐藥性和耐失巢凋亡性密切相關。進一步研究表明,CXCR1在具有腫瘤干細胞特征的循環腫瘤細胞(CTC)源性細胞上也會高表達。上海交通大學湯亭亭教授團隊設計合成一種CXCR1靶向肽,它可以競爭性抑制IL-8/CXCR1通路并提高CTCs對順鉑藥物的敏感性。有基于此,實驗制備了具有對pH響應來釋放順鉑的熒光標記磁性納米顆粒(NPs),并將其與CXCR1靶向肽連接得到Cis@MFPPC。結果表明,該靶向納米粒子可以有效地抑制CTC在體內的存活,并且在原位模型和病人來源的腫瘤異種移植模型中也能有效抑制OS的生長和肺轉移。
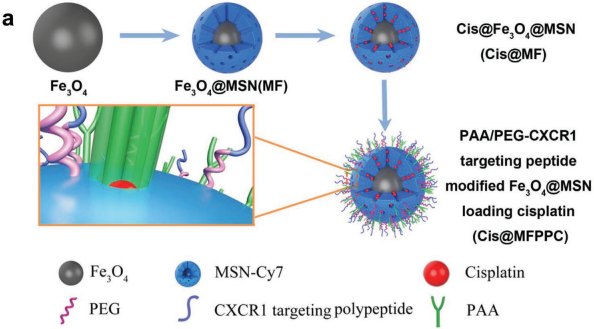
Xiu-guo Han, Ting-ting Tang. et al. Targeting of CXCR1 on Osteosarcoma Circulating Tumor Cells and Precise Treatment via Cisplatin Nanodelivery. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201902246
https://doi.org/10.1002/adfm.201902246
20. AM:全有機半導體C3N4/PDINH異質結構用于光催化抗菌治療
近年來,光催化抗菌療法被證明可以有效地對抗耐藥細菌。許多無機納米系統已也被開發用于進行細菌感染的光催化治療,但由于重金屬存在一定的毒性風險,其進一步的應用也受到了很大的限制。有機半導體光催化材料具有良好的生物相容性、可調諧的電子結構、多樣的結構、合適的帶隙和低成本等眾多優勢,因此受到人們的廣泛關注。西北大學劉晶教授團隊、國家納米科學中心陳春英團隊和濟南大學于欣博士團隊合作,通過在C3N4表面原位重結晶PDINH得到了一種全有機復合光催化納米材料C3N4/PDINH異質結構,該材料具有很高的光催化效率。實驗結果表明,該復合結構的吸收光譜可以從紫外光擴展到近紅外光(750 nm),從而利用增強的光催化作用來產生更多的活性氧,因此其對革蘭氏陰性菌和陽性菌都有很好的滅活作用,而對正常組織細胞的毒性則可以忽略不計。研究表明,該異質結構對感染金黃色葡萄球菌的小鼠真皮傷口感染傷口再生具有有效的促進作用。這種全有機異質結構在傷口消毒中具有廣闊的應用前景。
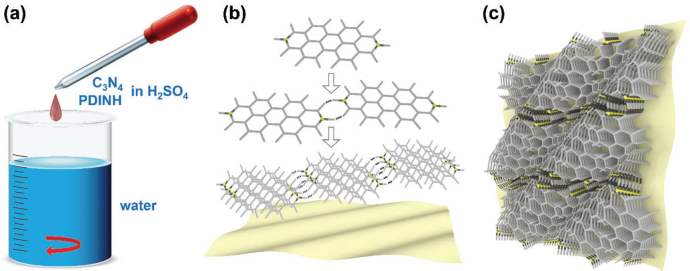
Longwei Wang, Xin Yu, Jing Liu, Chunying Chen. et al. An All-Organic Semiconductor C3N4/PDINH Heterostructure with Advanced Antibacterial Photocatalytic Therapy Activity. Advanced Materials. 2019
DOI: 10.1002/adma.201901965
https://doi.org/10.1002/adma.201901965
21. Nano Lett.:對急性缺血性腦卒中的中性粒細胞進行識別、干預和監測
中性粒細胞與許多炎癥性疾病例如急性缺血性中風(AIS)有關。當中性粒細胞不受控制地向腦缺血區遷移并隨后釋放活性氧,會造成AIS后的再灌注損傷。因此,減少炎癥性中性粒細胞的浸潤是治療AIS的一種有效方法。受血小板和炎癥性中性粒細胞之間發生的特異性細胞識別作用的啟發,中國藥科大學鞠曹云博士和張燦教授合作制備了一種模擬血小板的納米顆粒(PTNPs),它可在治療AIS過程中對炎癥性中性粒細胞進行識別、干預和監測。實驗表明,PTNPs可以對脾酪氨酸激酶抑制劑白皮杉醇和T2造影劑超順磁性氧化鐵(SPIO)進行共負載,隨后通過包覆血小板膜來成功地識別并粘附中性粒細胞。負載的白皮杉醇可以被遞送給中性粒細胞從而減少中性粒細胞的浸潤和梗死區域。同時可以結合磁共振成像,利用內源性的SPIO來對炎癥性中性粒細胞與治療效果進行實時監測。
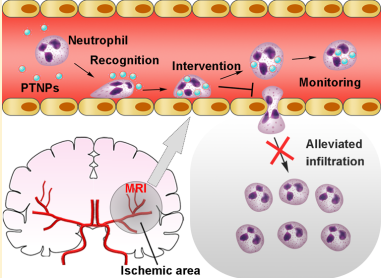
Chunming Tang, Caoyun Ju, Can Zhang. et al. Recognition, Intervention, and Monitoring of Neutrophils in Acute Ischemic Stroke. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01282
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01282
22. Adv. Sci.綜述:納米系統用于免疫調節
免疫治療已成為預防和治療許多疾病的一種有效策略。而利用納米系統進行免疫調節則可以很高效地提高治療效果,同時也能克服治療時所面臨的許多障礙,如免疫刺激不足、脫靶以及免疫因子的生物活性喪失等等。中科院長春應化所丁建勛團隊綜述了納米技術在免疫刺激和免疫抑制等領域的最新研究進展,包括在腫瘤免疫治療中用于免疫細胞活化、腫瘤微環境調控以及聯合其他抗腫瘤方法的納米系統和對抗病毒和細菌感染的基于納米材料的疫苗;同時也對納米材料在增強免疫抑制性免疫細胞治療炎癥和自身免疫性疾病時的作用進行了介紹;最后討論了納米技術在應用于免疫治療時面臨的挑戰和未來前景。
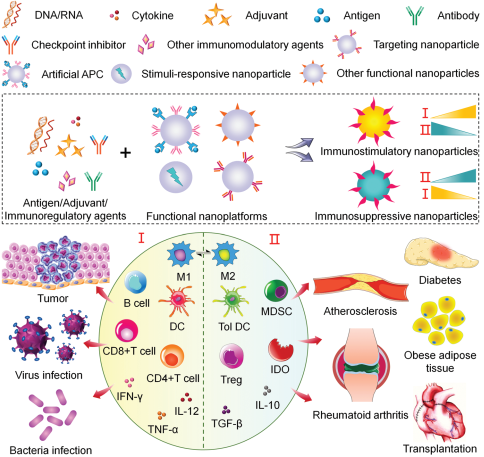
Xiangru Feng, Jianxun Ding, Xuesi Chen. et al. Immunomodulatory Nanosystems. Advanced Science. 2019
DOI: 10.1002/advs.201900101
https://doi.org/10.1002/advs.201900101
23. Small:金納米籠/簇混合結構用于多光譜光學成像、遞送EGFR抑制劑和光熱治療
金納米團簇(AuClusters)和金納米籠(AuNCs)是一類具有特殊光學性質的納米結構,而若將它們集成到一個納米系統中則可以實現更加強大的性能。華南理工大學曾鈁教授和吳水珠教授合作制備了一種用于熒光/光聲成像、藥物控釋和光熱治療(PTT)的混合金納米結構。實驗利用AuNCs對表皮生長因子受體(EGFR)抑制劑EB進行負載,隨后通過靜電相互作用將AuCluster@BSA偶聯物對其進偶聯功能化得到納米藥物EA-AB。其被細胞內化后,溶酶體蛋白酶和偏酸性pH會引起EA-AB中EB的釋放以及恢復AuCluster的熒光成像性能。而利用近紅外光照射后會進一步促進藥物的釋放,同時產生PTT效應,實現顯著的腫瘤抑制效果。
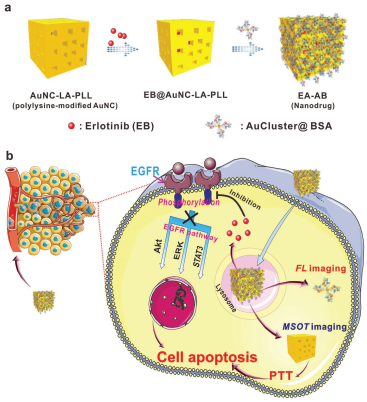
Chenyue Zhan, Fang Zeng, Shuizhu Wu. et al. A Gold Nanocage/Cluster Hybrid Structure for Whole-Body Multispectral Optoacoustic Tomography Imaging, EGFR Inhibitor Delivery, and Photothermal Therapy. Small. 2019
DOI: 10.1002/smll.201900309











