1. AM:可調(diào)親水-親脂平衡的兩親性納米顆粒的結(jié)構(gòu)穩(wěn)定性和腫瘤保留效果
親水-親脂平衡值(HLB)對兩親體的自組裝和其理化性質(zhì)及生物學(xué)效應(yīng)有著重要的影響。研究結(jié)果表明,HLB值適中的兩親性納米粒子(NPs)會具有較好的穩(wěn)定性和較高的腫瘤保留率。四川大學(xué)羅奎教授團隊合成了一系列帶有光敏劑的兩親化合物:G320P、G310P、G220P和G210P,并可以將它們的HLB值從6.1調(diào)整到9.9。分子動力學(xué)模擬表明,中等HLB值(8.0和7.8)的G320P和G210P可以自組裝成非常穩(wěn)定的NPs,具有較小的溶劑可及表面積和較高的非鍵合相互作用。具有中等HLB值(8.0)和長PEG鏈的G320P較其他NPs來說則具有更長的血液循環(huán)時間(13倍),進而可以更加有效地在腫瘤中累積并增強PDT的效率,腫瘤生長抑制率可達96.0%。這一研究說明通過合理設(shè)計HLB值適中的NPs可以為實現(xiàn)高水平的腫瘤保留提供幫助。
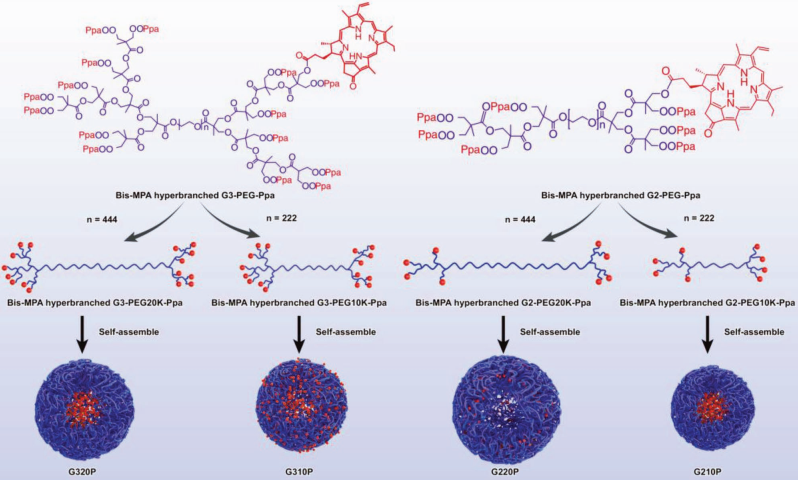
Xiuli Zheng, Kui Luo. et al. Tunable Hydrophile–Lipophile Balance for Manipulating Structural Stability and Tumor Retention of Amphiphilic
Nanoparticles. Advanced Materials. 2019
DOI: 10.1002/adma.201901586
https://doi.org/10.1002/adma.201901586
2. Adv. Sci.:細胞膜介導(dǎo)的生物特異性金屬離子轉(zhuǎn)運遞送
金屬離子在生物醫(yī)學(xué)中具有重要的應(yīng)用價值。武漢大學(xué)馮俊教授團隊報告了一種由細胞膜介導(dǎo)的金屬離子生物特異性轉(zhuǎn)運的新策略。細胞膜固有的生物功能使其在作為金屬離子載體時具有獨特的優(yōu)勢,例如良好的生物相容性,低免疫原性風險和特異性的生物靶向功能等等。實驗通過利用癌細胞膜在體內(nèi)去遞送各種金屬離子,包括釕、銪、鐵和錳等,證明其可以組成一系列具有光熱治療/成像、磁共振成像、光聲成像和熒光成像功能的腫瘤靶向納米雜化材料。此外,細胞膜的特殊結(jié)構(gòu)使得其可以很容易地去負載小分子藥物進而用于高效的化療。這一研究通過開發(fā)一類具有多種生物功能的,包含有金屬離子的納米材料,為解決金屬離子在體內(nèi)的靶向遞送這一難題提供了一種新的解決方案。
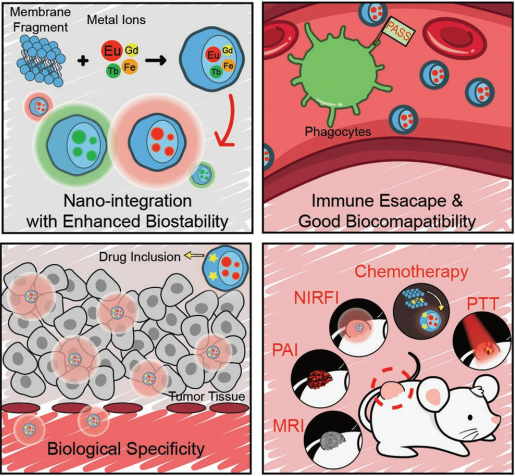
Ming-Kang Zhang, Jun Feng. et al. Cytomembrane-Mediated Transport of Metal Ions with Biological Specificity. Advanced Science. 2019
DOI: 10.1002/advs.201900835
https://doi.org/10.1002/advs.201900835
3. Small:利用ZIF-8對基因進行包封以實現(xiàn)其可視化及表達
近年來,MOF已被證明是一種可有效保護蛋白質(zhì)的材料。然而,對于核酸等其他生物大分子來說,將其封裝在納米MOFs內(nèi)及進行相關(guān)表征還處于起步階段。皇家墨爾本理工學(xué)院Ravi Shukla團隊設(shè)計了一個將完整的基因封裝在ZIF-8中的策略,并實現(xiàn)了該基因的細胞表達。實驗利用綠色熒光蛋白質(zhì)粒(plGFP)作為大分子基因,根據(jù)這一策略成功地對哺乳動物癌細胞進行了長達4天的plGFP轉(zhuǎn)染。細胞轉(zhuǎn)染和cryo-SXT實驗結(jié)果則充分證實了DNA@MOF生物復(fù)合材料作為細胞內(nèi)基因遞送載體的可行性。
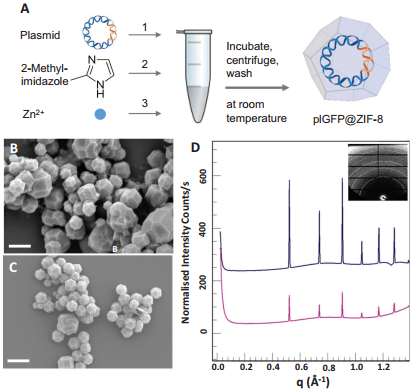
Arpita Poddar, Ravi Shukla. et al. Encapsulation, Visualization and Expression of Genes with Biomimetically Mineralized Zeolitic Imidazolate
Framework-8 (ZIF-8). Small. 2019
DOI: 10.1002/smll.201902268
https://doi.org/10.1002/smll.201902268
4. Chem. Soc. Rev.:具有高生物相容性的離子液體的基本行為和應(yīng)用
具有高生物相容性的離子液體(Bio-ILs)是一種生態(tài)友好型離子液體,其在電化學(xué)和生物醫(yī)學(xué)領(lǐng)域有著廣泛的應(yīng)用。目前,合成Bio-ILS的最佳策略是利用生物可再生資源的分子作為陰離子和陽離子的部分來構(gòu)建Bio- ILs結(jié)構(gòu)。人們對于Bio- ILs的性質(zhì)以及它們對環(huán)境和健康安全的影響也已經(jīng)進行了一定的研究。ICVS/3B’s – PT政府聯(lián)合實驗室Joana M. Gomes博士和Simone S. Silva博士合作綜述了生物Bio- ILs的合成策略以及它們的生態(tài)毒理學(xué)和生物學(xué)效應(yīng);對這些Bio- ILs在不同應(yīng)用領(lǐng)域中的應(yīng)用進行了討論;最后對這一領(lǐng)域的技術(shù)開發(fā)和改進提出了一些新的見解。
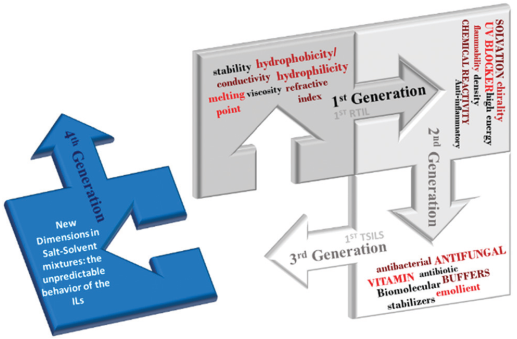
Joana M. Gomes, Simone S. Silva. et al. Biocompatible ionic liquids: fundamental behaviours and applications. Chemical Society Reviews. 2019
DOI: 10.1039/C9NH00291J
https://pubs.rsc.org/en/content/articlelanding/2019/nh/c9nh00291j#!divAbstract
5. ACS Nano:墨魚墨汁納米粒子可通過免疫-光熱協(xié)同治療抑制腫瘤生長
天然納米粒子因其性質(zhì)多樣、易獲取等特點而得到廣泛的研究。武漢大學(xué)張先正教授團隊和武漢大學(xué)人民醫(yī)院周龐虎博士團隊合作,對從墨魚的墨汁中提取的,具有顯著抗腫瘤作用的納米顆粒CINPs進行了系統(tǒng)研究。CINPs形態(tài)呈球形,分散性好,生物相容性高,富含黑色素并含有多種氨基酸和單糖。CINPs可通過活化絲裂原活化蛋白激酶(MAPK)信號通路有效地將腫瘤相關(guān)巨噬細胞(TAMs)從免疫抑制的M2表型轉(zhuǎn)變?yōu)榭鼓[瘤的M1表型。此外,在近紅外(NIR)照射下,CINPs也具有較高的光熱效應(yīng)和殺傷腫瘤細胞的能力,可作為一種出色的腫瘤光熱治療(PTT)藥物。在體內(nèi),CINPs可以增加M1巨噬細胞的比例并促進細胞毒性T淋巴細胞(CTLs)向腫瘤的富集,從而降低原發(fā)腫瘤的生長和進一步的肺轉(zhuǎn)移。通過光熱效應(yīng)和誘導(dǎo)腫瘤特異性抗原釋放,CINPs可高效抑制腫瘤生長并產(chǎn)生活躍的免疫反應(yīng),因此在腫瘤治療中具有廣闊的應(yīng)用前景。
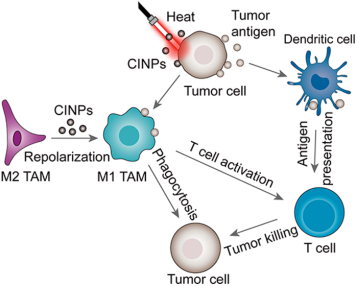
Rong-Hui Deng, Pang-Hu Zhou, Xian-Zheng Zhang. et al. Nanoparticles from Cuttlefish Ink Inhibit Tumor Growth by Synergizing Immunotherapy and Photothermal Therapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b02993
https://pubs.acs.org/doi/10.1021/acsnano.9b02993
6. Small:聚甘油功能化的納米金剛石偶聯(lián)染料后用于腫瘤的近紅外熒光成像
納米粒子在腫瘤中的特異性積累通常是通過主動靶向和被動靶向的聯(lián)合作用實現(xiàn)的。然而,基于EPR效應(yīng)的被動靶向往往在大多數(shù)荷瘤小鼠模型上都不足以實現(xiàn)清晰的腫瘤熒光成像。京都大學(xué)Naoki Komatsu教授團隊和蘇州大學(xué)趙利博士團隊合作合成了一種聚甘油功能化的納米金剛石(ND-PG)并將其與氰基染料(Cy7)偶聯(lián)得到ND-PG-Cy7。體內(nèi)外熒光成像結(jié)果表明,該材料在腫瘤中具有良好的富集效果,其中一個原因在于ND-PG-Cy7的體內(nèi)血液循環(huán)時間較長(半衰期為58 h),而其他納米顆粒的半衰期在以前的大多數(shù)報道中都小于20 h。得益于此,在注射后一周甚至更久后,腫瘤的熒光強度仍在增加,說明ND-PG-Cy7在腫瘤中的連續(xù)積累。這是因為之前的研究報道表明PG具有“隱身”的作用,可以有效避免被肝臟和脾臟中豐富的網(wǎng)狀內(nèi)皮細胞捕獲,進而實現(xiàn)基于EPR效應(yīng)的高效腫瘤攝取。
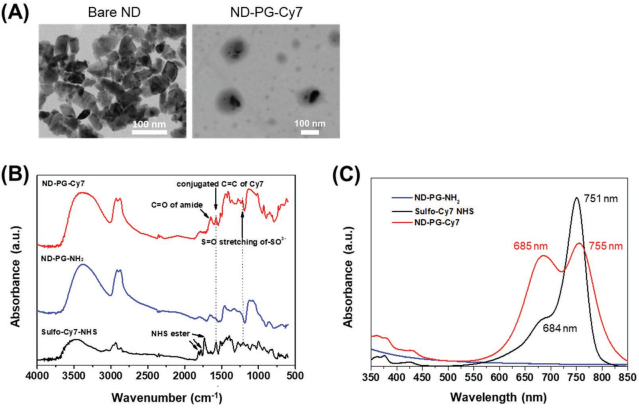
Fumi Yoshino, Li Zhao, Naoki Komatsu. et al. Preferential Tumor Accumulation of Polyglycerol Functionalized Nanodiamond Conjugated with Cyanine Dye Leading to Near-Infrared Fluorescence In Vivo Tumor Imaging. Small. 2019
DOI: 10.1002/smll.201901930
https://doi.org/10.1002/smll.201901930
7. Nature Nanotech.:酶激活的聚合物藥物偶聯(lián)物可增強腫瘤穿透和治療效果
腫瘤微環(huán)境對分子的被動擴散會產(chǎn)生障礙,使得藥物在腫瘤中的穿透成為抗癌藥物遞送的一大難題。浙江大學(xué)申有青教授團隊和美國加州大學(xué)洛杉磯分校顧臻教授團隊合作提出一個對γ-谷氨酰轉(zhuǎn)肽酶響應(yīng)的聚合物-喜樹堿偶聯(lián)物,它可以通過轉(zhuǎn)胞吞作用浸潤整個腫瘤組織。當偶聯(lián)物通過腫瘤血管內(nèi)皮細胞或滲出作用進入腫瘤間質(zhì)后,細胞膜上過表達的γ-谷氨酰轉(zhuǎn)肽酶可以使得偶聯(lián)物的γ-谷酰基發(fā)生斷裂并生成帶正電的一級胺。由此產(chǎn)生的陽離子偶聯(lián)物會由細胞膜穴樣內(nèi)陷介導(dǎo)的內(nèi)吞和外吞作用來進行跨細胞和細胞外轉(zhuǎn)運以實現(xiàn)其在腫瘤內(nèi)的均勻分布。實驗結(jié)果證明,該偶聯(lián)物具有很好的抗腫瘤活性,可以有效根除小型固體腫瘤(~ 100 mm3)并抑制大型腫瘤 (~ 500 mm3)的生長,進而可以顯著延長荷原位胰腺癌腫瘤小鼠的生存時間。
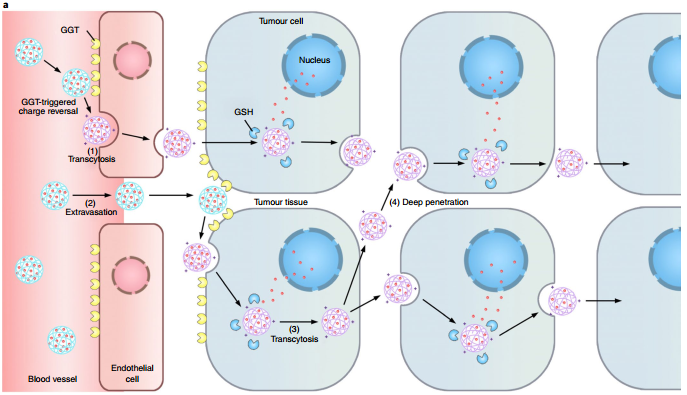
Quan Zhou, Zhen Gu?, Youqing Shen. et al. Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy. Nature Nanotechnology. 2019
https://doi.org/10.1038/s41565-019-0485-z
8. Small綜述:微流控技術(shù)合成納米材料用于生物醫(yī)學(xué)應(yīng)用
納米材料(NMs)具有眾多出色的物理化學(xué)性質(zhì),這些性質(zhì)往往與NMs特殊的尺寸和形貌密切相關(guān)。得益于這些獨特的理化性質(zhì),NMs在藥物遞送、生物傳感、生物成像和組織工程等領(lǐng)域的應(yīng)用正越來越普遍。通過選擇合適的方法對反應(yīng)條件進行精確控制,不僅可以快速生成高質(zhì)量的NMs,而且可以設(shè)計出用于納米醫(yī)學(xué)診療的復(fù)合產(chǎn)品。其中,微流控技術(shù)為在微尺度通道中通過簡單操作合成納米復(fù)合材料提供了一個重要的平臺。東南大學(xué)李玲教授和趙遠錦教授合作綜述了對用于制備納米顆粒和納米纖維兩大類納米材料的微流控技術(shù)的研究進展及其在生物醫(yī)學(xué)領(lǐng)域的應(yīng)用前景,并對這一研究今后面臨的主要挑戰(zhàn)和發(fā)展方向提出了新的意見。
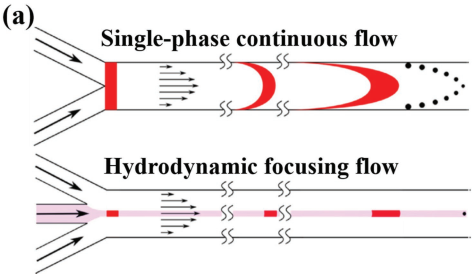
Xin Zhao, Ling Li, Yuanjin Zhao. et al. Microfluidic Generation of Nanomaterials for Biomedical Applications. Small. 2019
DOI: 10.1002/smll.201901943
https://doi.org/10.1002/smll.201901943
9. Nanoscale Horizons綜述:納米仿生技術(shù)用于心血管疾病的診療
心血管疾病(CVD)包括許多會影響心臟和血管的疾病,是現(xiàn)代醫(yī)療所面臨的一大重要挑戰(zhàn)。研究表明,由近三分之一的人患有不同形式的CVD,其中許多人還患有多種相互影響的疾病,最終往往導(dǎo)致心臟病發(fā)作或中風等嚴重后果。即使在發(fā)達國家,心血管疾病也仍然是導(dǎo)致死亡的主要原因之一。最近,許多研究人員探索了利用納米技術(shù)以對目前臨床治療CVD的策略進行改進。納米級給藥系統(tǒng)具有許多優(yōu)點,包括可靶向病變部位、提高藥物生物利用度和遞送多功能載荷的能力等等。加州大學(xué)圣地亞哥分校Ronnie H. Fang博士和張良方教授合作綜述了納米材料技術(shù)在CVD診療領(lǐng)域中的應(yīng)用,對開發(fā)具有增強功能的新型仿生平臺進行了詳細的討論。
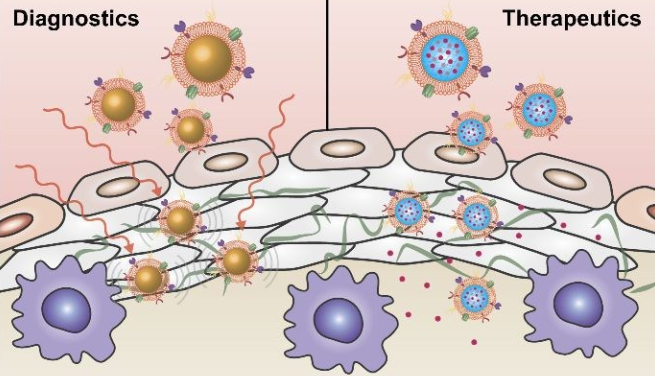
Joon Ho Park, Diana Dehaini, Ronnie H. Fang, Liangfang Zhang. et al. Biomimetic nanoparticle technology for cardiovascular disease detection and treatment. Nanoscale Horizons. 2019
DOI: 10.1039/C9CS00016J
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00016j#!divAbstract
10. AM綜述:仿生二維納米材料及其應(yīng)用
開發(fā)具有良好性能和特定功能的仿生材料是實現(xiàn)生態(tài)文明和社會可持續(xù)發(fā)展的重要環(huán)節(jié)。所謂仿生,就是將科學(xué)和自然結(jié)合起來,充分學(xué)習(xí)自然物種的獨特優(yōu)勢,進而制備出許多具有非凡性能的新材料。在目前,仿生二維納米材料及相關(guān)技術(shù)也已經(jīng)取得了一系列顯著的成就。澳大利亞昆士蘭科技大學(xué)Ziqi Sun博士團隊對近十年來仿生二維光子晶體材料、能源類納米材料和超潤濕材料的研究進展進行了綜述;也對用于可持續(xù)能源應(yīng)用和環(huán)境技術(shù)的仿生材料及該領(lǐng)域所面臨的挑戰(zhàn)和機遇進行了介紹。

Yuanwen Zhang, Ziqi Sun. et al. Bioinspired 2D Nanomaterials for Sustainable Applications. Advanced Materials. 2019
DOI: 10.1002/adma.201902806
https://doi.org/10.1002/adma.201902806
11. AM:3D打印制備具有優(yōu)異的剛度和彈性的仿生多級石墨烯材料
具有多級結(jié)構(gòu)的生物材料為設(shè)計和制備具有優(yōu)異的力學(xué)性能和低密度的仿生材料提供了新的策略。然而,大多數(shù)的傳統(tǒng)仿生材料只能利用生物材料的單一尺度,這也在很大程度上限制了其最終的力學(xué)性能。蘇州大學(xué)梁志強博士、江林教授和馬里蘭大學(xué)帕克分校Teng Li教授合作提出了一種基于墨水的3D打印策略,并將其用于制備具有超高剛度和彈性的超輕多級石墨烯 (BHGMs)材料。該BHGMs可以在高達95%的壓縮力下保持超高的彈性和穩(wěn)定性。研究表明,BHGMs的分層多級結(jié)構(gòu)可以有效地降低宏觀壓力,并將微觀的壓縮形變轉(zhuǎn)化為石墨烯片的旋轉(zhuǎn)和彎曲。這種3D打印策略也有望可以將其他功能材料組裝成多級細胞結(jié)構(gòu),具有非常廣闊的應(yīng)用潛力和價值。
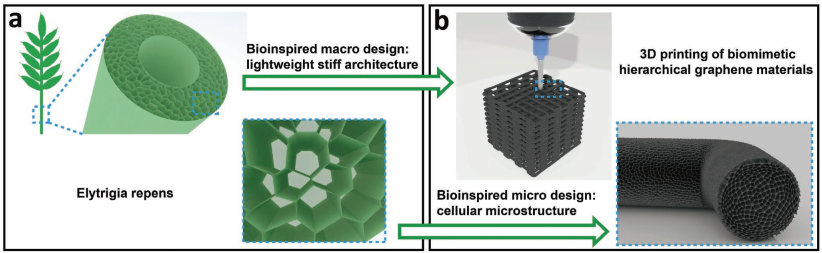
Meiwen Peng, Zhiqiang Liang, Teng Li, Lin Jiang. et al. 3D Printing of Ultralight Biomimetic Hierarchical Graphene Materials with Exceptional Stiffness and Resilience. Advanced Materials. 2019
DOI: 10.1002/adma.201902930
https://doi.org/10.1002/adma.201902930
12. AM:利用對環(huán)境敏感的水凝膠生物材料去遞送位點特異性修飾蛋白
控制蛋白質(zhì)在材料中的表達在許多生物工程的應(yīng)用中具有重要意義。雖然目前已有一些平臺可以根據(jù)某種單一的外部條件來控制蛋白質(zhì)的釋放,但是要實現(xiàn)對指定環(huán)境敏感的釋放以及控制同一材料中多個物種的釋放還缺乏相應(yīng)的有效策略。華盛頓大學(xué)Cole A. DeForest教授團隊提出了一種模塊化半合成策略來控制位點特異性修飾蛋白的釋放。實驗利用分選酶介導(dǎo)的轉(zhuǎn)位反應(yīng)來生成重組蛋白C,并通過對環(huán)境敏感的可降解連接劑將其連接在凝膠的末端。結(jié)果發(fā)現(xiàn),通過改變這些連接物中多個刺激響應(yīng)分子的連接性,可以實現(xiàn)多種環(huán)境條件控制的蛋白釋放。而若將多種蛋白通過不同的刺激敏感連接劑連接在一起,則可以在一種材料中實現(xiàn)多種蛋白獨立而有序地釋放。這一研究工作也為組織工程和治療藥物的遞送提供了一個重要的新策略。
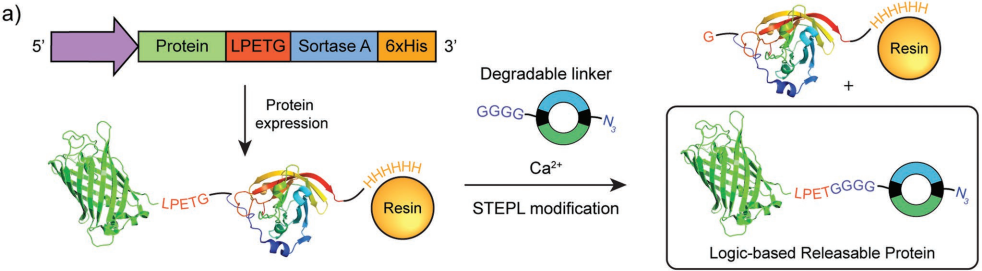
Prathamesh Milind Gawade, Cole A. DeForest. et al. Logic-Based Delivery of Site-Specifically Modified Proteins from Environmentally Responsive Hydrogel Biomaterials. Advanced Materials. 2019
DOI: 10.1002/adma.201902462
https://doi.org/10.1002/adma.201902462
13. AM:用于病人特異性治療的生物混合材料
精準醫(yī)學(xué)的實現(xiàn)需要開發(fā)出能夠感知和適應(yīng)動態(tài)的生理和病理條件的材料及設(shè)備,其中就包括可以對環(huán)境刺激進行響應(yīng)的生物混合材料。通常來說,設(shè)計生物混合材料有兩種方法:仿生和生物集成。例如生物混合水凝膠,它既可以模擬自然材料的形式和功能,也可以通過集成活細胞或其他生物活性部分來實現(xiàn)對一系列環(huán)境刺激(熱、光、pH、水合作用、酶、電、機械和磁力等等)的響應(yīng)。在目前,個性化醫(yī)療治療是一個不斷擴大和發(fā)展的市場,生物混合材料所具有的獨特性能,使其可以配合病人體內(nèi)具體環(huán)境做出動態(tài)變化,從而實現(xiàn)更有效和安全的治療。麻省理工學(xué)院Ritu Raman博士和Robert Langer教授通過介紹一系列的實例,說明了生物混合材料這一新興學(xué)科的巨大潛力,并概述了與這些材料的制備、存儲、遞送和非侵入性控制相關(guān)的技術(shù)挑戰(zhàn)以及臨床轉(zhuǎn)化所面臨的諸多問題。
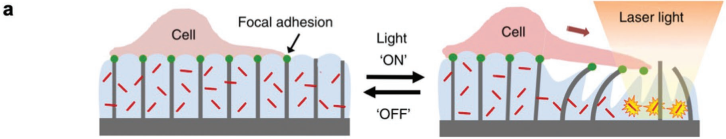
Ritu Raman, Robert Langer. Biohybrid Design Gets Personal: New Materials for Patient-Specific Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201901969
https://doi.org/10.1002/adma.201901969
14. AM:連接靶向肽的融合原性多孔硅納米顆粒用于遞送siRNA
已有研究表明,核糖核酸干擾療法具有很好的應(yīng)用前景。但是如何將寡核苷酸選擇性地遞送到身體的病變組織特別是可以實現(xiàn)最佳治療結(jié)果的組織細胞位置仍然是一個很大的難題。加州大學(xué)圣地亞哥分校Michael J. Sailor教授團隊對遞送小干擾RNA (siRNA)以實現(xiàn)靶細胞沉默的材料的關(guān)鍵特性及其生物學(xué)機制進行了研究。實驗以多孔硅納米顆粒作為siRNA的宿主載體,通過連接腫瘤靶向肽使其可以選擇性地進入目標組織,再利用包裹的融合原性脂質(zhì)體誘導(dǎo)其與細胞膜發(fā)生融合。因此該載體可以不依靠常見的受體介導(dǎo)的內(nèi)吞途徑來被細胞攝取。研究利用異種移植卵巢癌腹膜癌擴散模型證明了這一策略的有效性,充分說明其具有高效的遞送siRNA的性能進而可以實現(xiàn)基因沉默和治療,具有很好的臨床應(yīng)用前景。
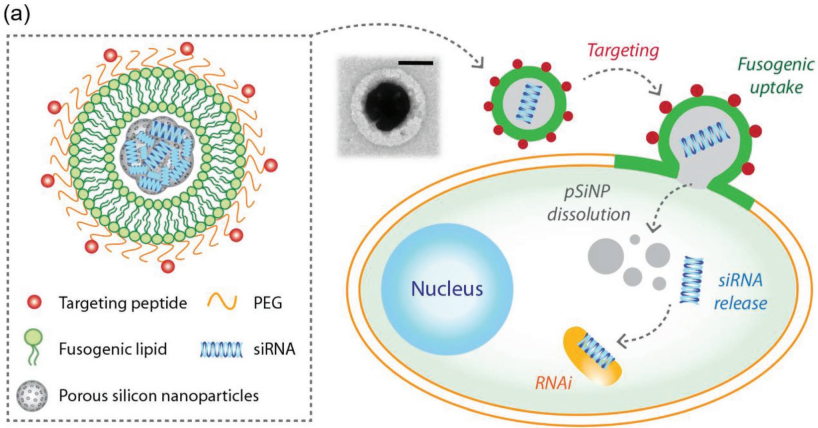
Byungji Kim, Michael J. Sailor. et al. Securing the Payload, Finding the Cell, and Avoiding the Endosome: Peptide-Targeted, Fusogenic Porous Silicon
Nanoparticles for Delivery of siRNA. Advanced Materials. 2019
DOI: 10.1002/adma.201902952
https://doi.org/10.1002/adma.201902952
15. AM綜述:作為活細胞的胞內(nèi)探針的核酸平臺
細胞在分子水平上的化學(xué)成分決定了它們的生長、分化、結(jié)構(gòu)和最終的功能。而對這類成分進行檢測分析則可以幫助人們了解細胞內(nèi)部的化學(xué)過程,并有望實現(xiàn)基于分子水平的疾病診斷。近年來,核酸探針已被證明是一種很有應(yīng)用前途的平臺,可以在單細胞分辨率下檢測多種活細胞內(nèi)的分析物。美國西北大學(xué)Chad A. Mirkin教授團隊對這一領(lǐng)域的最新研究進展進行了介紹,對探針設(shè)計的常用策略、靶點的類型、目前的局限性和未來的發(fā)展方向進行了詳細介紹。
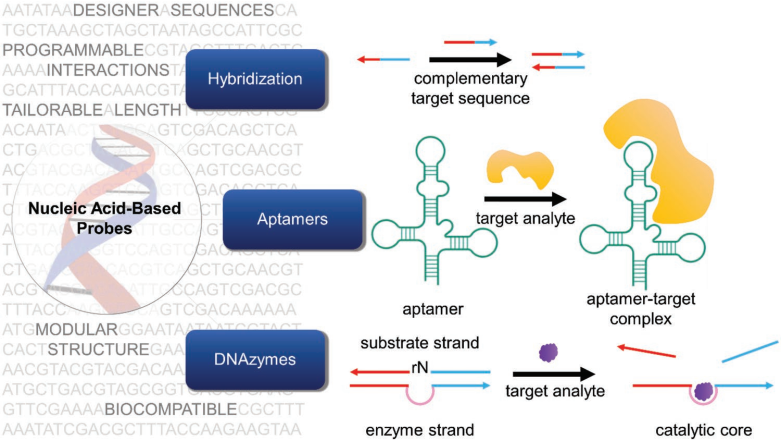
Devleena Samanta, Chad A. Mirkin. et al. Nucleic-Acid Structures as Intracellular Probes for Live Cells. Advanced Materials. 2019
DOI: 10.1002/adma.201901743
https://doi.org/10.1002/adma.201901743
16. JACS:響應(yīng)性磁共振成像造影劑用于在體內(nèi)檢測Cu2+
德州大學(xué)達拉斯分校A. Dean Sherry團隊設(shè)計合成了一種新型釓基銅響應(yīng)性磁共振造影劑GdL1,并對其性能進行了研究。GdL1對銅離子具有很高的選擇性,其在緩沖液中與1當量的Cu2+的結(jié)合后的 r1弛豫率(20mhz)會提高43%。而在正常的人血清白蛋白(HSA)生理水平情況下,其r1的弛豫率還會進一步提高270%。研究結(jié)果表明,Cu2+會與GdL1側(cè)鏈上的兩個羧基和單胺基配位,隨后與HSA形成三元絡(luò)合物(GdL1?Cu2+?HSA)。體內(nèi)T1加權(quán)成像表明,GdL1可以在活鼠體內(nèi)檢測到內(nèi)源性的不穩(wěn)定Cu2+。因此,這一工作也為探索和研究Cu2+在神經(jīng)系統(tǒng)疾病的發(fā)生和發(fā)展中的作用提供了一個新的策略。
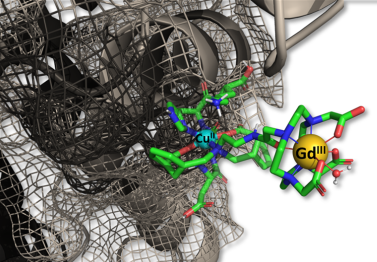
Namini N. Paranawithana, A. Dean Sherry. et al. A Responsive Magnetic Resonance Imaging Contrast Agent for Detection of Excess Copper(II) in the Liver In Vivo. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.8b13493
https://pubs.acs.org/doi/10.1021/jacs.8b13493
17. Angew:新的光-分子相互作用的發(fā)現(xiàn)助力熒光成像的研究
目前,人們對于光-分子之間的相互作用的理解是很有限的。華盛頓州立大學(xué)Alexander D. Q. Li教授團隊報道了一種新的現(xiàn)象,即發(fā)射光子的能量要大于吸收光子的能量,額外的能量則來自于被吸收和發(fā)射的光子與分子聲子的耦合作用,而分子聲子的勢能會不斷地與分子量子的能量以及環(huán)境進行交換。這一現(xiàn)象也是一種線性的光學(xué)過程。由于該現(xiàn)象會導(dǎo)致分子聲子冷卻,從而使分子冷卻,因此會出現(xiàn)與預(yù)期的熱熒光發(fā)射相反的行為。
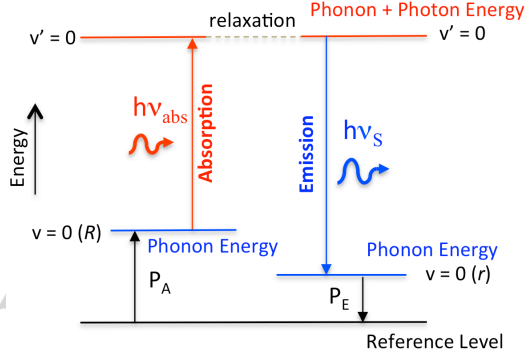
Wei Wan, Alexander D. Q. Li. The discovery of a new light-molecule interaction: Supracence reveals what are missing in fluorescence imaging. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201906499
http://dx.doi.org/10.1002/anie.201906499
18. Adv. Sci.:MOF衍生的碳納米結(jié)構(gòu)用于位點特異性的光熱/光動力血栓治療
盡管近紅外(NIR)光介導(dǎo)的光熱血栓治療可以有效克服臨床溶栓的風險問題,但是在光熱治療之后產(chǎn)生的二次栓塞也同樣十分棘手。首都醫(yī)科大學(xué)宣武醫(yī)院楊旗教授團隊和北京化工大學(xué)劉惠玉教授團隊合作探索了利用靶向納米材料進行雙模態(tài)光熱/光動力血栓治療的策略。該納米材料可以主動靶向血栓上的糖蛋白IIb/IIIa受體,并在NIR光照射下通過光熱效應(yīng)和產(chǎn)生活性氧來進行位點特異性的溶栓治療。在下肢血栓模型中,與單次光熱溶栓的治療效果相比,該雙模態(tài)溶栓治療的效果會更好。并且該策略也可有效避免二次栓塞的形成,是一種非常安全高效的溶栓方案,具有良好的臨床轉(zhuǎn)化前景。
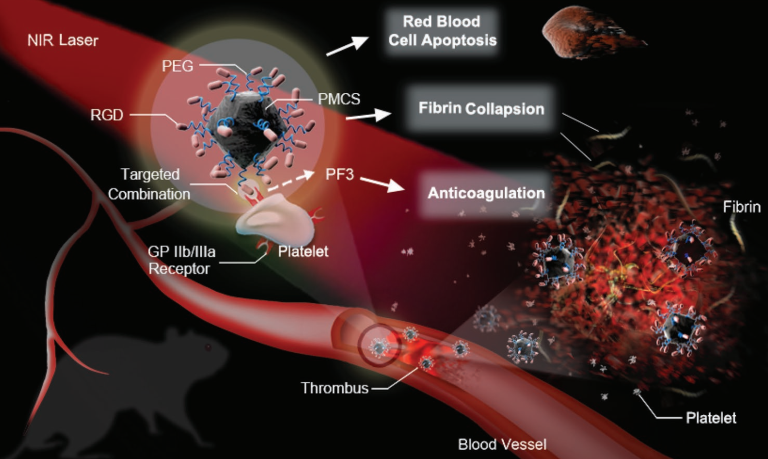
Fengrong Zhang, Huiyu Liu, Qi Yang. et al. Metal–Organic-Framework-Derived Carbon Nanostructures for Site-Specific Dual-Modality Photothermal/Photodynamic Thrombus Therapy. Advanced Science. 2019
DOI: 10.1002/advs.201901378
https://doi.org/10.1002/advs.201901378
19. Accounts Chem. Res.:納米酶的概念、機理、標準及其應(yīng)用
納米酶是一種具有類酶特性的納米材料。由于其可以解決天然酶的不足,如穩(wěn)定性差、成本高、不易儲存等問題,因此在過去十年中得到了蓬勃發(fā)展。隨著納米科學(xué)技術(shù)的快速發(fā)展,納米酶也有望直接替代傳統(tǒng)酶用于生產(chǎn)和研究。目前,已有數(shù)百種納米材料被發(fā)現(xiàn)具有類過氧化物酶、氧化酶、過氧化氫酶、水解酶和超氧化物歧化酶等等多樣的催化活性,有些納米材料還能同時具有雙酶甚至多酶的活性。隨著納米酶學(xué)這一新概念的出現(xiàn),納米酶已成為連接納米技術(shù)和生物學(xué)的一個重要橋梁。它具有獨特的理化性質(zhì)和類酶催化活性,可以發(fā)展成為多種多功能平臺,進而在體外檢測和體內(nèi)監(jiān)測及治療等領(lǐng)域有著廣泛的應(yīng)用前景。中科院生物物理研究所梁敏敏博士和閻錫蘊院士合作介紹了關(guān)于功能特異性納米酶的設(shè)計與構(gòu)建、納米酶研究的標準化以及納米酶在生物系統(tǒng)中替代天然酶的應(yīng)用研究進展;并在最后對納米酶的研究前景進行了展望。
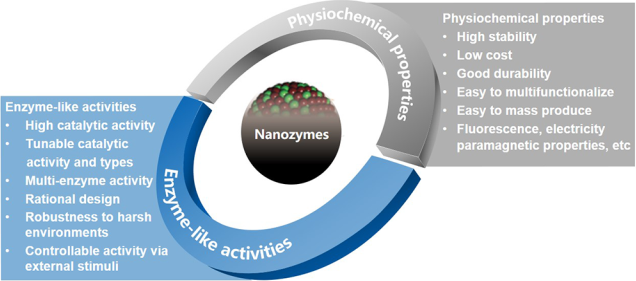
Minmin Liang, Xiyun Yan. Nanozymes: From New Concepts, Mechanisms, and Standards to Applications. Accounts of Chemical Research. 2019
DOI: 10.1021/acs.accounts.9b00140
https://pubs.acs.org/doi/10.1021/acs.accounts.9b00140
20. ACS Nano:調(diào)節(jié)自噬的納米激活劑對樹突狀細胞進行原位調(diào)控以實現(xiàn)免疫治療
細胞免疫療法的目的是將免疫細胞作為抗癌的藥物。例如通過對樹突狀細胞(DCs)進行調(diào)節(jié),可以產(chǎn)生特異性的抗腫瘤效應(yīng)從而實現(xiàn)腫瘤的消除。然而,目前直接在體內(nèi)激活DCs的策略的效率往往很低。國家納米科學(xué)中心王浩團隊設(shè)計了一種納米激活劑,它可以通過在體內(nèi)上調(diào)自噬來直接操控DCs,從而產(chǎn)生高效的DCs抗原表達和抗原特異性T細胞的生成。該納米激活劑可顯著增強腫瘤抗原的交叉表達和隨后的T細胞啟動。體內(nèi)實驗結(jié)果表明,該納米激活劑可以成功地抑制腫瘤的生長,從而延長小鼠的生存時間。
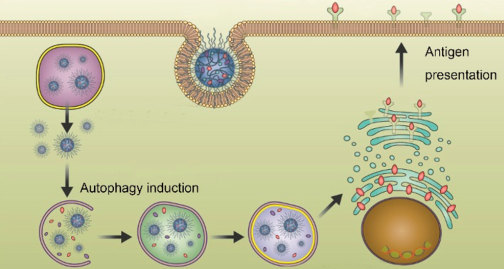
Yi Wang, Hao Wang. et al. In Situ Manipulation of Dendritic Cells by an
Autophagy-Regulative Nanoactivator Enables Effective Cancer Immunotherapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00143
https://pubs.acs.org/doi/10.1021/acsnano.9b00143
21. ACS Nano:可生物降解的膽綠素納米顆粒用于高效的光聲成像
光聲成像是一種具有較高組織穿透深度的成像模式。而用于光聲成像的、可生物降解的納米顆粒卻是非常少見的。伊利諾伊大學(xué)Jefferson Chan團隊和Dipanjan Pan團隊合作利用納米沉淀法制備出膽綠素納米顆粒,這是一種可生物降解的光聲成像探針。實驗發(fā)現(xiàn),與在2-(N-嗎啉)乙磺酸緩沖液中合成的納米粒子相比,在水中或在含有氯化鈉的水中合成的納米粒子會具有更高的吸光度和更低的熒光。并且這些納米粒子在365和680納米處都表現(xiàn)出高吸光度。其在近紅外波段被激發(fā)后會產(chǎn)生很強的光聲信號,而在紫外波段被激發(fā)則會產(chǎn)生熒光發(fā)射。小鼠體內(nèi)的光聲成像實驗表明,納米粒子會在淋巴結(jié)中有效積累因此其可以作為前哨淋巴結(jié)檢測的光聲試劑。質(zhì)譜研究則發(fā)現(xiàn)該納米粒子在膽綠素還原酶的作用下會被完全地生物降解,而膽綠素還原酶是一種在人體中普遍存在的酶,這也使其成為一種具有良好生物相容性的生物成像平臺。
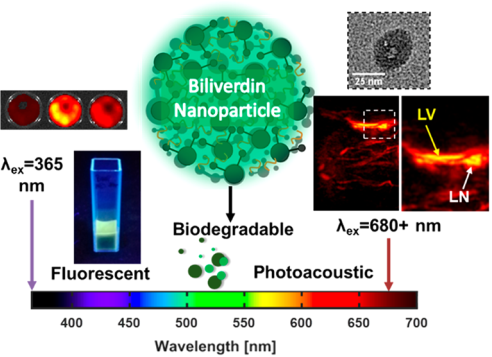
Parinaz Fathi, Jefferson Chan, Dipanjan Pan. et al. Biodegradable Biliverdin Nanoparticles for Efficient Photoacoustic Imaging. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01201











