1. Nano Lett.:基于黑磷的多模態納米材料用于靶向聯合治療癌癥轉移
開發精確靶向的多功能納米藥物以實現有效的乳腺癌腫瘤治療(尤其是轉移性腫瘤)仍然是一個很大的挑戰。中科院環境生態研究中心劉思金團隊和中科院深圳先進技術研究院喻學鋒團隊合作,成功地設計并合成了一種多功能的基于黑磷(BP)的納米材料BP/DTX@ PLGA以解決這一難題。實驗將BP量子點(BPQDs)負載到PLGA中,并與化療藥物多西紫杉醇(DTX)進行偶聯。體內分布結果表明,BP/DTX@PLGA對原發性腫瘤和肺轉移瘤均有很好的靶向性。此外,BP/DTX@PLGA也具有出色的化學-光熱聯合治療性能,其在近紅外光照射下可以有效的治療腫瘤。而光熱效應也會加速DTX從納米復合物中的釋放,協同地導致程序性細胞死亡,從而消除肺轉移瘤。體內外實驗結果均證實BP/DTX@PLGA具有良好的生物相容性。因此,這一研究為抑制腫瘤及其轉移提供了一種很有前途的BP基多模態納米藥物。
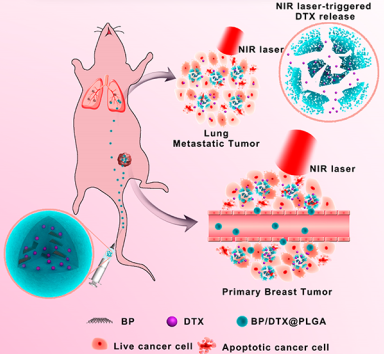
Shunhao Wang, Xue-Feng Yu, Sijin Liu. et al. Black Phosphorus-Based Multimodal Nanoagent: Showing Targeted Combinatory Therapeutics against Cancer Metastasis. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02127
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02127
2. Nano Lett.:增強氧化損傷和抑制MTH1可提高腫瘤光動力治療的效果
腫瘤細胞會通過啟動核苷酸池消毒酶突變同源體1 (MTH1)等DNA損傷修復機制來適應活性氧(ROS)的攻擊以減輕氧化誘導的DNA損傷,這也極大地限制了光動力治療的效果。武漢大學張先正教授團隊提出了一種放大氧化損傷的腫瘤治療策略,該方法不僅致力于增強ROS的生成,而且可以抑制隨后的MTH1酶活性。實驗制備了介孔硅包覆的普魯士藍納米材料 (PB@MSN),其具有很好的過氧化氫酶活性和藥物負載能力,可以用來封裝MTH1的抑制劑TH287,并最終利用作為光動力治療試劑和熒光成像造影劑的四苯基卟啉鋅(Zn-Por)對其進行修飾得到PMPT材料。PMPT納米系統可以誘導H2O2的分解來緩解腫瘤乏氧,從而提高單線態氧的生成以增強氧化損傷;同時也會釋TH287來阻礙MTH1介導的DNA損傷修復過程,從而顯著提高光動力治療的效果。
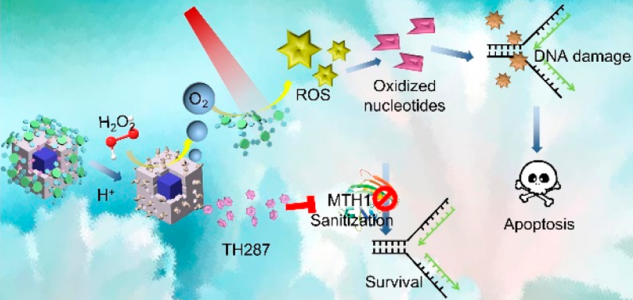
Jing-Jing Hu, Xian-Zheng Zhang. et al. Augment of Oxidative Damage with Enhanced Photodynamic Process and MTH1 Inhibition for Tumor Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02112
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02112
3. ACS Nano:可穿戴的皮膚狀人工石墨烯喉嚨
大多數的說話障礙者都是由于聲帶受損而不能正常說話。清華大學田禾博士、楊軼博士、任天令教授合作提出了一種可穿戴的皮膚狀超靈敏人工石墨烯喉嚨 WAGT。由于具有皮膚狀的結構和低阻抗的基底,WAGT的檢測靈敏度很高,其發聲能力也可高達75分貝(0.38 W的功率;2毫米的距離)。研究也對WAGT的聲音檢測和發聲機理進行了討論。實驗結果表明,WAGT可以檢測到人類不同的運動,如不同強弱程度的喉運動并可將其轉化為OK和NO等不同的聲音。這些聲/運動檢測聲學系統使得WAGT能夠實現從設備級應用到系統級應用的轉變,并且由于其小而輕,因此它也有著良好的可穿戴性能。
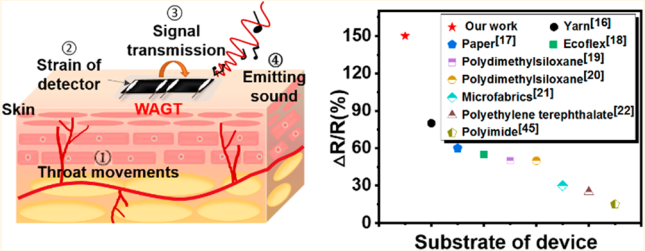
Yuhong Wei, He Tian, Yi Yang, Tian-Ling Ren. et al. A Wearable Skinlike Ultra-Sensitive Artificial Graphene Throat. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03218
https://pubs.acs.org/doi/10.1021/acsnano.9b03218
4. Angew:基于時間分辨的鑭系發光納米探針用于檢測全血中的循環腫瘤細胞
精確檢測血液中的循環腫瘤細胞(CTCs)對早期癌癥診斷和腫瘤轉移的評估至關重要。中科院福建物構所宋曉榮博士、陳學元研究員和陳卓研究員合作研制了一種基于時間分辨的鑭系發光納米探針,并將其作為超敏檢測血液CTCs的平臺。該納米探針可以特異性識別癌細胞上高表達的上皮細胞粘附分子,并使得信號通過時間分辨的光致發光(TRPL)進行放大。由于每個細胞中鑭系離子的標記率較高,并且TRPL可以消除短暫的自發熒光,因此這種方法可以直接用于檢測乳腺癌細胞,其檢測限為每孔1個細胞。研究結果表明,該探針可以在癌癥患者的血液中檢測血CTCs,檢出率為93.9%。由于CTC的水平與癌癥分期密切相關,因此該方法在監測癌癥進展方面具有重要的意義,同時也可以為早期的癌癥診斷和預后提供有效的新策略。
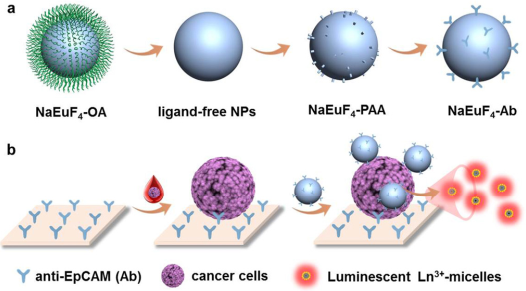
Hanhan Guo, Xiaorong Song, Xueyuan Chen, Zhuo Chen. et al. Direct Detection of Circulating Tumor Cells in Whole Blood Based on Time-Resolved Luminescent Lanthanide Nanoprobes.
DOI: 10.1002/anie.201907605
https://onlinelibrary.wiley.com/doi/10.1002/anie.201907605
5. AFM:CEST MRI和雙色近紅外成像對復合水凝膠支架的降解進行體內成像
干細胞水凝膠支架是克服細胞移植后細胞丟失和調控細胞功能的一種有效方法。而基質降解則是下游細胞分化和功能組織整合的必要條件,也決定了最終的治療效果。因此,監測水凝膠的降解對于支架細胞替代治療來說至關重要。約翰霍普金斯大學醫學院Jeff W. M. Bulte團隊研究表明,化學交換飽和轉移磁共振成像(CEST MRI)可以作為一種無標記的成像模式來監測含有明膠和透明質酸(HA)的交聯水凝膠的降解,通過改變明膠和HA的比例可以調節水凝膠的剛度。實驗進一步利用兩種不同發射頻率的近紅外(NIR)染料對明膠和HA進行標記,證明了HA的信號在42天內會保持穩定,而明膠的信號則逐漸下降到初始值的25%。結果表明,CEST MRI和近紅外熒光成像這兩種成像方式在時間進程和相對值方面也有著很好的一致性(R2 = 0.94)。
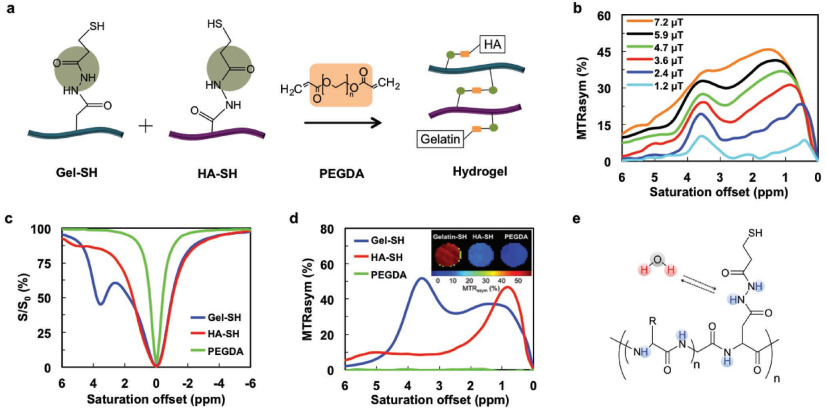
Wei Zhu, Jeff W. M. Bulte. et al. In Vivo Imaging of Composite Hydrogel Scaffold Degradation Using CEST MRI and Two-Color NIR Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903753
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903753
6. ACS Nano:負載舒尼替尼的綠色茶基膠束納米復合物的載體增強抗癌效果
納米載體用于癌癥治療的一個主要的缺點是載藥量低所導致的療效不足,因此需要增加劑量或給藥頻率,但是這也會增加載體的治療毒性。而增加載藥量也會導致納米載體的穩定性下降,進而導致療效低下和藥物脫靶造成的毒性。因此,藥物與載體的比例問題就成為了納米載體發展的一大挑戰。新加坡生物工程與納米科技研究院Min-Han Tan博士和Motoichi Kurisawa博士合作,以聚乙二醇偶聯的表沒食子兒茶素-3- O-沒食子酸酯(PEG-EGCG)為載體,利用其去負載舒尼替尼(SU)構建了膠束納米復合物(SU-MNC)。與口服或靜脈注射SU相比,SU-MNC對人腎細胞癌異種移植小鼠模型具有更強的抗癌作用和更低的毒性,對腫瘤也具有更有效的抗血管生成、凋亡誘導和增殖抑制等作用。而相比之下,由PEG-b-聚乳酸(PEG-PLA)共聚物組成的傳統納米載體聚合物膠束SU-PM盡管有著與SU-MNC相當的載藥率和靶向腫瘤效率,但是其僅僅降低了毒性卻沒有提高療效。而SU-MNC除了可以靶向給藥外,還可通過藥物-載體的高效協同作用來顯著地提高療效。
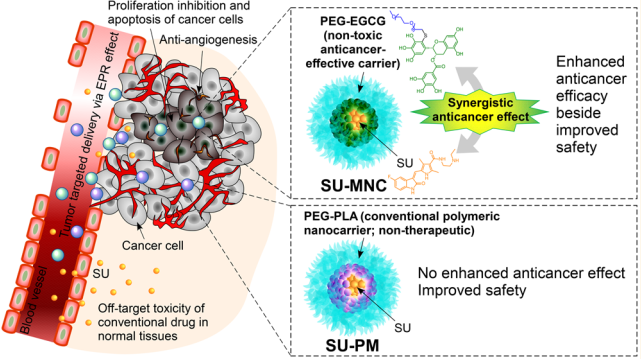
Nunnarpas Yongvongsoontorn, Min-Han Tan, Motoichi Kurisawa. et al. Carrier-Enhanced Anticancer Efficacy of Sunitinib-Loaded Green Tea-Based Micellar Nanocomplex beyond Tumor-Targeted Delivery. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00467
https://pubs.acs.org/doi/10.1021/acsnano.9b00467
7. Angew:有機半導體納米刺激劑用于近紅外光激活的癌癥免疫治療
免疫治療在對抗惡性腫瘤的臨床治療中表現出良好的應用前景。然而,如何實現免疫反應的定位激活以最大限度地減少與免疫相關的不良事件(IRAEs)的發生還仍然是一個棘手的難題。華中科技大學張燕博士、同濟大學羅宇博士和新加坡南洋理工大學浦侃裔教授團隊合作開發了一種由近紅外(NIR)光激活而產生免疫治療作用的有機半導體納米刺激試劑(OSPS)用于腫瘤的協同治療。OSPS是由半導體聚合物納米顆粒(SPN)作為內核,利用可被單線態氧(1O2)裂解的連接物將免疫刺激劑偶聯在其表面。在近紅外激光照射下,OSPS可以產生熱和1O2以進行聯合光療,這不僅可以治療腫瘤,還可以產生腫瘤相關抗原。同時,近紅外輻射也會使得連接物裂解,從而觸發免疫刺激物從OSPS中釋放出來以調節免疫抑制的腫瘤微環境。小鼠異種移植模型實驗結果表明,釋放的腫瘤相關抗原會結合被激活的免疫刺激物光療后誘導產生協同的抗腫瘤免疫反應,從而高效抑制原發性和遠處腫瘤的生長以及轉移。
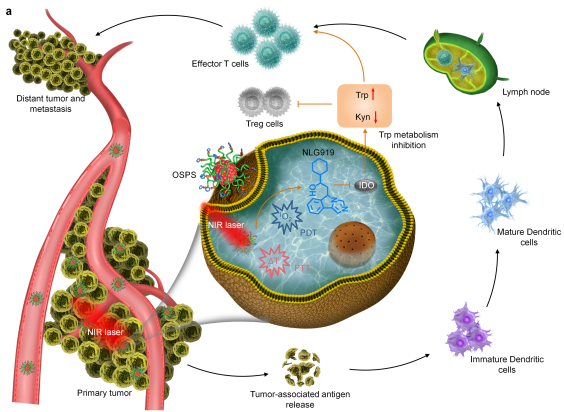
Jingchao Li, Yan Zhang, Kanyi Pu. et al. Organic Semiconducting Pro-nanostimulants for Near-Infrared Photoactivatable Cancer Immunotherapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201906288
https://onlinelibrary.wiley.com/doi/10.1002/anie.201906288
8. AFM綜述:用于骨和軟骨組織工程的聚合物纖維支架
負重骨缺損和軟骨缺損的成功修復是臨床骨科面臨的一大難題。在過去的幾十年里,許多具有仿生理化特性的可生物降解聚合物材料作為骨和軟骨組織工程支架的理想材料得到了迅速的發展。聚合物纖維支架由于其具有高的比表面積、合適的機械強度和可調整的性能,也被越來越多地應用于骨和軟骨缺損的修復。吉林大學左建林博士、福州大學張進博士、蘇州大學鄒俊博士和中科院長春應化所丁建勛研究員合作綜述了聚合物纖維的制備、組成及其特點;對具有良好結構和性能的聚合物纖維支架在骨、軟骨組織工程中的應用進行了介紹;最后也對該領域的發展提出了新的建議。
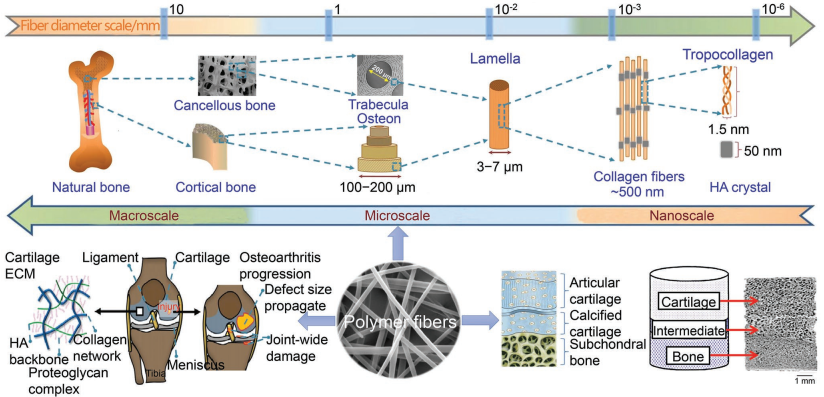
Yanbo Zhang, Jin Zhang, Jianlin Zuo, Jun Zou, Jianxun Ding. et al. Polymer Fiber Scaffolds for Bone and Cartilage Tissue Engineering. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903279
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903279
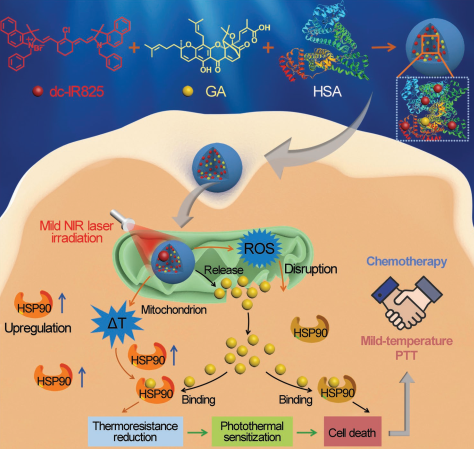
9. Small:基于白蛋白的納米藥物用于靶向腫瘤的溫和光熱治療
光熱療法(PTT)通常需要大于50 ℃才能有效地消融腫瘤,而這也不可避免地會對周圍的正常組織或器官造成損傷。此外,低的腫瘤保留效率和高的肝臟積累也是限制許多納米藥物療效和安全性的兩大主要問題。東南大學吳富根教授團隊通過將人血清白蛋白(HSA),dc-IR825(花青染料和PTT試劑)和藤黃酸(GA,熱休克蛋白90(HSP90)抑制劑及抗癌試劑) 進行自組裝,設計了一種基于白蛋白、對腫瘤微環境響應的納米藥物,它可以實現靶向腫瘤的溫和PTT。在近紅外(NIR)激光照射下,HSA/dc-IR825/GA NPs可以從線粒體逃逸到胞質。其中的GA分子會阻止HSP90過度表達,降低腫瘤細胞的耐熱性從而可以進行有效的溫和PTT (< 45 ℃)。此外,該NPs還具有對pH響應的電荷逆轉性能,較好的腫瘤積累和低的肝臟富集等優點,可以充分發揮溫和PTT和化療的協同作用來抑制腫瘤。
Ge Gao, Fu-Gen Wu. et al. Molecular Targeting-Mediated Mild-Temperature Photothermal Therapy with a Smart Albumin-Based Nanodrug. Small. 2019
DOI: 10.1002/smll.201900501
https://onlinelibrary.wiley.com/doi/10.1002/smll.201900501
10. Chem. Rev.:納米碳材料的生物醫學應用:傳感、成像和藥物遞送
不同維度的納米碳材料由于其具有獨特的理化性質而被廣泛應用許多領域。其中,基于納米碳材料的診療及其他生物醫學應用也是目前研究的熱點之一。美國NIH陳小元教授團隊和新加坡南洋理工大學Ken-Tye Yong博士團隊系統地綜述了納米碳材料的最新診療應用研究,并對不同納米碳材料的特性及其對診療應用的影響進行了說明比較;介紹了不同的碳材料的制備方法、表面功能化方法、理化性質、毒性和生物降解性及在體內外系統中的應用;最后也概述了設計納米碳材料的原則和該領域所面臨的挑戰及相關解決方案。

Nishtha Panwar, Ken-Tye Yong, Xiaoyuan Chen. et al. Nanocarbons for Biology and Medicine: Sensing, Imaging, and Drug Delivery. Chemical Reviews. 2019
DOI: 10.1021/acs.chemrev.9b00099
https://pubs.acs.org/doi/10.1021/acs.chemrev.9b00099
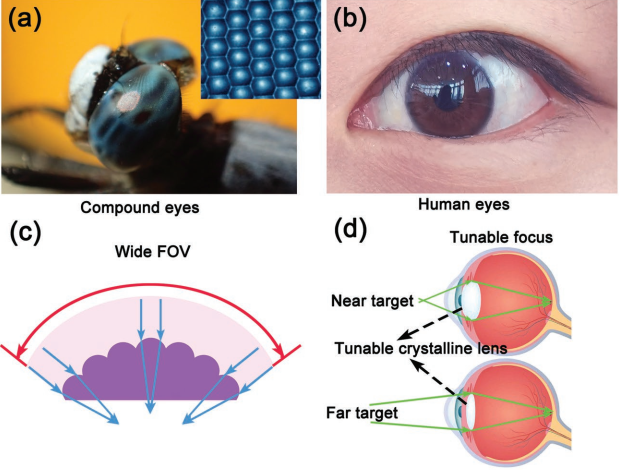
11. AFM:智能復眼用于可調成像
復眼是一種天然的多孔徑光學成像系統,在現代光學領域中具有廣闊的應用前景。然而,無論是自然的還是人工合成的復眼,都是由具有固定焦距的全單體構成的,因此無法實現變焦成像。清華大學孫洪波教授團隊和吉林大學張永來教授團隊合作,采用飛秒激光直寫技術制備了基于牛血清蛋白 (BSA)的智能刺激響應型復眼。基于BSA在不同pH條件下的膨脹和收縮作用,實驗獲得了具有可調諧視野和可變焦距的小眼。該研究除了直接構建整個基于BSA的復眼之外,還展示了將智能蛋白小眼與傳統光學透鏡進行靈活集成以構建復合復眼的能力。該復合復眼可以實現近400%的焦距調諧,因此這一工作也為開發微型可調諧的成像系統提供一個新的方法。
Zhuo-Chen Ma, Yong-Lai Zhang, Hong-Bo Sun. et al. Smart Compound Eyes Enable Tunable Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903340
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903340
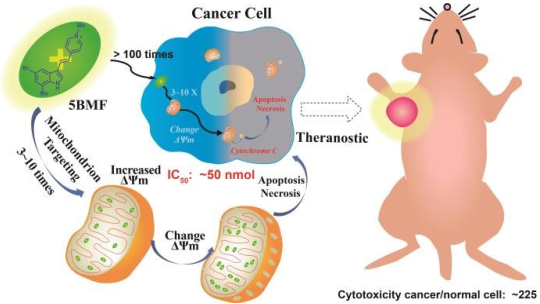
12. Chem. Sci.:靶向線粒體的熒光分子用于生物成像和抑制腫瘤生長
在線粒體進行熒光聚集的離域親脂陽離子(DLCs)在腫瘤治療領域中已引起人們的廣泛關注,F16就是其中之一。它可以選擇性地觸發癌細胞的凋亡和壞死,是一種很好的靶向診療藥物。然而,它的臨床轉化前景卻一般,主要原因是其抗癌活性較低,且對其對構效關系(SAR)的認識也不足。吉林大學第一醫院張惠茅團隊和斯坦福大學程震教授團隊合作合成了11個吲哚環取代的F16衍生物(F16s)。在這些衍生物中,5BMF是一種高效的診療試劑,體外研究表明其IC50值低至50 nM (對H2228細胞),而對正常細胞則具有很好的安全性。體內研究結果證明,與PBS對照組相比,經5BMF治療的腫瘤的生長會受到明顯抑制,且對小鼠也沒有明顯的毒性。而5BMF的腫瘤成像能力則通過體內熒光成像得到了證實。
Hao Chen, Hao Chen, Zhen Cheng. et al. Mitochondria-targeted fluorescent molecules for high efficiency cancer growth inhibition and imaging. Chemical Science. 2019
DOI:10.1039/C9SC01410A
https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc01410a#!divAbstract
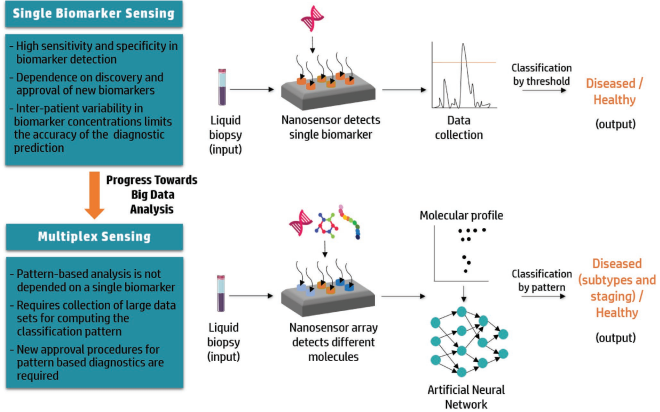
13. AM:人工智能和納米技術相結合用于精確癌癥醫學
人工智能(AI)和納米技術是實現精準醫學的兩個重要工具,可以為每個癌癥患者量身定制出最佳的治療方案。最近研究表明,通過AI獲取患者數據進而設計或改善適合患者的納米癌癥藥物是一種很好的方案。然而,腫瘤和患者間的高異質性使得對診斷和治療平臺進行合理設計及其輸出分析變得非常困難。而通過集成AI的方法則可以解決這一難題,通過使用模式分析和分類算法等可以提高診斷和治療的準確性。并且人工智能的應用也可以優化納米藥物的設計和性能,并且能夠預測其與靶點、生物液體、免疫系統、血管系統和細胞膜的相互作用情況,而這些都與最終的治療效果息息相關。以色列理工學院Avi Schroeder教授團隊對人工智能的基本概念進行了介紹,并總結綜述了將納米技術與人工智能相結合用于精確癌癥醫學的研究和未來的前景。
Omer Adir, Avi Schroeder. et al. Integrating Artifcial Intelligence and Nanotechnology for Precision Cancer Medicine. Advanced Materials. 2019
DOI: 10.1002/adma.201901989
https://onlinelibrary.wiley.com/doi/10.1002/adma.201901989
14. AFM:共摻雜氮和鑭系元素的碳量子點與用于多模態成像
納米粒子由于其具有很好的成像性能,正日益成為生物成像領域中常用造影劑的替代品。西班牙奧維爾多大學Jose Manuel Costa-Fernandez教授和Juan Carlos Mayo博士合作采用一鍋微波輔助水熱法合成了共摻雜氮和鑭系元素(Gd和Yb)的碳量子點,并將其一種多模態成像造影劑。這種摻雜后的CQDs具有強烈的熒光發射量子產量(66 7%)以及很好的磁共振(MR)和計算機斷層掃描(CT)成像性能,并且具有很好的生物安全性。實驗進一步將這些共摻雜的CQDs應用于體外熒光、MR和CT細胞成像,并通過尾靜脈注射入小鼠體內后發現可以在膀胱和腎臟中觀察到顯著的MR和CT對比增強,表明這一材料確是一種很好的體內外多模態成像造影劑。

Diego Bouzas-Ramos, Juan Carlos Mayo, Jose Manuel Costa-Fernandez. et al. Carbon Quantum Dots Codoped with Nitrogen and Lanthanides for Multimodal Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903884
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903884
15. Nano Lett.:多功能空心多孔錳(II)氧化物納米平臺用于實時可視化的藥物遞送
多功能納米平臺具有良好的負載效率、可實時監測、提高藥物的生物利用度和生物選擇性等優點。其中,刺激響應型納米顆粒NPs作為一種智能納米平臺受到了研究的廣泛關注。廈門大學高錦豪教授團隊制備了一種空心多孔錳(II)氧化物(HPMO)納米顆粒,并將其作為一種刺激響應型的,可激活的納米平臺用于腫瘤特異性的藥物遞送和實時監測。這種由兩性離子多巴胺磺酸鹽(ZDS)功能化的HPMO NPs可作為負載有機染料或化療藥物的載體平臺,且負載效率很高。所得到Cargo@HPMO會在腫瘤微環境和溶酶體的弱酸性條件下分解為順磁性Mn2+離子并進行釋放。釋放的Mn2+可以增強T1磁共振信號,實時監測體內藥物的遞送情況。這一工作報道的智能化多功能納米平臺具有pH響應的多模態成像和位點特異性藥物遞送功能,因此為實現癌癥的準確診斷和有效治療提供了一個新的策略。
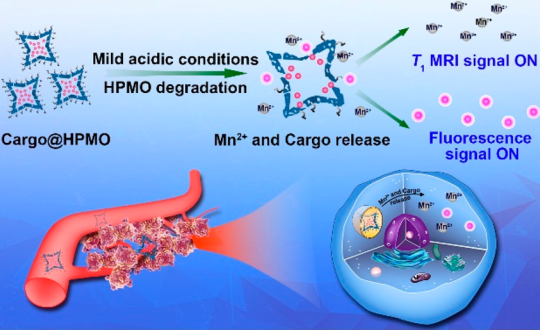
Ruixue Wei, Jinhao Gao. et al. Versatile Octapod-Shaped Hollow Porous Manganese(II) Oxide Nanoplatform for Real-Time Visualization of Cargo Delivery. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01900
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01900
16. Chem. Soc. Rev.:抗體-藥物偶聯物中的可裂解連接物
抗體-藥物偶聯物(ADCs)是目前公認的一類重要的癌癥臨床治療藥物。而抗體和藥物之間的連接物的性質也被證明是成功構建ADCs的關鍵。盡管ADCs之間的連接物在正常狀況下往往是不可裂解的,但臨床開發中的絕大多數ADCs也都有著特定的釋放機制,可以實現連接物在靶點部位發生裂解。近年來,大量研究致力于開發從ADCs中釋放藥物的新方法,有鑒于此,劍橋大學David R. Spring團隊綜述了近年來對ADCs之間可裂解連接物和連接技術的研究進展,并對這一領域的未來進行了展望。
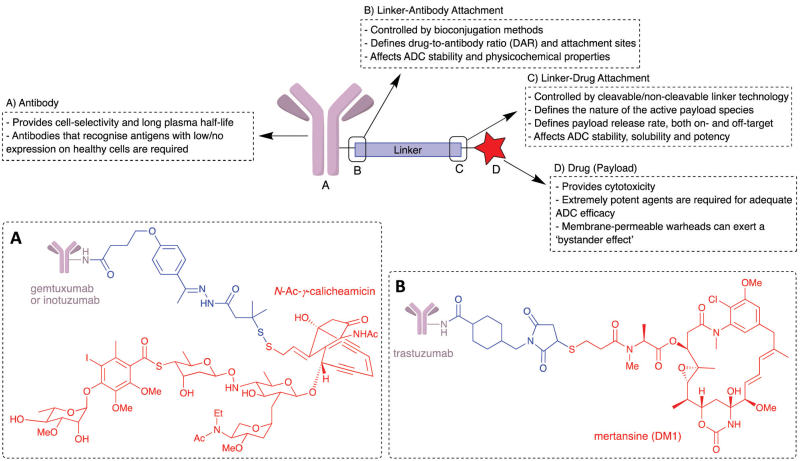
Jonathan D. Bargh, David R. Spring. et al. Cleavable linkers in antibody–drug conjugates. Chemical Society Reviews. 2019
DOI:10.1039/C8CS00676H
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c8cs00676h#!divAbstract
17. ACS Nano:納米顆粒的力學性能對其遞送腫瘤藥物的性能的影響
納米粒子的理化性質在調控納米-生物相互作用中起著至關重要的作用。雖然目前關于納米顆粒的大小、形狀和表面電荷對其生物學性能的影響已有廣泛的研究,但是人們對納米顆粒的機械力學性能及其對藥物遞送性能的影響還不夠了解。復旦大學趙東元院士、美國布朗大學高華健院士和昆士蘭大學趙春霞教授合作綜述了納米顆粒力學性能對其遞送腫瘤藥物性能的影響,包括:(1)納米顆粒力學性能的基本術語和表征這些性能的主要技術;(2)目前制備具有可調力學性能的納米粒子的方法;(3)不同力學性能的納米顆粒的體內外生物學行為的研究,例如血液循環、腫瘤或組織靶向、腫瘤滲透性和癌癥細胞攝取等,并對在細胞、組織和器官的水平上控制復雜的納米粒子-生物相互作用的潛在機制進行了介紹。
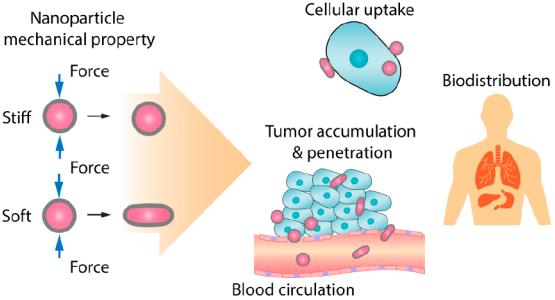
Yue Hui, Dongyuan Zhao, Huajian Gao, Chun-Xia Zhao. et al. Role of Nanoparticle Mechanical Properties in Cancer Drug Delivery. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03924
https://pubs.acs.org/doi/10.1021/acsnano.9b03924
18. Nano Lett.:對pH與熱敏感的納米顆粒介導進行免疫-微波熱協同抗腫瘤治療
陽離子抗癌多肽可誘導腫瘤細胞免疫原性死亡來進一步提高腫瘤特異性免疫反應,它也為緩解腫瘤免疫抑制微環境提供了一種很好的解決方案。然而,肽類藥物往往容易降解,缺乏靶向性,導致其應用受到很大的限制。浙江大學游劍教授、杜永忠教授和紀建松教授合作報道了一種對pH值和熱敏感的,負載牛乳鐵蛋白肽的納米粒子,它可以實現抗腫瘤和活化免疫細胞的作用,因此可以用于免疫-微波熱聯合腫瘤治療。牛乳鐵蛋白肽可以通過納米載體被遞送到腫瘤部位,在溶酶體的酸性環境和微波熱條件下從納米顆粒中迅速地被釋放出來,進而通過釋放損傷相關分子模式(DAMPs)來誘導腫瘤細胞凋亡。體內實驗表明,在靜脈注射該材料后通過進一步結合微波熱治療不僅可以顯著地抑制腫瘤生長,也會產生很強的抗腫瘤免疫反應。
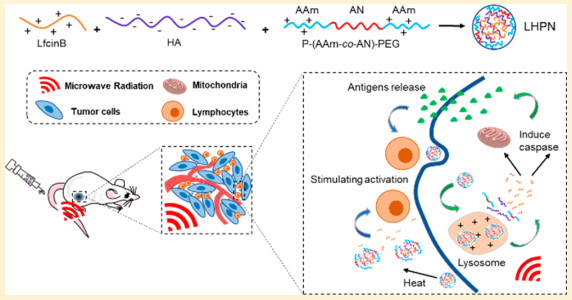
Jing Qi, Jian You, Jiansong Ji, Yongzhong Du. et al. pH and Thermal Dual-Sensitive Nanoparticle-Mediated Synergistic Antitumor Effect of Immunotherapy and Microwave Thermotherapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01061
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01061
19. Angew:利用靶向DNA的四嗪生物正交反應生產單線態氧
馬爾堡菲利普大學Olalla Vázquez教授團隊報道了一種將生物正交反應用于光動力療法的策略,它可以同時實現有條件的光毒性和特異性的亞細胞定位。實驗設計的新型鹵代BODIPY-四嗪探針只有通過在細胞內進行的逆狄爾斯-阿爾德反應才會成為一種高效的光敏劑 (ΦΔ0.50)。理論計算結果表明,這一活化過程控制了單線態氧的(1O2)生成。研究通過選擇性地激活休眠的光敏劑,證明其可以在細胞核內被活化產生1O2,進而導致癌癥細胞死亡。這一工作也為利用生物正交反應去激活光敏劑提供了新的策略,可以有效克服目前光動力治療的局限性。
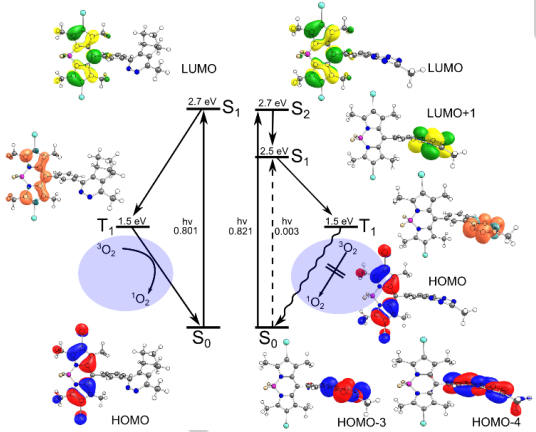
Greta Linden, Lei Zhang, Olalla Vázquez. et al. Conditional Singlet Oxygen Generation via DNA-targeted Tetrazine Bioorthogonal Reaction. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201907093
https://onlinelibrary.wiley.com/doi/10.1002/anie.201907093
20. ACS Nano:利用納米顆粒輔助表征動脈粥樣硬化的動脈內皮結構
動脈粥樣硬化與內皮屏障受損有關,它也會促進動脈粥樣硬化病變中免疫細胞和大分子的積累。阿姆斯特丹大學醫學中心Ewelina Kluza團隊使用透明質酸納米顆粒(HA-NPs)研究了內皮屏障的完整性及其在動脈粥樣硬化的進展和治療過程中的EPR效應。研究發現,動脈粥樣硬化斑塊覆蓋的內皮細胞的連接連續性會明顯低于正常血管壁,這表明內皮屏障有被破壞。此外,研究通過超分辨和相關的光學電子顯微鏡在斑塊微環境中跟蹤納米顆粒,發現在內皮細胞底層的細胞外基質中有很高的HA-NP積累。最后,研究探討了利用HA-NPs的EPR效應結合糖酵解抑制劑3PO進行代謝治療實現血管正常化的策略。體外實驗表明,經3PO治療的小鼠主動脈對HA-NP的吸收減弱與3PO的內皮細胞沉默活性相一這一工作闡明了納米顆粒在動脈粥樣硬化斑塊中積累的自然局限性,并為納米顆粒的動脈粥樣硬化內皮轉運提供了機制上的理解。
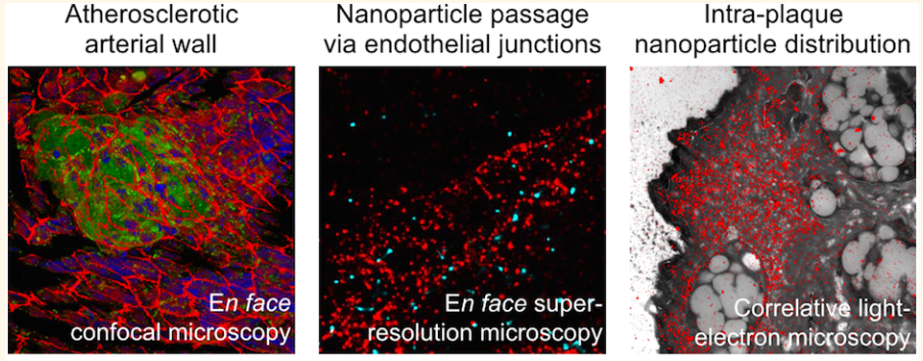
Thijs J. Beldman, Tsveta S. Malinova, Ewelina Kluza. et al. Nanoparticle-Aided Characterization of Arterial Endothelial Architecture during Atherosclerosis Progression and Metabolic Therapy. ACS Nano. 2019
DOI: 10.1021/acsnano.8b08875
https://pubs.acs.org/doi/10.1021/acsnano.8b08875
21. Nano Lett.:生物響應性蛋白復合物用于增強的免疫治療
盡管免疫檢查點阻斷(ICB)治療對多種癌癥具有很好的療效,但其臨床療效往往受到響應率低和全身免疫相關不良事件的限制。蘇州大學陳倩教授和加州大學顧臻教授合作制備了一種對活性氧(ROS)敏感的蛋白質復合體,將其用于生物響應型 ICB治療。該蛋白復合體可以利用腫瘤微環境(TME)中豐富的ROS來有控制地順序釋放aCD47和aPD1的信號。因此這些蛋白復合物也可作為TME中活性氧的清除劑來逆轉免疫抑制,從而提高其體內的抗腫瘤效果。實驗在黑色素瘤腫瘤模型中也證明了該復合物具有很好的協同抗腫瘤效果。

Qian Chen, Zhen Gu. et al. Bioresponsive Protein Complex of aPD1 and aCD47 Antibodies for Enhanced Immunotherapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00584











