1. Angew:利用活性氧對活細胞中可裂解RNA的DNA酶進行正交活化
可裂解RNA的 DNA酶是用于細胞內金屬離子傳感和基因調控的一種有效工具。通過對DNA酶引入可響應刺激的修飾,可以對它們的活性進行時空和化學控制,從而實現更加精確的應用。目前,已有許多可被光誘導活化的籠狀DNA酶被成功地開發出來,但可被細胞內具有重要生物學性能的物質(如活性氧ROS)激活的DNA酶卻還是很少。
過氧化氫(H2O2)和次氯酸鹽(HClO)等活性氧是氧化應激相關細胞信號傳導和失調的重要關鍵介質,可以激活免疫系統并和疾病衰老的進展密切相關。而要使用DNA酶來研究與ROS相關的細胞過程就需要開發可被ROS激活的DNA酶來避免來自其他細胞背景事件信號的干擾。清華大學向宇博士團隊通過對Zn2+依賴的8-17 DNA酶進行苯硼酸和硫代磷酸修飾,構建了可被ROS活化的 DNA酶。研究結果表明,這些DNA酶可在活的人和小鼠細胞中被H2O2和HClO等直接激活。
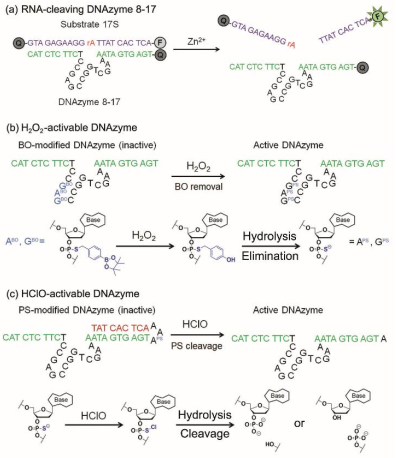
Lu Xiao, Chunmei Gu, Yu Xiang. Orthogonal Activation of RNA-Cleaving DNAzymes in Live Cells by Reactive Oxygen Species. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201908105
https://onlinelibrary.wiley.com/doi/10.1002/anie.201908105
2. Small:對刺激響應型軟體微機器人進行高分辨SPECT成像
無栓小型機器人在生物醫學領域具有巨大的應用潛力。然而,要將這些微型機器人轉化為臨床實踐還存在著許多的障礙。其中,如何實現高分辨的體內示蹤和成像是限制微納米機器人臨床應用的難題之一。
蘇黎世聯邦理工學院Veronica Iacovacci團隊通過在軟的熱響應磁性微機器人中引入放射性化合物,實現了利用單光子發射計算機斷層成像(SPECT)對其進行體內成像。實驗對4個具有不同水凝膠結構的微機器人和4個99mTc[Tc]基放射性化合物進行了組合研究以獲得最佳的造影劑保留率和成像效果。結果表明,利用這一策略可以實現對直徑小于100微米的單個微型機器人進行成像對對其結構的形狀轉換進行示蹤觀察。
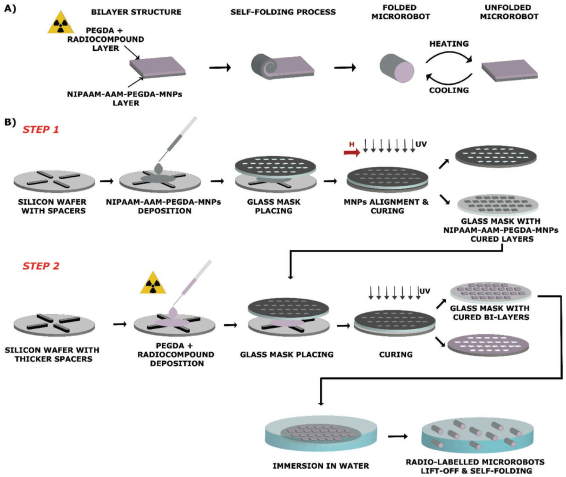
Veronica Iacovacci, Salvador Pané. et al. High-Resolution SPECT Imaging of Stimuli-Responsive Soft Microrobots. Small. 2019
DOI: 10.1002/smll.201900709
https://onlinelibrary.wiley.com/doi/10.1002/smll.201900709
3. Small綜述:用于光學生物成像的石墨烯量子點
石墨烯量子點(GQDs)具有良好的生物相容性、低的細胞毒性、可表面功能化、生理穩定性和可調諧的熒光特性等優點,因此在生物成像領域具有巨大的應用潛力。北京科技大學李文軍教授和董海峰教授合作綜述了適合用于生物成像的GQDs及其光學特性和合成策略,詳細介紹了對GQDs的光學特性進行調諧的最新方法;然后介紹了GQDs在體內外的一些成像應用,如細胞成像、靶向成像和構建納米診療平臺等方面;最后對這一新興領域所面臨的挑戰和發展前景進行了說明。
Huiting Lu, Wenjun Li, Haifeng Dong. et al. Graphene Quantum Dots for Optical Bioimaging. Small. 2019
DOI: 10.1002/smll.201902136
https://onlinelibrary.wiley.com/doi/10.1002/smll.201902136
4. ACS Nano:納米級聯酶用于靶向腫瘤的饑餓-化學聯合治療
在腫瘤內消耗葡萄糖引起的饑餓治療是一種重要的抗癌治療策略,但它往往存在著全身毒性和非特異性等缺點。中科大學王育才教授團隊提出了一種級聯催化納米藥物的概念,即將靶向腫瘤的饑餓治療和脫氧激活的化療相結合以降低全身毒性并提高癌癥治療的效率。實驗利用對pH響應的聚合物去和葡萄糖氧化酶(GOx)及過氧化氫酶(CAT)進行共價交聯合成了一種納米級聯酶。
酶的釋放可由微酸性的腫瘤微環境觸發進行,再由后續產生的葡萄糖酸實現自加速。而一旦被釋放,GOx可迅速消耗腫瘤細胞中的葡萄糖和分子氧,產生的毒副產物H2O2也可被CAT分解進而實現具有特異性和低毒性的腫瘤饑餓治療。此外,該級聯酶還可實現局部乏氧以激活前藥進行聯合化療。這一研究通過使用級聯催化納米藥物,可以同時有效地提高癌癥治療的選擇性和效率。
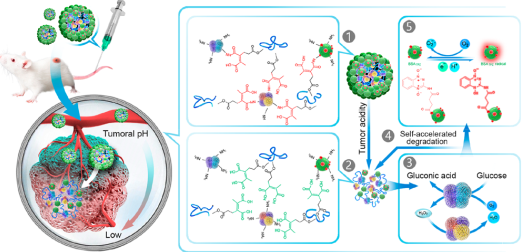
Yinchu Ma, Yangyang Zhao, Naveen Kumar Bejjanki, Yucai Wang. et al. Nanoclustered Cascaded Enzymes for Targeted Tumor Starvation and Deoxygenation-Activated Chemotherapy without Systemic Toxicity. ACS Nano. 2019
DOI: 10.1021/acsnano.9b02466
https://pubs.acs.org/doi/10.1021/acsnano.9b02466
5. Small:多功能疏水性微粒用于內鏡粘膜下剝離術后加速傷口愈合
內鏡下粘膜剝離術(ESD)作為一種微創治療方法,對早期胃腸道腫瘤具有良好的治療效果。然而,目前還沒有可靠的治療方法來預防ESD引起的瘢痕攣縮以及瘢痕狹窄。
日本國立材料科學研究所Tetsushi Taguchi團隊介紹了一種促進ESD后組織再生的多功能膠體創面敷料。這種噴霧式傷口敷料由疏水性微粒組成,具有促進多種傷口愈合的功能,如組織黏附性、促進凝血、再上皮化、血管生成以及與生物系統發生疏水相互作用而控制炎癥等。實驗利用豬胃ESD模型進行體內可行性研究的結果表明,這種膠體創面敷料可以有效抑制創面壞死并加速創面愈合。

Akihiro Nishiguchi, Tetsushi Taguchi. et al. Multifunctional Hydrophobized Microparticles for Accelerated Wound Healing after Endoscopic Submucosal Dissection. Small. 2019
DOI: 10.1002/smll.201901566
https://onlinelibrary.wiley.com/doi/10.1002/smll.201901566
6. Small綜述:基于納米金剛石的診療平臺用于藥物遞送和生物成像
納米金剛石(NDs)具有良好的生物相容性和天然的理化性質,非常適合用于生物醫學領域。中科院理化技術研究所只金芳團隊對基于納米金剛石的診療平臺進行了綜述介紹,重點強調了其在藥物遞送和生物成像等方面的應用,同時也介紹了相關治療策略的最新研究進展,最后對這一領域的未來進行了展望。
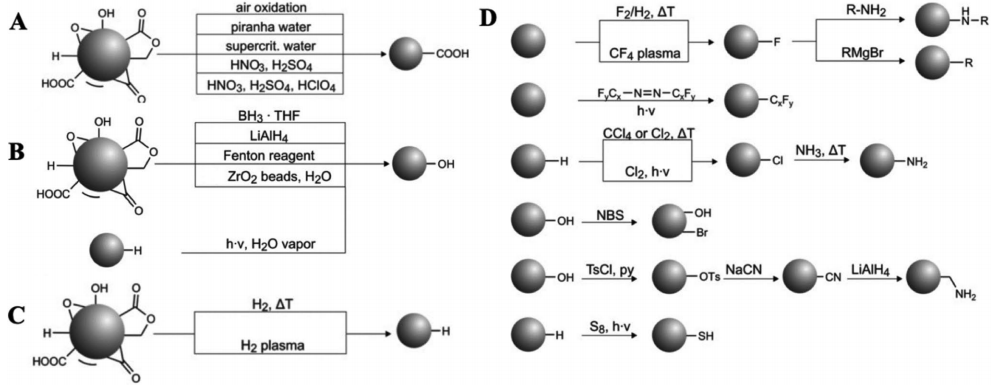
Guanyue Gao, Jinfang Zhi. et al. Nanodiamond-Based Theranostic Platform for Drug Delivery and Bioimaging. Small. 2019
DOI: 10.1002/smll.201902238
https://onlinelibrary.wiley.com/doi/10.1002/smll.201902238
7. Acc. Chem. Res:用于對細胞活力進行可視化的熒光探針
監測細胞活力是研究細胞凋亡、壞死以及設計藥物等基礎研究的重要一環。細胞的凋亡和壞死是維持細胞數量的重要因素,如果發生異常就會導致包括癌癥在內的嚴重疾病。在細胞死亡過程中,細胞內的許多物質內容和物理性質都會發生很大額,如酯酶活性降低、線粒體膜電位的去極化、半胱天冬酶含的量增加,膜不對稱、耗散和膜完整性的損失等。而利用這些生物學參數和各種熒光機制所開發的熒光探針則有望用于監測細胞活力,進而成為研究生物學和病理學的有力工具。
濟南大學林偉英教授團隊綜述了近幾十年來利用熒光探針去檢測細胞活力的代表性例子,并將其進行了分類;討論了熒光探針的基本設計原理、設計策略、熒光機理和分子結構,還說明了這些探針的內在特性和優點;著重介紹了該團隊自主開發的熒光探針和雙色可逆探針,為推動熒光探針的發展和其在細胞凋亡研究、藥物發現等相關領域的應用提供了很好的理論基礎。
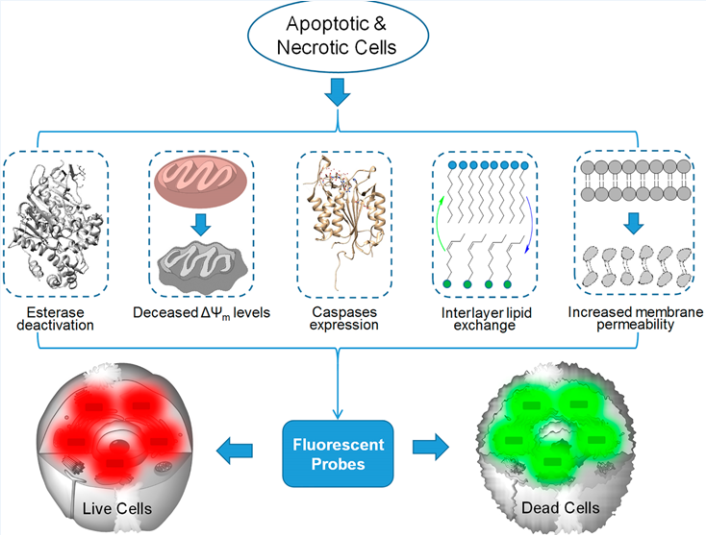
Minggang Tian, Weiying Lin. et al. Fluorescent Probes for the Visualization of Cell Viability. Accounts of Chemical Research. 2019
DOI: 10.1021/acs.accounts.9b00289
https://pubs.acs.org/doi/10.1021/acs.accounts.9b00289
8. Nano Lett.: 可降解的多孔中空磷化鎳納米球用于多模態成像指導的光熱治療
由于無機納米材料固有的不可生物降解性和潛在的長期毒副作用,目前其在臨床應用中還存在一定的局限性。中科院長春應化所王櫻蕙博士和張洪杰研究員合作,成功地制備了用牛血清白蛋白(BSA)改性的雙開關可生物降解清除的磷化鎳多孔中空納米球(NiP PHNPs)。
NiP PHNPs具有對酸性和氧化還原響應的雙開關降解能力,可有效地從小鼠體內清除排出,因此不會產生長期毒性。此外,由于其具有順磁性和在近紅外II區的強吸收性,NiP PHNPs有望用于光聲成像(PAI)和T1加權磁共振成像(MRI)指導的近紅外II區腫瘤光熱治療。并且其具有的中空結構和酸性降解特性使得NiP PHNPs能夠作為具有隨需釋放能力的智能藥物載體。
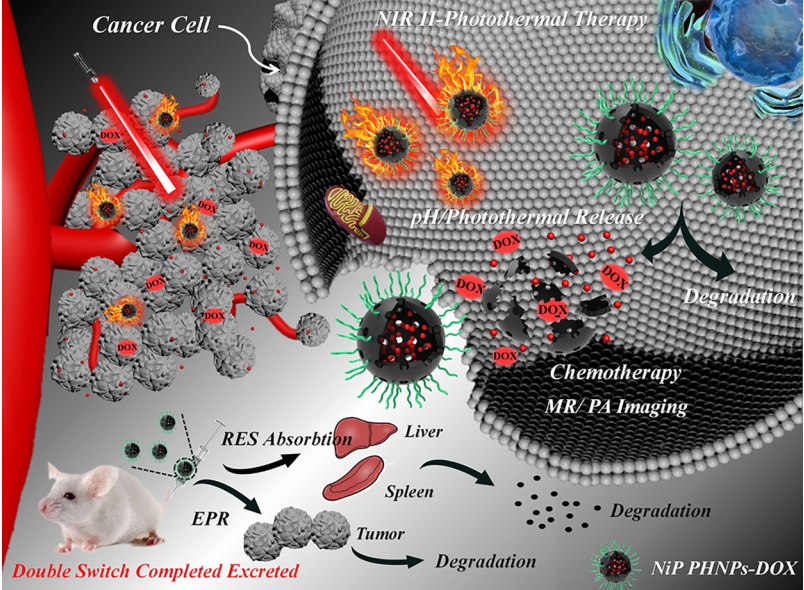
Yang Liu, Yinghui Wang, Hongjie Zhang. et al. Double Switch Biodegradable Porous Hollow Trinickel Monophosphide Nanospheres for Multimodal Imaging Guided Photothermal Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01370
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01370
9. AFM:AIE增強光致發光的可光降解半導體納米復合物用于雙模態腫瘤診療
半導體聚合物納米粒子(SPNs)具有廣闊的生物應用前景。其中,一些SPNs作為光熱和光聲(PA)試劑具有顯著的光熱轉換效率(PCEs),而另一些SPNs作為光致發光(PL)試劑則具有較高的熒光產率。然而,SPNs中能量的平衡分布會阻礙它們在PL/PA雙模成像中的成功應用。并且SPNs在體內的超穩定性也會使其會對生物體造成副作用。
北京化工大學王卓教授團隊報道了一種由半導體聚合物(SPs)和四苯乙烷聚集誘導發光原(TPE AIEgens)構建的納米復合半導體聚合物納米顆粒STNPs。其中SP SPC10具有良好的光熱轉換能力,而 TPBM則可以實現AIE增強的光致發光。結果表明,STNPs可以作為一種PL/PA雙模態顯像劑,其在PL模態下的信噪比(S/N)達到8.7,PA模態下的成像深度為5.8 mm。并且STNPs中的SPC10在90mW cm -2的白光照射下,6 h后就可以自主分解,利用其光熱效應也可有效治療異種移植的小鼠4T1腫瘤。
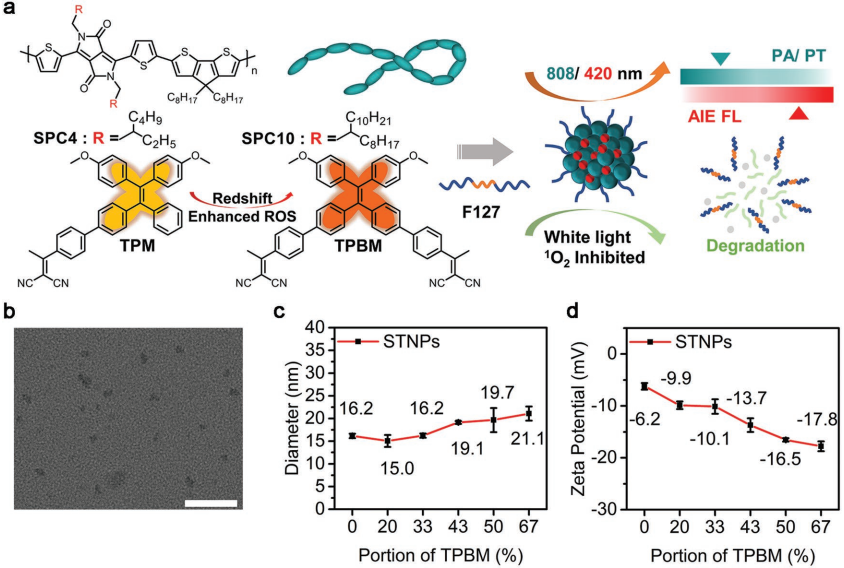
Yawen Li, Zhuo Wang. et al. Semiconducting Nanocomposite with AIEgen-Triggered Enhanced Photoluminescence and Photodegradation for Dual-Modality Tumor Imaging and Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903733
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903733
10. Acc. Chem. Res:近紅外光免疫治療對抗癌癥
美國國立衛生研究院Hisataka Kobayashi教授對新近發展起來的以光化學為基礎的近紅外光免疫治療(NIR-PIT)進行了綜述。NIR-PIT是一種利用分子靶向策略治療癌癥的光學療法,即通過注射一種NIR染料700dx (IR700)和單克隆抗體(mAb)的偶聯物,該偶聯物以癌細胞表面表達的抗原為靶點。隨后在近紅外光下會開啟光化學“死亡”開關,導致被靶向的癌細胞發生快速和高選擇性的免疫原細胞死亡(ICD)。而鄰近的受體陰性細胞則完全不會受到傷害。由于其具有高靶向性,NIR-PIT往往造成的副作用很低。
研究表明,NIR-PIT幾乎可以靶向任何細胞的表面抗原,包括癌癥干細胞標志物如CD44和CD133。目前其在臨床實驗中也表現出很好的效果。NIR-PIT的下一步發展方向是進一步利用免疫反應,從而實現增強腫瘤細胞選擇性的全身宿主免疫,顯著抑制遠端轉移性腫瘤。此外,NIR-PIT還可有效提高納米藥物遞送到腫瘤中的效率,其效果是傳統EPR治療的24倍。最后,作者也對這種新型光化學癌癥治療的未來進展和研究方向進行了介紹。
Hisataka Kobayashi, Peter L. Choyke. Near-Infrared Photoimmunotherapy of Cancer. Accounts of Chemical Research. 2019
DOI: 10.1021/acs.accounts.9b00273
https://pubs.acs.org/doi/10.1021/acs.accounts.9b00273
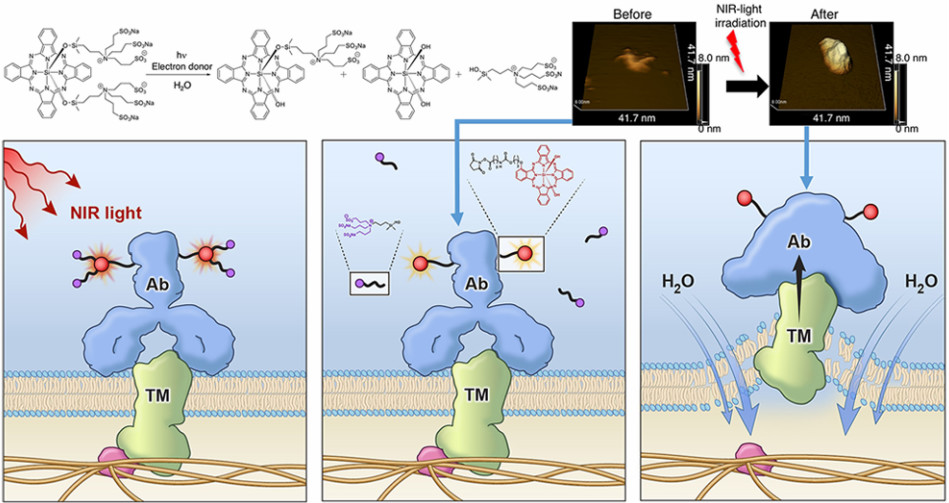
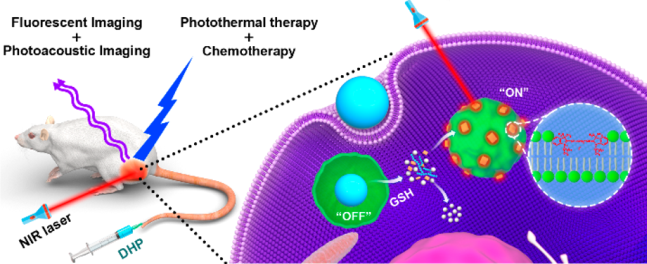
11. Nano Lett.:對谷胱甘肽響應的納米顆粒用于雙模態成像和化學-光熱聯合治療
構建可被腫瘤微環境刺激激活的納米診療平臺是目前研究的一大熱點和難題。華中科技大學李子福教授和楊祥良教授合作報道了一種新型簡單的,對谷胱甘肽(GSH)響應而激活的納米顆粒,并將其用于雙模態成像和聯合治療。實驗采用一步透析法制備了一種由二硫鍵連接的羥乙基淀粉-紫杉醇偶聯物(HES-SS-PTX)和近紅外(NIR)氰基熒光團DiR組成的納米診療平臺DHP。
由于DiR被包裹在HES-SS-PTX形成的疏水核內,其熒光會因聚集猝滅(ACQ)效應而猝滅。然而,一旦DHP被癌細胞內化,細胞內的谷胱甘肽可以裂解HES-SS-PTX中的二硫鍵,導致共軛的PTX和負載的DiR發生同步釋放。釋放的PTX能發揮化學治療作用,而DiR能吸附到鄰近的內溶酶體膜上進而恢復熒光。因此,DHP可以通過DiR的熒光恢復來監測PTX的釋放和治療效果。此外,DHP還可以作為抑制熒光和光聲成像的體內探針,并通過化學-光熱聯合治療實現有效的抗腫瘤效果。
Yihui Li, Yuxin Wu, Jitang Chen, Jiangling Wan, Zifu Li, Xiangliang Yang. et al. A Simple Glutathione-Responsive Turn-On Theranostic Nanoparticle for Dual-Modal Imaging and Chemo-Photothermal Combination Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02769
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02769
12. AFM:熱響應半導體聚合物納米顆粒用于增強的光聲成像
設計可被生物標志物激活信號的光聲(PA)造影劑可以改善其體內成像的信號背景比(SBRs)。但是它們的SBRs還是會嚴重依賴于病變組織和正常組織的生物標志物的濃度差異。相比之下,利用外部刺激則可以非侵入性的方式控制PA造影劑的信號生成,進而增強SBRs。
南洋理工大學浦侃裔教授、武漢大學喻愛喜教授和胡祥博士合作了制備一種嫁接有聚(N,N-二甲基丙烯酰胺)-r-(丙烯酸羥丙酯)(PDMA-r-HPA)的熱響應半導體聚合物,并將其用于增強對比度的體內成像。這種兩親性聚合物可以在水介質中自組裝成納米顆粒 (SPNph1),其臨界溶解溫度(LCSTs) 為48 ℃。因此,SPNph1不僅具有很好的光熱轉換效率,而且也可以發生相分離以形成大的納米顆粒,從而產生增強的PA信號。SPNph1的熱響應性使得其PA信號可以提高光輻照進行原位遠程調控,進一步增強成像的SBR。
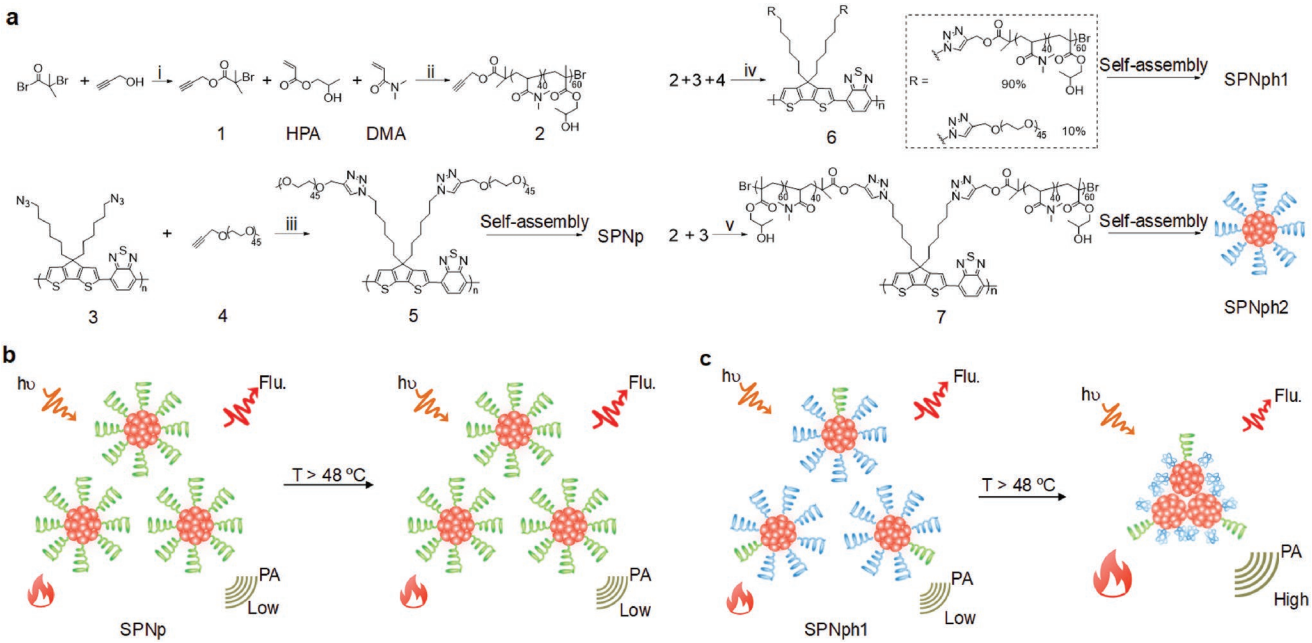
Dong Cui, Aixi Yu, Xiang Hu, Kanyi Pu. et al. Thermoresponsive Semiconducting Polymer Nanoparticles for Contrast-Enhanced Photoacoustic Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903461
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903461
13. AM:硅烯的濕化學剝離合成及其納米醫學應用
硅基生物材料在生物醫學工程中具有不可替代的作用。然而由于硅缺乏多樣化的功能,硅基納米材料往往僅限于作為藥物遞送系統的載體。同時,硅基生物材料作為一種典型的無機材料,其較差的生物降解特性也阻礙了其在體內的生物醫學應用和臨床轉化。
中科院上海硅酸鹽研究所陳雨研究員和施劍林研究員合作,通過濕化學剝離法合成了2 D的硅烯納米片,將傳統的0 D納米顆粒轉換為2 D材料系統。2 D硅烯納米片具有良好的理化性質,可以實現光觸發的治療和診斷成像,并具有很好的生物相容性和生物可降解性。研究結合基于DFT的分子動力學(MD)計算,對硅烯與生物環境相互作用的機理及其在特定模擬生理條件下的降解行為進行了討論。這一研究制備了一種新型硅基生物材料,并證明其具有生物可降解性、高的生物相容性、多功能性等優點,具有廣闊的臨床應用前景。
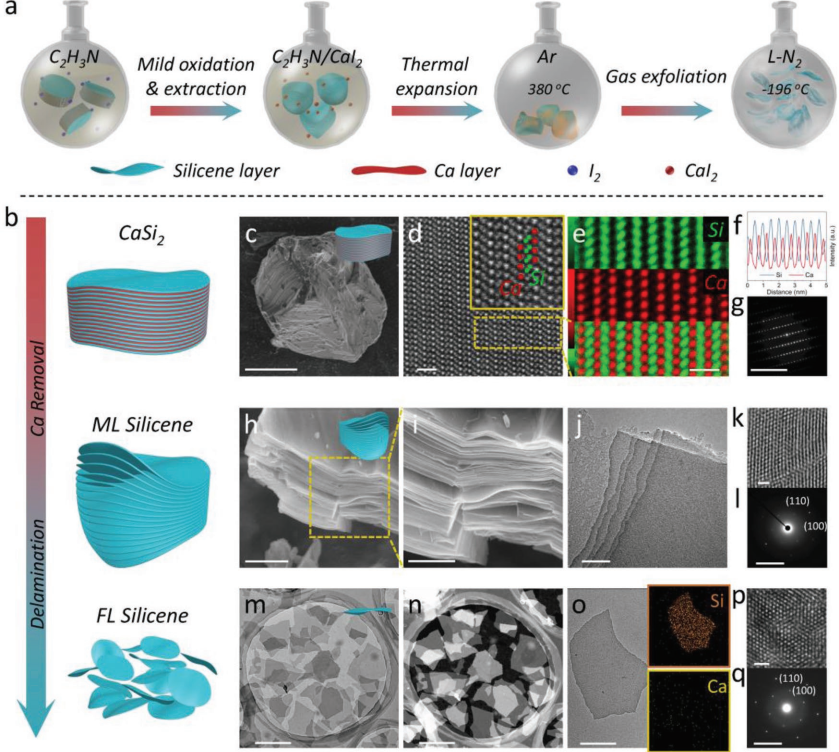
Han Lin, Yu Chen, Jianlin Shi. et al. Silicene: Wet-Chemical Exfoliation Synthesis and Biodegradable Tumor Nanomedicine. Advanced Materials. 2019
DOI: 10.1002/adma.201903013
https://onlinelibrary.wiley.com/doi/doi/10.1002/adma.201903013
14. ACS Nano: 鐵磁渦旋納米環介導的微磁熱療對抗腫瘤轉移
癌癥轉移是導致其治療失敗的一個主要原因。中科院自動化研究所杜洋博士、田捷研究員、西北大學樊海明教授和國家納米科學中心梁興杰研究員合作報告了一種有效安全的納米治療策略,可以根除原發性腫瘤,并抑制其肺部轉移,進而控制遠處腫瘤的轉移和生長。
該鐵磁渦旋氧化鐵納米環(FVIO)介導的輕度磁熱療會導致4T1乳腺癌細胞鈣網蛋白(CRT)的表達。而CRT的表達會傳遞“吃我”的信號,進而促進免疫系統對癌細胞的吞噬吸收,誘導有效的免疫原性細胞死亡,并進一步導致巨噬細胞極化。這種溫和的熱療法可以有效增強遠處腫瘤的CD8+細胞毒性T淋巴細胞的浸潤,并有效地使腫瘤對PD-L1檢查點阻斷治療敏感而觸發免疫治療。而在與PD-L1阻斷治療進行結合后,CD8+細胞毒性T淋巴細胞的比例可進一步從55.4%提高到64.5%。此外,該聯合治療也可抑制腫瘤的免疫抑制反應,使得骨髓源性抑制細胞(MDSCs)顯著下調。這一研究結果表明,FVIO介導的溫和磁熱療法可以激活宿主免疫系統,并可通過與PD-L1阻斷試劑的有效合作以抑制遠處腫瘤的轉移擴散和生長。
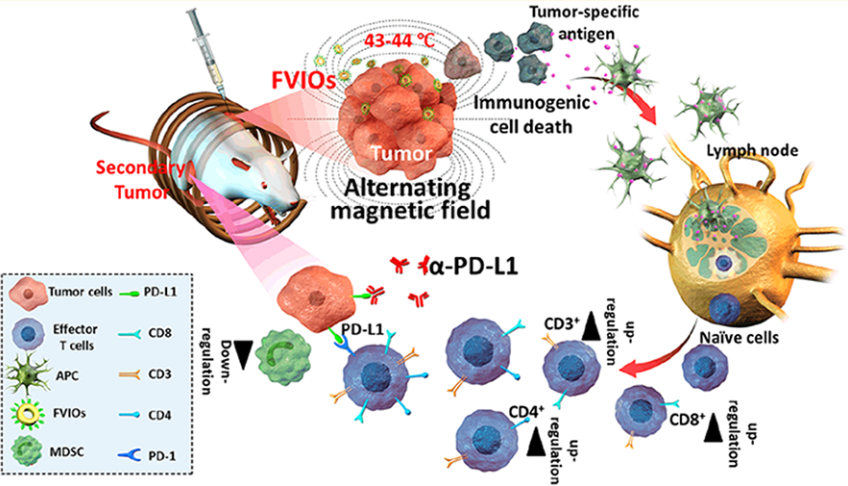
Xiaoli Liu, Yang Du, Haiming Fan, Jie Tian, Xing-Jie Liang. et al. Ferrimagnetic Vortex Nanoring-Mediated Mild magnetic Hyperthermia Imparts Potent Immunological Effect for Treating Cancer Metastasis. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01979
https://pubs.acs.org/doi/10.1021/acsnano.9b01979
15. Small:負載有miRNA納米粒子的可黏附水凝膠用于促進傷口愈合
慢性傷口的特點是愈合困難且往往會有炎癥發生,這會損害免疫系統的保護作用,并可能導致細菌感染。miR-223 microRNAs (miRNAs)的上調可以使得巨噬細胞向抗炎(M2)表型極化,這會有助于加速傷口的愈合。然而,由于microRNA的穩定性較低,實現其局部靶向遞送仍然具有很大的挑戰性。
加州大學Nasim Annabi教授團隊制備了含有miR-223 5p mimic (miR-223*)的透明質酸納米顆粒的可黏附水凝膠,用于控制傷口愈合過程中組織巨噬細胞的極化。體外實驗表明,該材料可以實現J774A中miR-223*的上調。體內實驗也表明該水凝膠具有很好的治療效果。在急性切除的創面模型中,該水凝膠可在創面愈合過程中粘附并覆蓋創面。組織學評價和定量聚合酶鏈反應(qPCR)分析表明,通過局部遞送miR-223*能夠有效促進傷口部位均勻血管化皮膚的形成,這主要是由于巨噬細胞向M2表型極化所導致的。
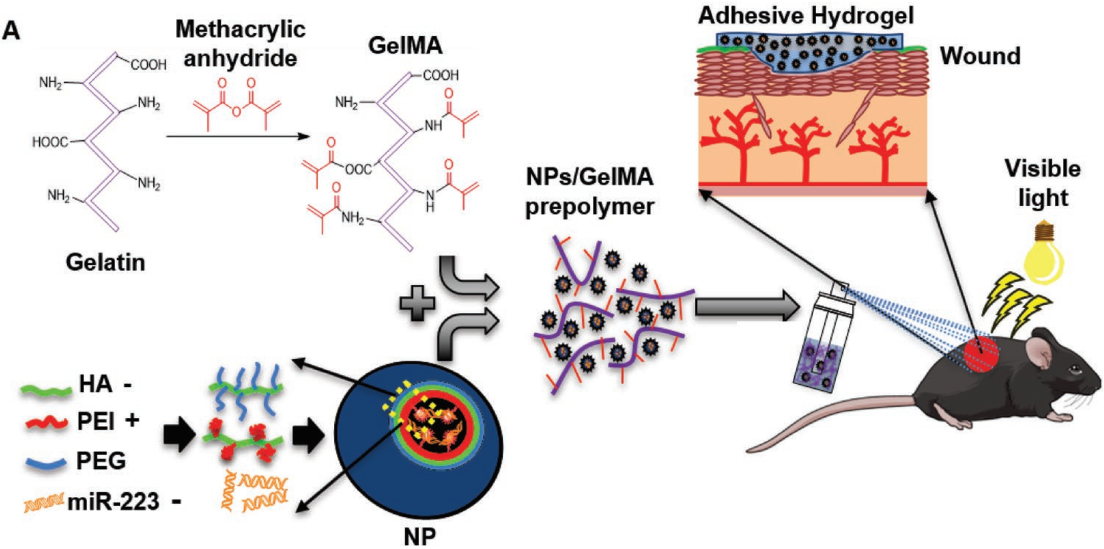
Bahram Saleh, Nasim Annabi. et al. Local Immunomodulation Using an Adhesive Hydrogel Loaded with miRNA-Laden Nanoparticles Promotes Wound Healing. Small. 2019
DOI: 10.1002/smll.201902232
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.201902232
16. ACS Nano:增強原發腫瘤的滲透性有助于納米顆粒流入淋巴結以抑制腫瘤轉移
淋巴結(LNs)通常是腫瘤轉移的主要部位。因此,通過全身給藥使化療藥物有效地進入LNs對于治療轉移腫瘤來說至關重要。華南理工大學李洪軍博士和杜金志教授合作發現,增強原發腫瘤的滲透性有利于納米顆粒轉移到LNs并抑制腫瘤轉移。
研究發現一種納米粒子(iCluster)的尺寸可以在腫瘤部位從100納米減小到5納米,進而顯著提高其在原發腫瘤間質的滲透。這種腫瘤特異性的納米粒子尺寸變化可以增強納米粒子的內滲并遷移到LNs。定量分析表明,當存在原發腫瘤并經iCluster治療后,LNs的藥物累積情況明顯高于原發腫瘤切除后LNs的藥物累積效果。通過在早期進行iCluster化療對抗轉移性4T1腫瘤,并對原發腫瘤進行手術切除后可顯著延長荷瘤小鼠的存活時間。這一發現為設計有效的納米藥物去治療轉移性癌癥提供了新的思路。
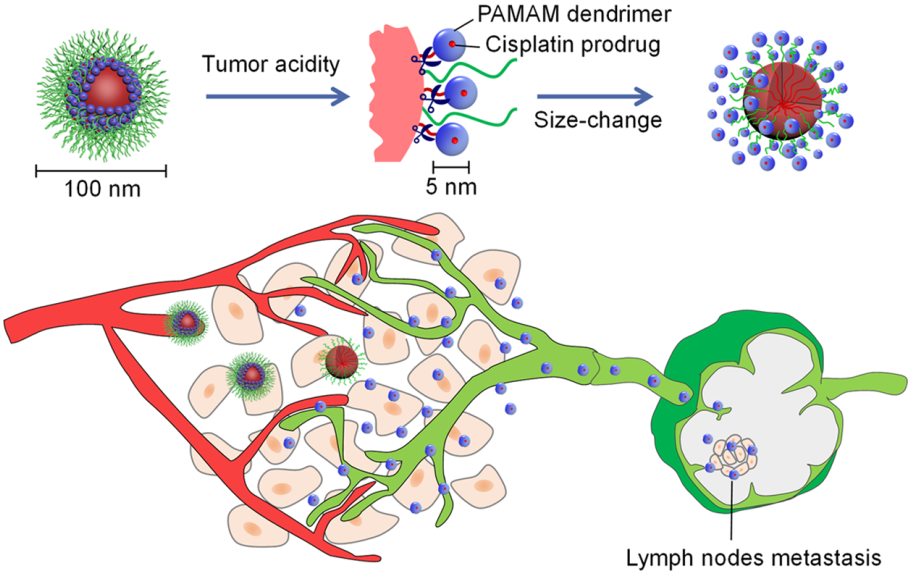
Jing Liu, Hong-Jun Li, Jin-Zhi Du. et al. Enhanced Primary Tumor Penetration Facilitates Nanoparticle Draining into Lymph Nodes after Systemic Injection for Tumor Metastasis Inhibition. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03472
https://pubs.acs.org/doi/10.1021/acsnano.9b03472
17. Small:對谷胱甘肽響應的部分中空的金-銀納米籠用于腫瘤診療
金-銀納米籠(GSNCs)具有良好的生物相容性、中空結構和可調諧的光學性能等優點,在腫瘤診療中有著廣泛的應用。然而,人們對于它們對腫瘤微環境的反應還不夠清楚。東南大學王雪梅教授和姜暉博士合作研究表明,一種小尺寸(35nm)、部分中空的GSNCs(吸收峰532nm)可以對腫瘤周圍血管進行增強光聲成像。更重要的是,腫瘤細胞微環境周圍高濃度的谷胱甘肽可誘導這些GSNCs發生聚集-解體-團聚,使GSNCs的吸收向近紅外(NIR)區域發生顯著轉移。進而實現高效的近紅外光熱治療(PTT)。體內光聲成像和光熱治療實驗也充分證明了這一結果。
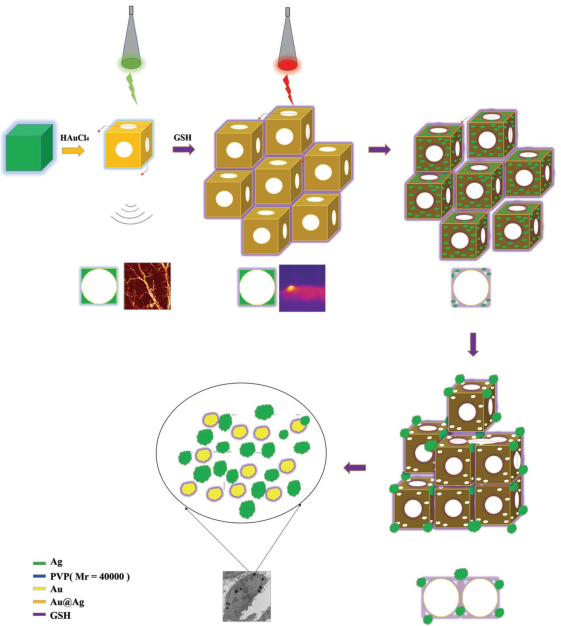
Zhaojian Qin, Xuemei Wang, Hui Jiang. et al. Glutathione Induced Transformation of Partially Hollow Gold–Silver Nanocages for Cancer Diagnosis and Photothermal Therapy. Small. 2019
DOI: 10.1002/smll.201902755
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.201902755
18. Small:不同大小的納米顆粒在細胞吸收中的相互作用
尺寸對于納米顆粒(NPs)被細胞攝取的影響已被廣泛研究,但仍未得到很好的理解。上海大學王海芳教授和曹傲能教授合作,采用簡化法將除粒徑外的所有影響因素最小化。實驗采用將不同粒徑二氧化硅納米顆粒(SNPs)進行和細胞共孵育的方法來代替普通的單次孵育。
在無血清培養基中,Hela細胞主要通過對網格蛋白依賴的內吞作用將SNPs內化,從而可以簡化數據分析進而將尺寸效應作為控制變量。盡管在單次孵育實驗中,尺寸效應往往很不明顯甚至無法被檢測到。但共孵育實驗結果則體現了顯著的尺寸效應,這是由于兩個不同大小的SNPs之間產生的相互作用造成的。即較大的SNPs會顯著促進較小的SNPs被細胞攝取,而較小的SNPs會抑制較大SNPs的細胞攝取,從而使得細胞內SNPs的顆粒總數增加。并且這種相互作用在大多數的“單尺寸”(實則尺寸分布在一定的范圍)NPs中也會存在。

Ling Li, Haifang Wang, Aoneng Cao. et al. Unexpected Size Effect: The Interplay between DifferentSized Nanoparticles in Their Cellular Uptake. Small. 2019
DOI: 10.1002/smll.201901687
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.201901687
19. ACS Nano:順序特異性遞送溶栓劑和神經保護劑用于強化治療缺血性中風
由血栓阻塞和缺血引起的缺血性中風是一種容易致殘甚至致命的腦血管疾病之一。而開發一個可以將溶栓劑和神經保護劑分別送到血栓和缺血半暗帶位置的順序靶向給藥系統則有望實現很好的聯合效果。
受血小板在血栓形成中的重要作用的啟發,加州大學顧臻教授和南京醫科大學辛洪亮博士合作開發了一種生物工程納米血小板(tP-NP-rtPA/ZL006e),用于對重組組織纖溶酶原激活劑(rtPA)和神經保護劑(ZL006e)進行順序特異性遞送。tP-NP-rtPA/ZL006e可經血小板膜介導的靶向作用到達血栓部位,進而上調凝血酶并觸發rtPA的釋放。隨后,原位暴露的Tat肽可以使得納米血小板穿過血腦屏障進入缺血大腦,實現了對ZL006e的位點特異性遞送。體內外實驗表明,tP-NP-rtPA / ZL006e在大鼠大腦中動脈閉塞模型中具有很好的抗中風療效,可顯著降低63%的缺血區和72%的活性氧水平。
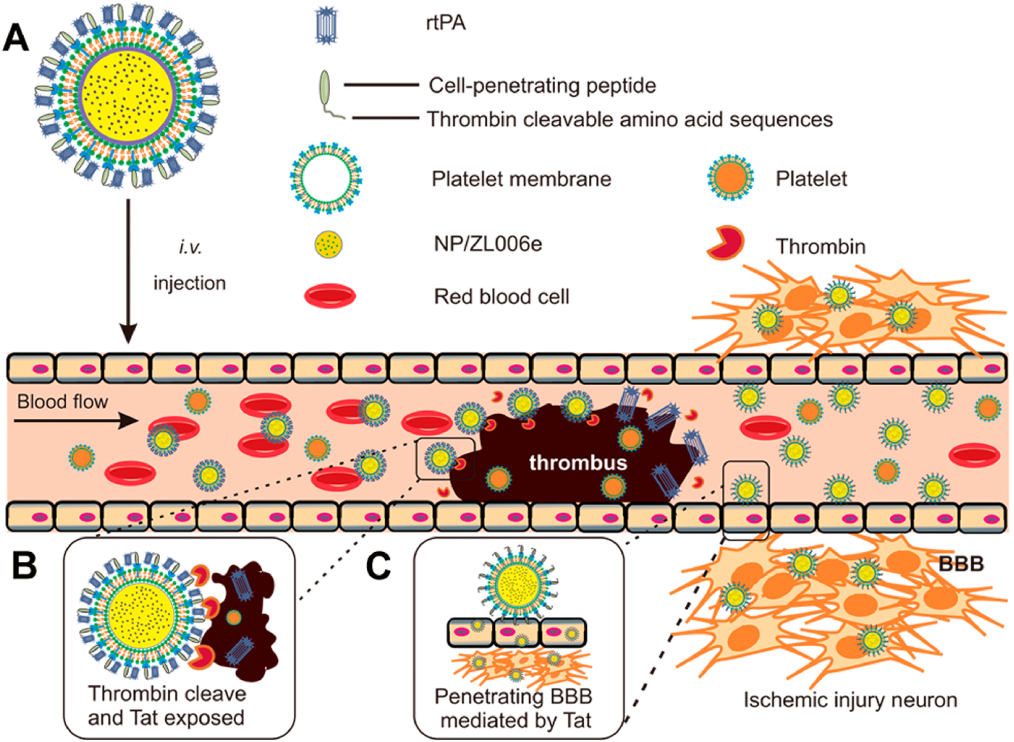
Jianpei Xu, Zhen Gu, Hongliang Xin. et al. Sequentially Site-Specific Delivery of Thrombolytics and Neuroprotectant for Enhanced Treatment of Ischemic Stroke. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01798
https://pubs.acs.org/doi/10.1021/acsnano.9b01798
20. Nano Lett.:雙功能超納米粒子用于微波動力治療和微波熱療
光動力療法(PDT)是利用光敏劑去產生細胞毒性活性氧(ROS)并進行腫瘤治療,目前已被廣泛研究。然而,光的穿透深度差也嚴重阻礙PDT的臨床治療效果。雖然微波(MWs)具有更好的穿透深度,但其能量還遠低于激活任何物種產生ROS所需的能量。中科院理化技術研究所孟憲偉研究員、李來風研究員和解放軍總醫院梁萍教授合作發現,微波輻射可以激活液態金屬(LM)超納米粒子產生·OH、·O2等ROS。在此基礎上,實驗通過將LMs和一種MW熱敏劑離子液體(IL)共負載到介孔ZrO2納米顆粒中制備了一種雙功能的超納米粒子,并證明其可以實現微波動力治療和微波熱療。
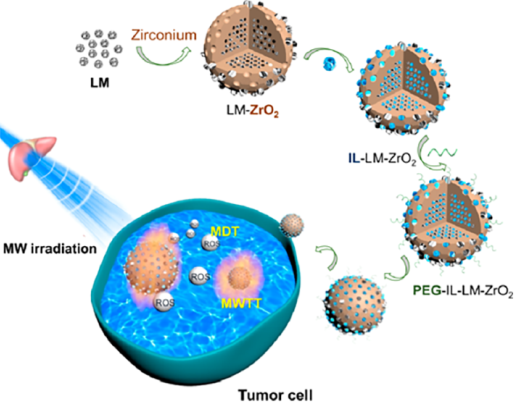
Qiong Wu, Ping Liang, Laifeng Li, Xianwei Meng. et al. Dual-Functional Supernanoparticles with Microwave Dynamic Therapy and Microwave Thermal Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01735
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01735
21. AFM:對功能化納米顆粒進行逐層組裝用于治療肝癌
由于治療效果一般和對正常組織的毒性較大,傳統方法的癌癥治療往往臨床結果不佳。近年來,利用功能化載體以實現聯合治療的研究也越來越多。天津醫科大學魏璽博士團隊將功能化納米粒子(FNPs)進行逐層組裝。即在FNPs的表面負載兩種藥物(10-羥基喜樹堿和凋亡蛋白質粒)和兩種肝細胞癌靶向配體(乳酸菌酸和生物素)。細胞毒性實驗表明,空白的FNPs在小鼠模型上具有良好的生物相容性。而流式細胞分析和毒性研究則表明,雙靶向FNPs具有更好的腫瘤特異性和選擇性毒性。共聚焦實驗表明,當藥物被釋放到細胞質基質中后,該FNPs可以在核中定位并增強其負載的10-羥基喜樹堿和凋亡蛋白質粒在核內的遞送。體內實驗則證明該FNPs對裸鼠皮下腫瘤具有很好的治療效果。
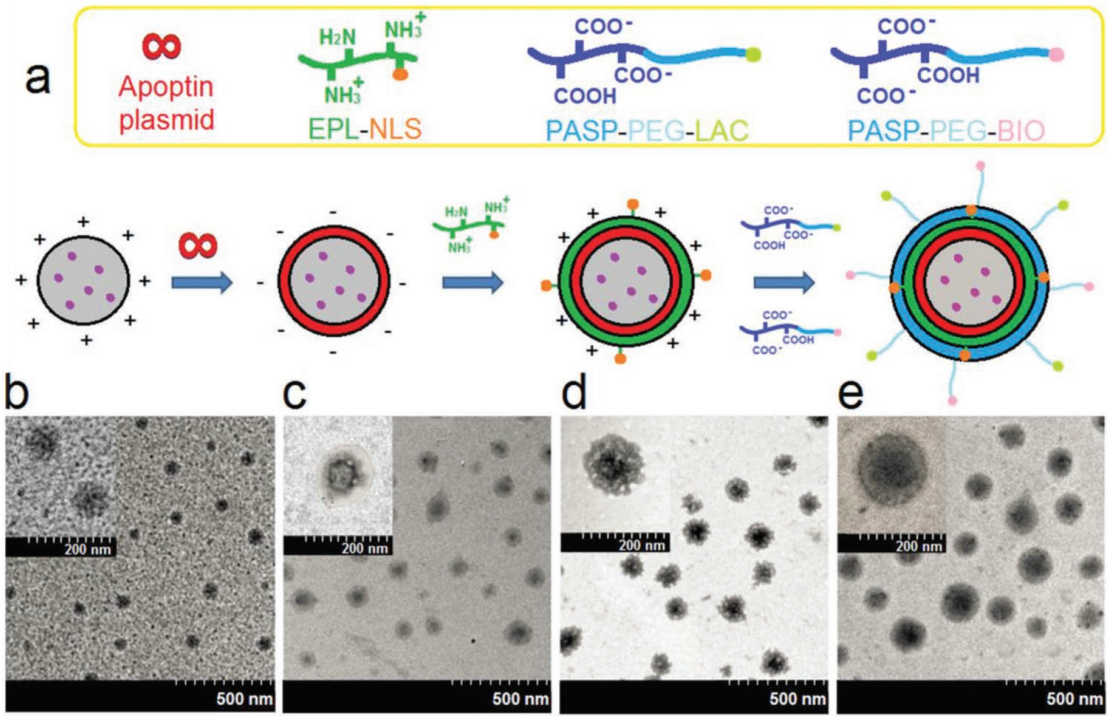
Xiujun Gao, Xi Wei. et al. Layer-by-Layer Assembly of Functional Nanoparticles for Hepatocellular Carcinoma Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201904246











