1. Angew:共價有機骨架用于光動力治療
武漢大學鄧鶴翔教授團隊設計合成了一種具有二維(2D)π-共軛的共價有機骨架(COF)并將其作為一種新型光敏劑用于進行高效的光動力治療。實驗將兩種并不能有效生成ROS的分子進行連接后得到兩種COF(COF-808和COF- 909),它們具有非常高效的ROS生成效率。這些COFs具有較高的孔隙率,其表面積分別為2270和2610 m2g-1,這一特點可以使其在細胞內增強氧的擴散和ROS的釋放。
結合其具有的優(yōu)良的光穩(wěn)定性和高的生物相容性,它們的PDT性能十分顯著。體外實驗表明,在使用COF-909進行PDT治療后,80%以上的腫瘤細胞被有效殺滅。在體內實驗中,經過10天的COF治療后可以使得腫瘤生長被顯著抑制,體現(xiàn)出優(yōu)異的活體治療效果。
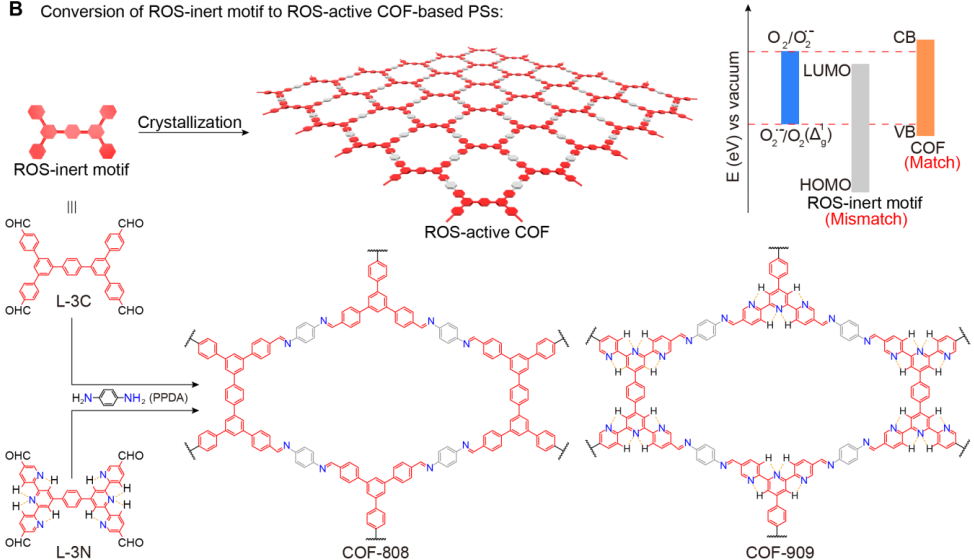
Liang Zhang, Shibo Wang, Hexiang Deng. et al. Covalent Organic Frameworks as Favorable Constructs for Photodynamic Therapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201909020
https://onlinelibrary.wiley.com/doi/10.1002/anie.201909020
2. AFM:基于陽離子聚天冬氨酸和柱狀[5]芳烴的超分子材料用于靶向抗菌
由致病菌引起的感染嚴重威脅著人類的公共健康,每年都有許多人死于耐甲氧西林的革蘭氏陽性金黃色葡萄球菌(MRSA)造成的感染。天津理工大學陳莉教授、高輝教授和吉林大學楊英威教授合作設計了四種具有不同側鏈長度的基于陽離子聚天冬氨酸和柱狀[5]芳烴的超分子材料。
陽離子季銨鹽基團可以使該聚合物插入帶負電荷的細菌膜中,進而導致膜的溶解、細菌含量的滲漏和病原體的死亡。并且這種可生物降解的聚合物除了可迅速清除MRSA外,還可通過其可裂解的骨架將微生物耐藥性降到最低。實驗也成功地將該系統(tǒng)應用于MRSA感染創(chuàng)面的體內愈合治療,進而為構建先進的抗菌生物材料提供了一種新的重要參考。
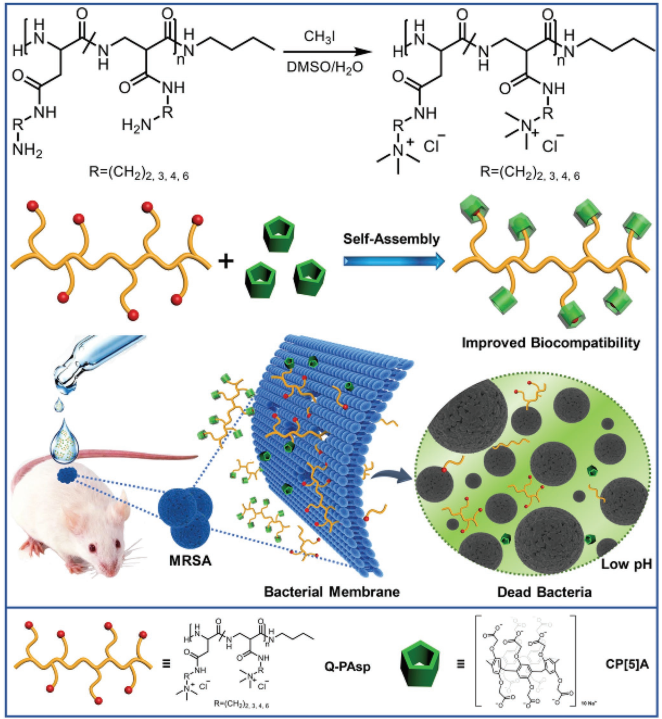
Shuzhen Yan, Ying-Wei Yang, Li Chen, Hui Gao. et al. Biodegradable Supramolecular Materials Based on Cationic Polyaspartamides and Pillar[5]arene for Targeting GramPositive Bacteria and Mitigating Antimicrobial Resistance. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201904683
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201904683
3. Small:氟化聚合物和含錳LDH納米粒子相結合用于19F MRI檢測乳腺癌
19F核磁共振成像(19F MRI)能夠在與癌癥觸發(fā)物相互作用時被激活的試劑正越來越受到關注,盡管精確和特異地檢測癌癥組織仍然存在挑戰(zhàn)。昆士蘭大學許志平教授和Andrew K. Whittaker教授合作報道了一種新型的、用于檢測乳腺癌的、pH活化的混合19F MRI試劑。該試劑是一種將全氟聚醚偶聯(lián)到含有錳的層狀雙氫氧化物(Mn-LDH@PFPE)納米顆粒的表面所構建的復合體系。
Mn-LDH@PFPE納米粒子水溶液中的19F NMR/ MRI信號會在pH為 7.4時被淬滅,只有在pH降至6.5以下后才會出現(xiàn)。這是由于Mn-LDH納米粒子中Mn2+的部分溶解以及隨后順磁弛豫效應的減弱所導致的。體內實驗表明,得益于這種腫瘤特異性激活的效應,在注射Mn-LDH@PFPE納米顆粒后,只有在乳腺癌腫瘤組織中才能檢測到19F MRI的信號。因此,該pH激活的Mn-LDH@PFPE納米粒子是一種智能化的19F MRI試劑,可用于對癌癥疾病進行精確的特異性檢測。
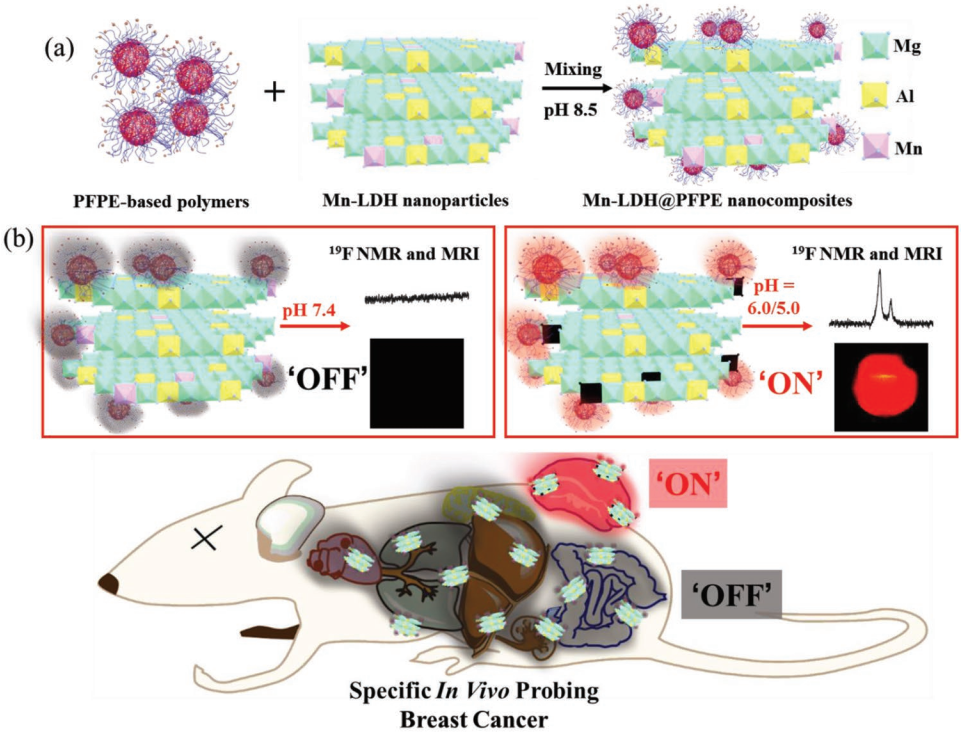
Cheng Zhang, Zhi Ping Xu, Andrew K. Whittaker. et al. Integrating Fluorinated Polymer and Manganese-Layered Double Hydroxide Nanoparticles as pH-activated 19F MRI Agents for Specific and Sensitive Detection of Breast Cancer. Small. 2019
DOI: 10.1002/smll.201902309
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.201902309
4. AM綜述:納米催化醫(yī)學
催化和生物醫(yī)學通常被認為是兩個獨立的研究領域。近年來,隨著納米化學的發(fā)展,大量的納米催化劑,如納米酶、光催化試劑和電催化試劑等也都在體內被用于啟動催化反應和調節(jié)生物微環(huán)境以實現(xiàn)治療的效果。納米催化劑在生物醫(yī)學領域的應用也得到了迅速的發(fā)展,并有望推動納米醫(yī)學這一分支學科的前進。在過去的一個世紀里,許多化學家都在努力地將具有高效和高選擇性的催化劑巧妙地轉化為納米診療藥物,通過催化反應來優(yōu)化治療的結果。
中科院上海硅酸鹽研究所陳雨研究員和施劍林研究員合作,根據(jù)催化反應的基本反應因素,對構建納米藥物的基本原理進行了綜述說明;然后全面介紹了這一新興領域的最新研究進展,并詳細討論了具有診療功能的納米催化系統(tǒng)的內在機理。
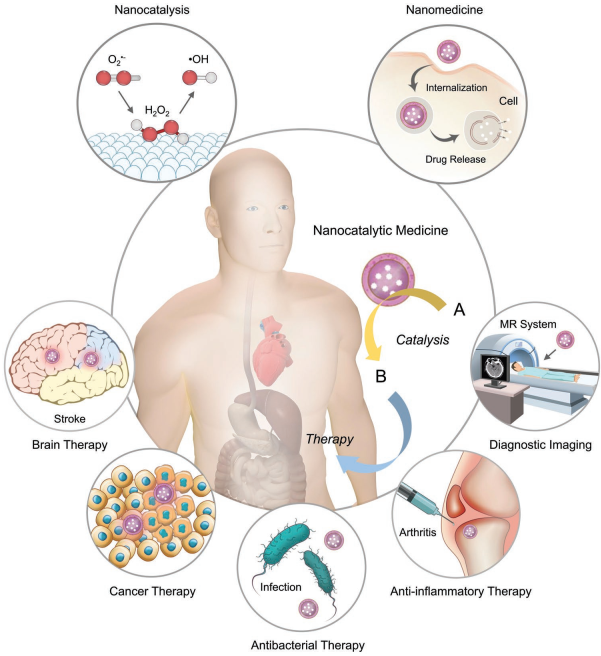
Bowen Yang, Yu Chen, Jianlin Shi. et al. Nanocatalytic Medicine. Advanced Materials. 2019
DOI: 10.1002/adma.201901778
https://onlinelibrary.wiley.com/doi/10.1002/adma.201901778
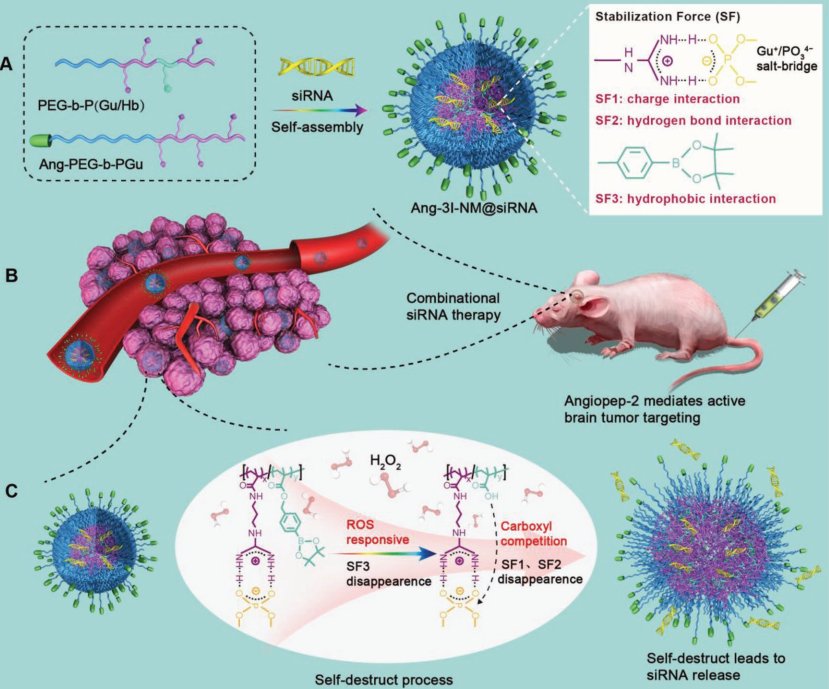
5. AM:對ROS響應的聚合siRNA納米藥物用于對膠質瘤的聯(lián)合RNAi治療
小干擾RNA (siRNA)在治療難治性疾病方面具有突出的優(yōu)勢和巨大的應用潛力。然而,目前仍然缺乏具有良好的循環(huán)穩(wěn)定性和有效遞送能力的siRNA遞送系統(tǒng),這也嚴重阻礙了siRNA的臨床治療效果。河南大學科研團隊構建了一種聚合siRNA納米藥物(3I-NM@siRNA),并通過三種相互作用(靜電、氫鍵和疏水相互作用)對其進行穩(wěn)定。與單純依賴靜電相互作用的siRNA納米藥物相比,通過額外地引入加入氫鍵和疏水相互作用后可顯著提高其生理穩(wěn)定性。
3I-NM@siRNA納米藥物可以對腫瘤活性氧(ROS)做出響應使其不穩(wěn)定并導致siRNA的釋放。實驗隨后利用angiopep-2肽功能化的3I-NM@siRNA納米藥物對療膠質母細胞瘤(GBM)進行治療。結果發(fā)現(xiàn),Ang-3I-NM@siRNA具有很好的穿透血腦屏障和腫瘤積聚的能力,因此可通過聯(lián)合靶向保羅樣激酶 1和血管內皮生長因子受體-2來有效地抑制腫瘤生長進而顯著延長原位GBM腦瘤裸鼠的生存時間。
Meng Zheng et al. ROS-Responsive Polymeric siRNA Nanomedicine Stabilized
by Triple Interactions for the Robust Glioblastoma Combinational RNAi Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201903277
https://onlinelibrary.wiley.com/doi/10.1002/adma.201903277
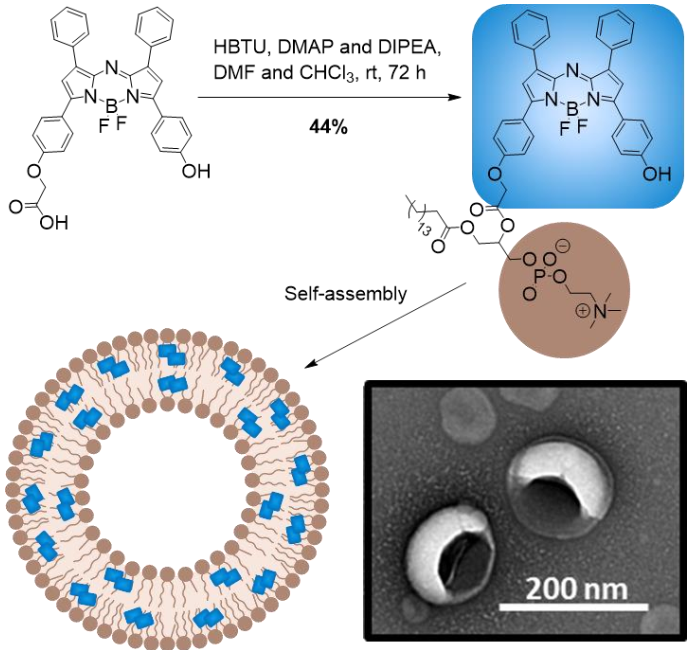
6. Angew:脂質體中的氮雜氟硼吡咯形成的J-聚集體用于光學癌癥成像
多倫多大學鄭鋼教授團隊報道了一種新型的氮雜氟硼吡咯脂質構建塊的合成并將其自組裝成了脂質體納米顆粒(BODIPYsome)。實驗觀察到,在BODIPYsome內有穩(wěn)定的近紅外J-聚集體,這是由于發(fā)生了J-二聚作用的結果。
研究結果表明,BODIPYsomes在保持高消光系數(shù)(128 mM-1cm-1)和高熒光猝滅(99.70±0.09%)的同時,其膠體穩(wěn)定性也有明顯增強,這使得其在保持完整的結構時會具有光聲(PA)的性能,而在癌細胞中被破壞后則會恢復近紅外熒光。實驗在在原位前列腺腫瘤小鼠模型上通過靜脈注射BODIPYsome24小時后,證明了它的體內光學成像(PA/熒光)性能。因此,這一研究報道的BODIPYsome也為設計光學穩(wěn)定的生物光子成像試劑提供了新的思路。
Miffy H. Y. Cheng, Gang Zheng. et al. Stable J-aggregation of an aza BODIPY-lipid in a liposome for optical cancer imaging. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201907754
https://onlinelibrary.wiley.com/doi/10.1002/anie.201907754
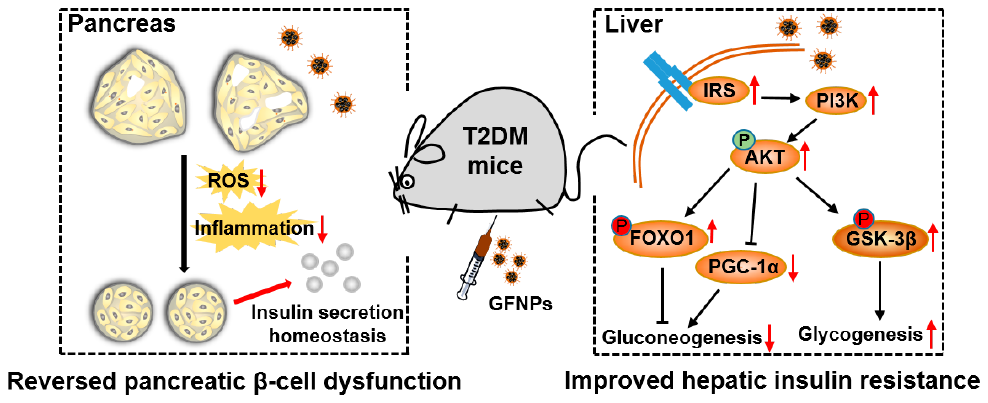
7. ACS Nano:金屬富勒烯納米顆粒可逆轉胰腺的功能紊亂以治療2型糖尿病
2型糖尿病(T2DM)是最常見的代謝性疾病之一。但是目前研究發(fā)現(xiàn),當治療T2DM停止后,再次使用抗T2DM藥物往往不起作用。中科院化學所甄明明博士和王春儒研究員合作提出了一個可持續(xù)對抗2型糖尿病的策略。
實驗對db/db糖尿病小鼠進行腹腔內給藥氨基酸功能化的金屬富勒烯納米顆粒(GFNPs),發(fā)現(xiàn)GFNPs會在胰腺和肝臟中高度積累,并可顯著降低高血糖以使得T2DM小鼠保持正常的血糖水平,甚至在停止給藥后也可以繼續(xù)維持。同時,GFNPs會通過降低氧化應激和炎癥反應來逆轉胰島功能紊亂,從根本上實現(xiàn)胰島分泌胰島素的功能正常化。機制研究表明,GFNPs可通過激活IRS2/PI3K/AKT信號通路來調控糖脂代謝,從而改善肝臟的耐胰島素特效,抑制糖異生并增加肝糖原的生成。此外,GFNPs還可減輕肝臟脂肪變性,最終維持全身的糖脂代謝平衡,并且沒有明顯的毒性。這一工作表明GFNPs可為治療T2DM提供了一個新的高效方法。
Xue Li, Mingming Zhen, Chunru Wang. et al. Gadofullerene Nanoparticles Reverse Dysfunctions of Pancreas and Improve Hepatic Insulin Resistance for Type 2 Diabetes Mellitus Treatment. ACS Nano. 2019
DOI: 10.1021/acsnano.9b02050
https://pubs.acs.org/doi/10.1021/acsnano.9b02050
8. JACS:用于標記和成像單個RNA的量子點納米信標
在活細胞中對RNA進行檢測和成像是目前研究的一大熱點,同時也面臨著諸多挑戰(zhàn),特別是對活細胞中單個RNA進行檢測和成像往往更加困難。中科院武漢病毒研究所崔宗強和武漢大學何治柯教授合作,通過一鍋水熱法,將黑洞猝滅基團(BHQ1)和硫代磷酸修飾的DNA精確地偶聯(lián)到CdTe:Zn2+ 量子點(QDs)上,構建了一種價態(tài)可控的納米信標。
實驗發(fā)現(xiàn),使用僅偶聯(lián)有一個DNA的納米信標去標記和檢測活細胞中低豐度的核酸,可在活細胞中對單個HIV-1 RNA進行檢測和成像。而將被該QDs納米信標標記的HIV-1基因組RNA封裝在子代病毒顆粒中,則可以用來跟蹤和研究單個病毒的脫殼過程。因此,這一研究也為核酸的標記和高靈敏度成像提供了一個新的平臺。

Yingxin Ma, Guobin Mao, Weiren Huang, Zhike He, Zongqiang Cui. Quantum Dot Nanobeacons for Single RNA Labeling and Imaging. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.9b04659
https://pubs.acs.org/doi/10.1021/jacs.9b04659
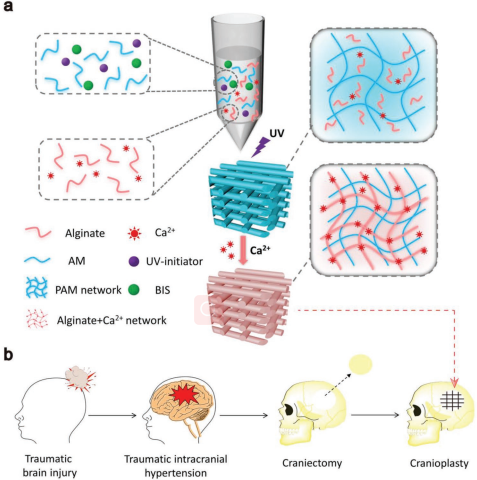
9. AFM:可3D打印的生物活性水凝膠支架用于治療創(chuàng)傷性腦損傷
外傷性腦損傷以及顱內壓增高是目前世界上最致命的損傷之一。通常情況下,患者必須經過兩個手術,即顱骨切除和顱骨成形來降低顱內壓,然后對顱骨進行修復。而傳統(tǒng)的生物材料往往會壓迫顱內組織,因此不能在顱骨切除后被直接植入。
上海交通大學醫(yī)學院宋滇文博士團隊和東華大學武培怡教授團隊合作制備了一種可3D打印的高彈性生物活性水凝膠支架,該支架能保護腦組織并適應顱內壓的變化,可以輔助營養(yǎng)物質的轉運以及骨間充質干細胞的增殖和成骨分化。體內實驗表明,該水凝膠支架能在8周內有效治療創(chuàng)傷性腦損傷,并能被安全地降解。
Lingbin Che, Peiyi Wu, Dianwen Song. et al. A 3D Printable and Bioactive Hydrogel Scaffold to Treat Traumatic Brain Injury. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201904450
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201901761
10. Nature Commun.:靶向內質網的光動力/光熱治療可增強免疫原性癌細胞的死亡率
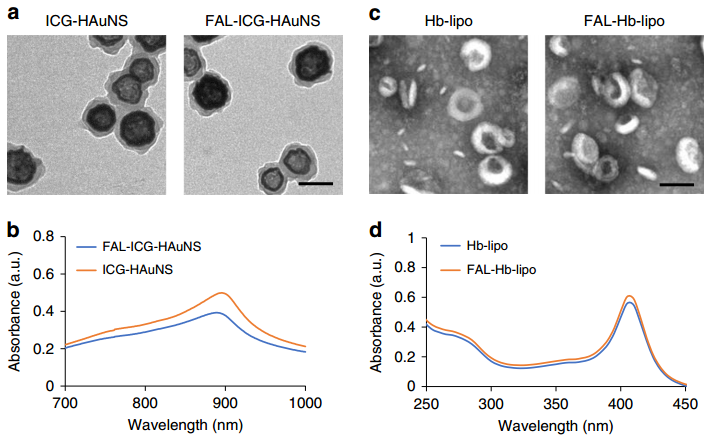
與免疫原性細胞死亡(ICD)相關的免疫原性可通過內質網(ER)應激產生的活性氧(ROS)誘發(fā)產生。浙江大學游劍教授團隊提出了一種雙靶向ER的策略來將光動力治療(PDT)、光熱治療(PTT)和免疫治療進行結合。該納米系統(tǒng)由可靶向ER的pardaxin (FAL)肽修飾的、吲哚菁綠(ICG)共軛的中空金納米球(FAL-ICG-HAuNS)和用于改善乏氧的載氧血紅蛋白(Hb)脂質體(FAL-Hb lipo)組成。
與非靶向納米系統(tǒng)相比,該靶向ER的納米材料可以在近紅外(NIR)光的照射下在細胞表面誘導產生ER應激和鈣網蛋白(CRT)的暴露。而CRT是ICD的標記物,它可作為一種“吃我”的信號去刺激樹突狀細胞發(fā)揮抗原遞呈的功能。因此,一系列的免疫反應會被激活,包括CD8+ T細胞的增殖和細胞毒性因子的分泌等。研究結果表明,該納米系統(tǒng)可通過靶向ER 進行PDT-PTT并利用基于ROS的ER應激促進ICD相關免疫治療,實現(xiàn)增強的抗腫瘤效果。
Wei Li, Jian You. et al. Targeting photodynamic and photothermal therapy
to the endoplasmic reticulum enhances immunogenic cancer cell death. Nature Communications. 2019
https://www.nature.com/articles/s41467-019-11269-8
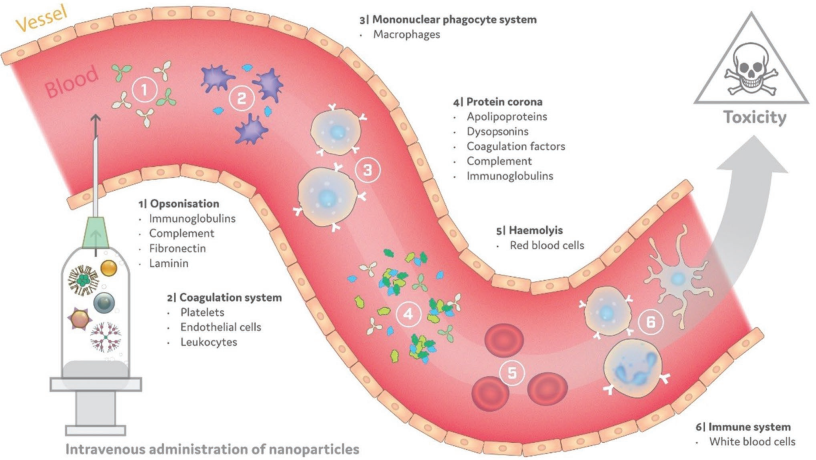
11. Adv. Sci.綜述:納米藥物的免疫毒性及其臨床轉化
盡管人們對將納米技術用于腫瘤診療領域的興趣日益高漲,但是要實現(xiàn)其臨床轉化還有很多的挑戰(zhàn)亟待解決。在被靜脈注射后,納米材料會與血液中的成分發(fā)生相互作用并產生一系列相關的免疫毒性反應。納米材料的特性(如尺寸、形狀或表面電荷)的微小變化都會對其體內的免疫特性產生重大影響。
都柏林圣三一學院Adriele Prina-Mello團隊對用于癌癥診療的納米材料,如脂質體、樹突狀大分子、介孔二氧化硅、氧化鐵、納米金和量子點等的免疫學效應進行了綜述,并對其臨床前評估所缺失的內容進行了重點介紹;同時也討論了如何通過有效的臨床前評估來避免或降低材料的免疫毒性,從而有效地推動其未來的臨床轉化。
Gary Hannon, Adriele Prina-Mello. et al. Immunotoxicity Considerations for Next Generation Cancer Nanomedicines. Advanced Science. 2019
DOI: 10.1002/advs.201900133
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201900133
12. Nano Lett.:簡單的多功能納米材料用于根除腫瘤并預防復發(fā)
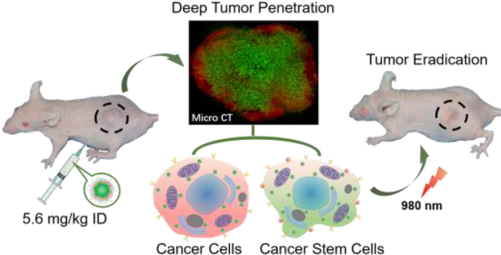
上海交大周廣東教授和陶可博士合作,通過簡單地將連有光敏劑的聚賴氨酸兩親性大分子結合到疏水的上轉化納米顆粒上制備了一種用于光動力治療(PDT)的納米藥物。
盡管該納米藥物的結構較為簡單,但其也同時具有多種功能特性,如可大量負載光敏劑、在體內外可被細胞有效地內化、在腫瘤內有廣泛的分布和對腫瘤干細胞有著強大致死性等。實驗結果表明,得益于這些功能的結合,在腹腔給藥(劑量5.6 mg/kg)后小鼠的腫瘤可被根除,并且40天后也未見復發(fā)。這一研究結果也為設計結構簡單的多功能高效納米藥物提供了一種新的策略。
Yan Liu, Guangdong Zhou, Ke Tao. et al. A Simple, Yet Multifunctional, Nanoformulation for Eradicating Tumors and Preventing Recurrence with Safely Low Administration Dose. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02053
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02053
13. AM綜述:智能熒光納米粒子的腫瘤靶向策略及其在腫瘤診療中的應用
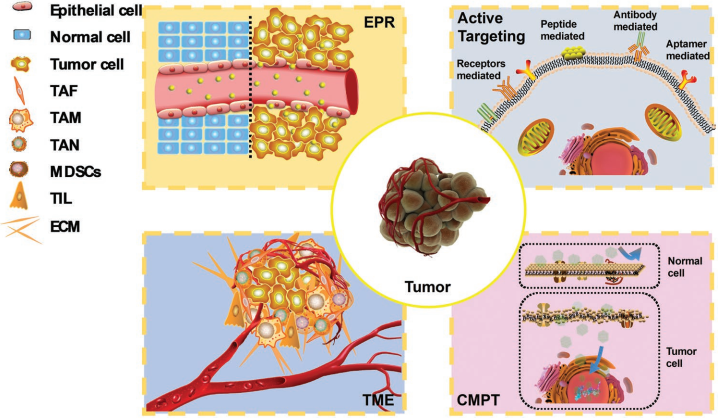
熒光納米粒子(FNPs)具有信號強度高、耐光漂白、熒光發(fā)射可調、靈敏度高、生物相容性好等優(yōu)點,非常適合用于癌癥診療領域。此外,F(xiàn)NPs也具有較大的表面積,易于對其修飾從而構建具有腫瘤靶向和相關的診療功能的多功能納米顆粒(MFNPs)。而為了獲得更好的靶向性和治療效果,就有必要對FNPs的性質和靶向機制進行充分了解。
米尼奧大學Rui L. Reis教授、上海大學吳明紅教授和王艷麗博士合作綜述了近年來被人們廣泛接受和應用的靶向機制,如EPR效應、主動靶向、腫瘤微環(huán)境(TME)靶向等;此外還對新發(fā)現(xiàn)的靶向機制即細胞膜通透性靶向(CMPT)進行了介紹,它可以將納米材料靶向腫瘤的效率從單純依靠EPR效應的不足5%提高到50%以上;最后對設計新的腫瘤靶向藥物和其臨床應用的轉化前景進行了總結。
Jiuyang He, Minghong Wu, Rui L. Reis, Yanli Wang. et al. Tumor Targeting Strategies of Smart Fluorescent Nanoparticles and Their Applications in Cancer Diagnosis and Treatment. Advanced Materials. 2019
DOI: 10.1002/adma.201902409
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902409
14. AFM:可生物降解的多功能氧化石墨烯材料用于靶向癌癥治療
斯特拉斯堡大學Alberto Bianco博士團隊利用趨化肽N -甲酰基-蛋氨酸-亮氨酸(fMLP)對氧化石墨烯(GO)進行功能化,fMLP可與甲酰基肽受體發(fā)生相互作用,后者會在包括宮頸癌細胞在內的不同癌細胞中表達。
實驗證明了GOfMLP在靶向藥物遞送和殺傷癌細胞方面具有很好的效果,同時也利用拉曼光譜和透射電鏡對其生物降解能力進行了評估。結果表明,GOfMLP易受髓過氧化物酶介導的作用發(fā)生降解,并且通過該降解作用誘導中性粒細胞發(fā)生脫顆粒。共聚焦成像和流式細胞實驗表明,與非功能化的氧化石墨烯相比,GOfMLP能夠更快地將化療藥物阿霉素遞送入細胞,從而誘導更高水平的細胞凋亡。

Cristina Martín, Alberto Bianco. et al. A Biodegradable Multifunctional Graphene Oxide Platform for Targeted Cancer Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901761
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201901761
15. ACS Nano:多功能聚多巴胺材料的合成、表面修飾及其應用
聚多巴胺(PDA)具有制備工藝簡單、生物相容性好、粘附性強、易功能化、光熱轉換效率高、猝滅效果強等優(yōu)點。并且由于PDA為合成多種多功能納米材料提供了一種簡單而通用的材料表面功能化的方法,因此越來越受到人們的重視。
中山大學曾小偉博士和南洋理工大學趙彥利教授合作綜述了關于PDA的合成、聚合機理、物理化學性質和應用等方面重要研究進展,重點介紹了近年來其在用于表面改性和生物醫(yī)學等領域的重要成果;最后對基于PDA的納米平臺在未來所面臨的挑戰(zhàn)和發(fā)展前景進行了理性的討論。
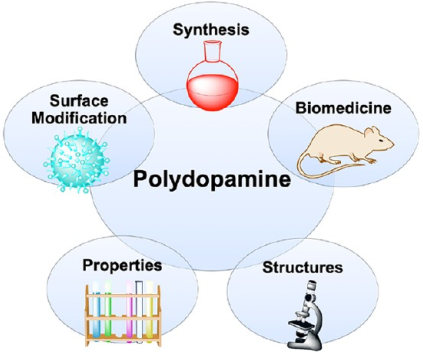
Wei Cheng, Xiaowei Zeng, Yanli Zhao. et al. Versatile Polydopamine Platforms: Synthesis and Promising Applications for Surface Modification and Advanced Nanomedicine. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04436
https://pubs.acs.org/doi/10.1021/acsnano.9b04436
16. AM:利用堿基對相互作用來保持穩(wěn)定的納米膠囊用于藥物遞送
納米藥物遞送系統(tǒng)的靶向和持續(xù)藥物釋放往往因其結構發(fā)生不可逆和不受控制的破壞而無法實現(xiàn)。福州大學宋繼彬教授團隊和美國NIH陳小元教授團隊合作制備了一種仿生納米膠囊,它是通過將聚胸腺嘧啶和光異構化聚偶氮苯(PETAzo) 進行交聯(lián)并與腺嘌呤修飾的ZnS納米顆粒(ZnS-A)通過堿基配對相連接組成的。
ZnS-A – NPs可將x射線轉化為紫外光使得偶氮苯基團發(fā)生異構化,從而使得活性載荷在雙層膜上發(fā)生可控擴散。此外,PETAzo和ZnS-A之間的堿基配對相互作用可以防止藥物在體內循環(huán)過程中發(fā)生滲漏,這樣不僅可以增強其在腫瘤中的累積,還可以使其保持穩(wěn)定。研究表明,該納米膠囊具有長時間的腫瘤保留、可遠程控制的藥物釋放、增強的腫瘤積累和有效的抗腫瘤作用等優(yōu)點,因此是一種很好的抗癌藥物遞送系統(tǒng)。
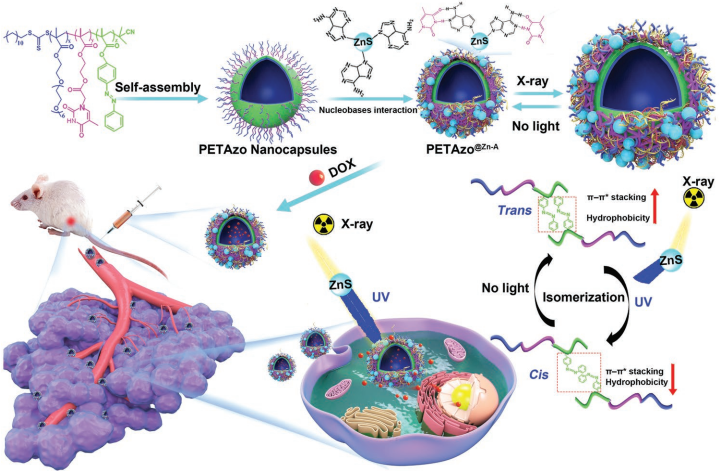
Hongzhang Deng, Jibin Song, Xiaoyuan Chen. et al. X-ray-Controlled Bilayer Permeability of Bionic Nanocapsules Stabilized by Nucleobase Pairing Interactions for Pulsatile Drug Delivery. Advanced Materials. 2019
DOI: 10.1002/adma.201903443
https://onlinelibrary.wiley.com/doi/10.1002/adma.201903443
17. Adv. Sci.:通過調節(jié)炎癥前微環(huán)境和腸道微生物群來治療炎癥性腸病
全球炎癥性腸病(IBD)的發(fā)病率和患病率正逐年上升,因此迫切需要有效和安全的IBD治療策略來對其進行控制。中國人民解放軍第三軍醫(yī)大學張建祥教授和澳門大學王瑞兵博士合作開發(fā)了一種含有預分解膜聯(lián)蛋白A1模擬肽 Ac2-26的納米顆粒AON,它可以通過響應在病變部位高表達的活性氧(ROS)來釋放Ac2-26。并且AON能有效保護Ac2-26在胃腸道內富含酶的環(huán)境中不被降解。
實驗在利用AON對炎癥性腸病小鼠的結腸進行治療時發(fā)現(xiàn),炎癥部位的ROS水平升高時,AON會位點特異性地釋放Ac2-26。因此,AON治療能有效降低促炎介質的表達,減弱炎癥細胞的轉運和滲透,促進對凋亡中性粒細胞的胞葬作用并提高巨噬細胞的表型轉換效率。結果表明,AON可減輕炎癥癥狀,加速腸粘膜傷口愈合,同時也能重組腸道的微生物種群并增加短鏈脂肪酸的產生,且小鼠在口服這種納米藥物后也表現(xiàn)出良好的生物安全性。
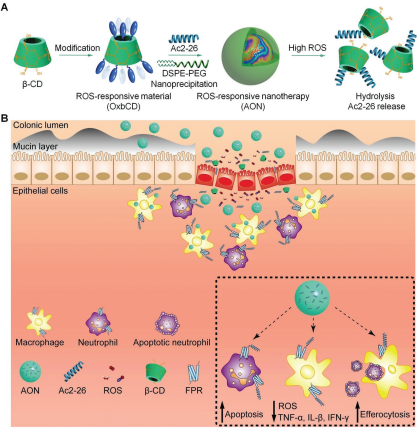
Chenwen Li, Ruibing Wang, Jianxiang Zhang. et al. A Proresolving Peptide Nanotherapy for Site-Specific Treatment of Inflammatory Bowel Disease by Regulating Proinflammatory Microenvironment and Gut Microbiota. Advanced Science. 2019
DOI: 10.1002/advs.201900610
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201900610
18. ACS Nano:核殼納米結構用于對親水性貨物的刺激響應型遞送
傳統(tǒng)的用于遞送親水材料的系統(tǒng)在實際應用中面臨著許多挑戰(zhàn),例如較差的保留能力、缺乏刺激響應性和較低的生物利用度等。康奈爾大學Alireza Abbaspourrad團隊提出了一種適用于遞送親水性貨物的封裝策略,即構造具有優(yōu)異穩(wěn)定性和多功能的水核-椰殼納米結構。
實驗以花青素為親水性材料模型,證明了這些納米膠囊具有很高的包封效率、載藥量、對環(huán)境應力的耐受性、生物相容性和被細胞吸收的能力。此外,這種由共價鍵和靜電作用共同驅動形成的納米膠囊也具有對pH和氧化還原這兩種刺激進行響應的能力。
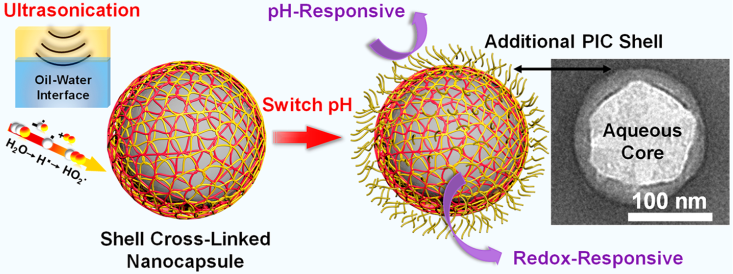
Chen Tan, Alireza Abbaspourrad. et al. A Robust Aqueous Core?Shell?Shell Coconut-like Nanostructure for Stimuli-Responsive Delivery of Hydrophilic Cargo. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03049
https://pubs.acs.org/doi/10.1021/acsnano.9b03049
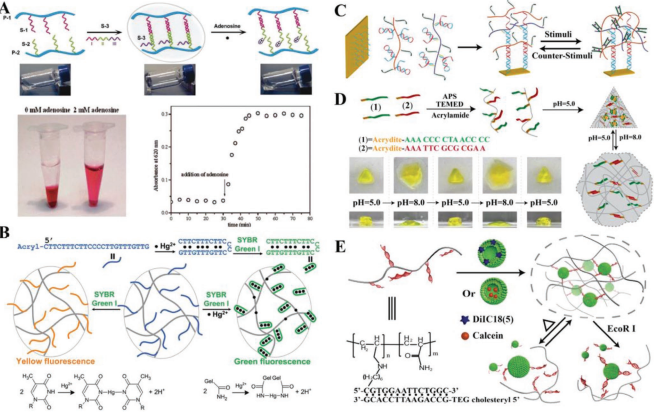
19. AM:用于生物傳感和生物醫(yī)學應用的DNA水凝膠和微凝膠
DNA水凝膠具有DNA功能基序的獨特性質,如特異性分子識別、可編程和高精度組裝、多功能和良好的生物相容性等,在諸多領域尤其是生物傳感和生物醫(yī)學等方面體現(xiàn)出很好的應用價值。而智能DNA水凝膠可以通過改變其膨脹體積、交聯(lián)密度和光學或機械性能等來對外界刺激作出響應,這也大大促進了基于DNA水凝膠的體外生物傳感系統(tǒng)的發(fā)展。
當將DNA水凝膠的尺寸縮小到微米或納米級時,其響應性和遞送能力往往會更好,從而滿足快速檢測、體內實時傳感和藥物遞送等應用的需要。南開大學郭瑋煒教授團隊綜述了近年來對用于生物傳感和生物醫(yī)學領域的智能DNA水凝膠和DNA微凝膠的研究進展,并對其面臨的挑戰(zhàn)和未來的發(fā)展前景進行了展望。
Fengyun Li, Weiwei Guo. et al. DNA Hydrogels and Microgels for Biosensing and Biomedical Applications. Advanced Materials. 2019
DOI: 10.1002/adma.201806538
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.201806538
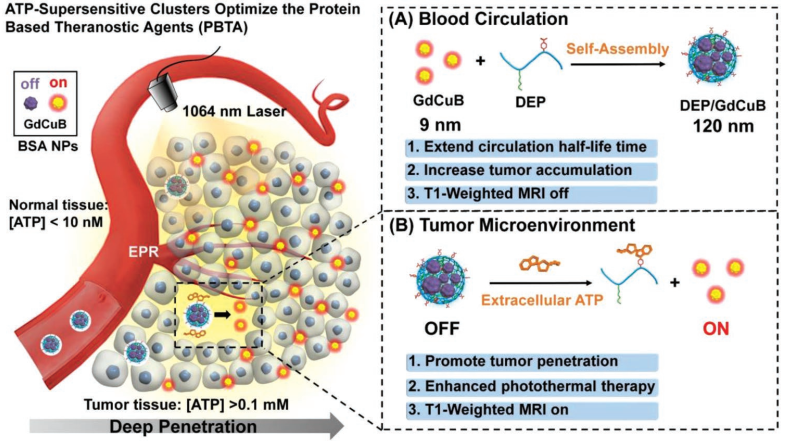
20. AFM:尺寸可變的納米團簇用于磁共振成像指導的光熱治療
基于蛋白質的診療試劑 (PBTA)在癌癥的診療方面具有優(yōu)越的性能,但是其在體內的應用也會受到不良的積累、滲透和選擇性等因素的限制。中國醫(yī)科大學孫敏捷博士團隊制備了一種對ATP超敏感的蛋白簇,用于增強PBTA的遞送和實現(xiàn)磁共振成像(MRI)指導的腫瘤光熱治療。
實驗將尺寸為9nm,共負載有Gd3+和CuS的牛血清白蛋白納米顆粒(GdCuB)為模型,將其封裝進電荷可變的聚合陽離子(DEP)中形成了120 nm的DEP/ GdCuB納米團簇。實驗表明,DEP/GdCuB具有較長的血液循環(huán)半衰期,因此其在腫瘤中的積累效果較好。當其到達腫瘤部位后,細胞外的腺苷三磷酸(ATP)可以有效地觸發(fā)GdCuB的釋放,實現(xiàn)其向腫瘤的深處滲透并激活T1加權的磁共振成像指導的腫瘤光熱治療。
Zhanwei Zhou, Minjie Sun. et al. Size Switchable Nanoclusters Fueled by Extracellular ATP for Promoting Deep Penetration and MRI-Guided Tumor
Photothermal Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201904144
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201904144
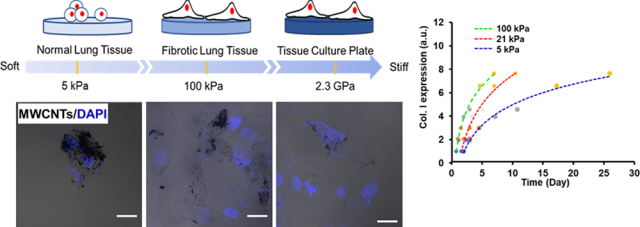
21. Nano Lett.:碳納米管誘導的肺纖維化與基質硬度相關
大多數(shù)的活體組織都具有特定的硬度,并且對細胞行為有著重要深遠的影響。而這種硬度是如何影響細胞對納米材料的反應這一問題目前還尚未闡明。北德州大學楊勇教授團隊研究了基質硬度這一因素對多壁碳納米管(MWCNTs)誘導正常人肺成纖維細胞(NHLFs)發(fā)生成纖維反應的影響。
實驗在與人類正常肺組織和纖維化肺組織具有相當硬度的聚丙烯酰胺(PAAm)水凝膠上培養(yǎng)NHLFs,并利用MWCNTs做不同時長的處理。結果觀察到NHLFs的成纖維反應,包括細胞增殖、活性氧的產生和膠原I的表達等都會受到基質硬度的影響。具體來說,NHLFs在軟凝膠上時會需要較長的處理時間才能表現(xiàn)出纖維化反應;而在硬水凝膠上通過短時間的MWCNTs處理就足以誘導纖維化反應。機制研究表明,MWCNTs可通過促進局灶性粘附激酶(FAK)的表達和磷酸化來誘導NHLFs的纖維化形成,并且當在硬凝膠上時還通過可以減弱細胞內的張力以增加細胞對MWCNTs的攝取,從而提高纖維化反應。這一研究表明增加基質剛度可以加速纖維化的形成,也為合理設計用于納米毒理學研究的體外模型提供了新的依據(jù)。
Kai Wang, Yong Yang. et al. Substrate Stiffness-Dependent Carbon Nanotube-Induced Lung Fibrogenesis. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01943











