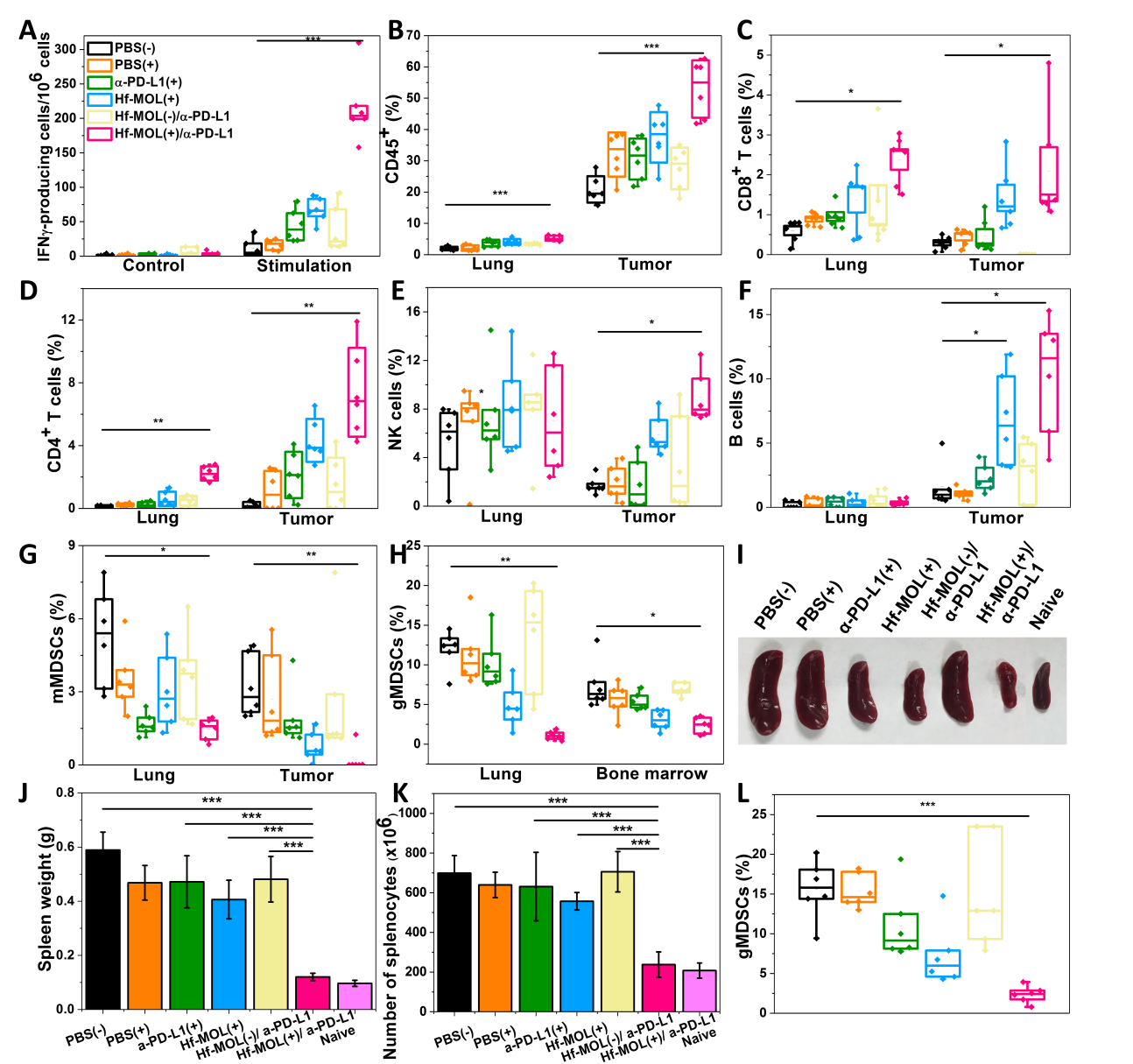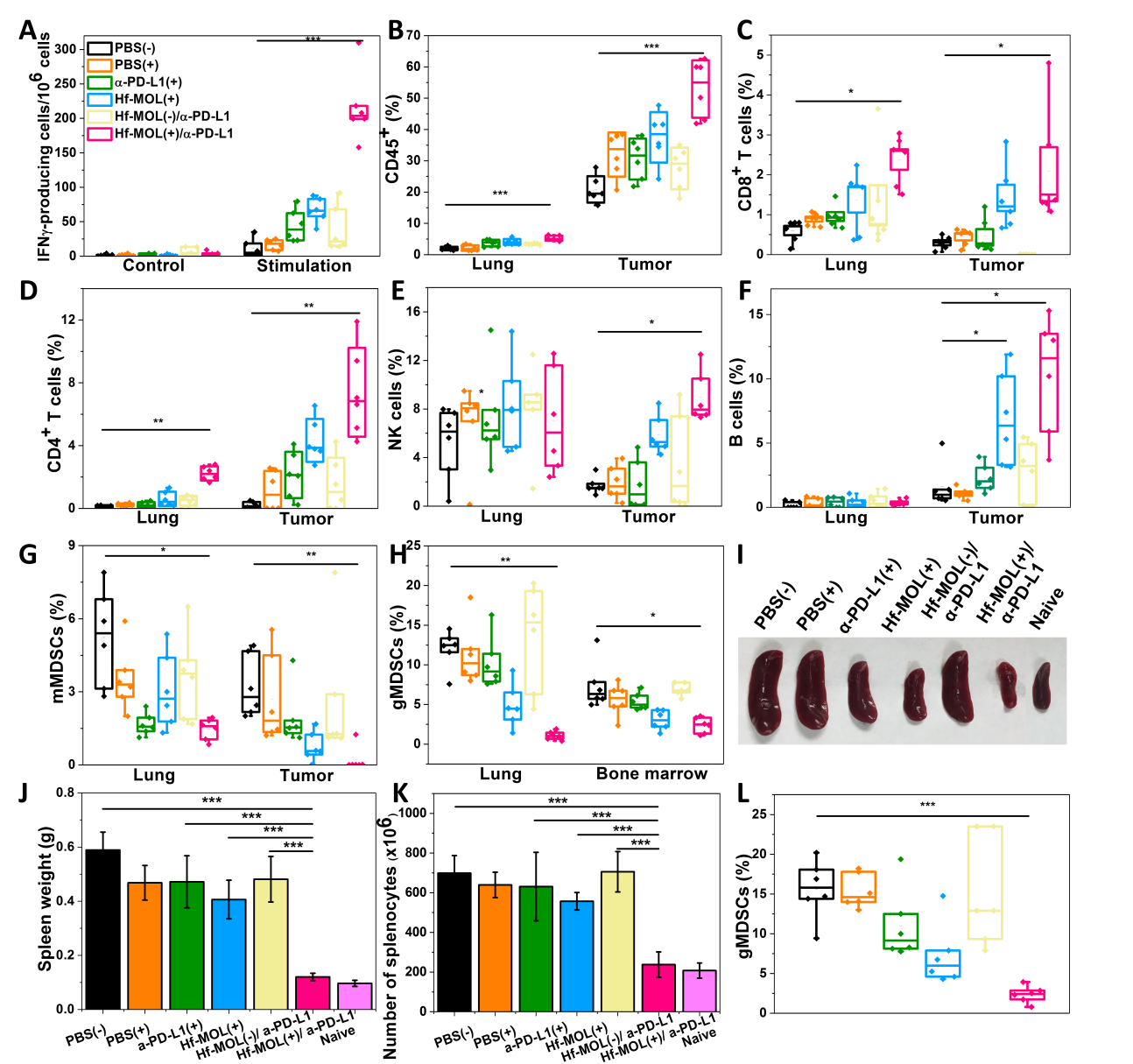1. 首次報(bào)道了單層結(jié)構(gòu)的Hf-MOL用于增強(qiáng)放射-放射動力治療。2. nMOL介導(dǎo)的放射-放射動力治療與免疫檢測點(diǎn)阻斷療法有效結(jié)合協(xié)同消除原位腫瘤,更能抑制遠(yuǎn)端轉(zhuǎn)移。3. 報(bào)道的聯(lián)合治療有效降低gMDSCs,具有抑制遠(yuǎn)端轉(zhuǎn)移灶的形成作用。免疫療法是目前癌癥治療的研究熱點(diǎn)。腫瘤可以逃避免疫監(jiān)視,通過調(diào)節(jié)信號通路紊亂、劫持免疫抑制細(xì)胞和細(xì)胞因子、耗竭效應(yīng)細(xì)胞和分子,從而避免被免疫系統(tǒng)消除。免疫檢測點(diǎn)阻斷療法(checkpoint blockade immunotherapy,CBI)能夠通過抗體阻斷程序性細(xì)胞死亡蛋白-1(PD-1)及其與配體(PD-L1)等負(fù)向免疫調(diào)控通路以重新激活腫瘤免疫。近年來,被批準(zhǔn)的幾種抗PD-1和抗PD-L1抗體在一些癌癥上表現(xiàn)出良好的治療效果,已在美國、歐洲和中國獲批用于臨床。然而,T細(xì)胞浸潤低、腫瘤抗原提呈效率不夠、以及缺少對宿主免疫系統(tǒng)的激活等諸多因素使得疫檢測點(diǎn)阻斷療法在針對實(shí)體瘤時(shí)表現(xiàn)不佳。因此,尋找有效的致免疫原性的輔助療法用于與免疫檢測點(diǎn)阻斷療法結(jié)合成為進(jìn)一步提升癌癥治療的新方向。目前,常用的光動力療法、光熱療法已被證明具有很強(qiáng)的致免疫原性,能有效與CBI結(jié)合。然而,由于光存在組織穿透性差的缺點(diǎn),使得這些療法難以實(shí)現(xiàn)臨床應(yīng)用。而廣譜的放射療法使用組織穿透性好的高能射線作為外界能量源殺傷腫瘤細(xì)胞產(chǎn)生局部炎性可有效解決這一問題。目前,臨床上已有超過150項(xiàng)在研實(shí)驗(yàn)正在論證放療與CBI聯(lián)用的療效與愈后。然而,低腫瘤灶能量截留與低癌細(xì)胞毒性限制了放療用于腫瘤特異性殺傷結(jié)合CBI的潛力。基于這些問題,林文斌團(tuán)隊(duì)報(bào)道了首例nMOF介導(dǎo)的局部療法,放射-放射動力治療(RT-RDT),并向臨床轉(zhuǎn)化。在X射線照射下,作為節(jié)點(diǎn)的鉿團(tuán)簇能有效截流X射線,通過輻射解離(radiolysis)生成羥基自由基(Nat. Comms., 2018, 9 (1),2351),同時(shí)將能量轉(zhuǎn)移到光敏配體如銥、釕等金屬配合物(Nat. Comms., 2018, 9 (1),4321;J. Am. Chem. Soc., 2019, 141(17), 6859-6863)以及卟啉(Nat. Biomed. Eng. 2018, 2 (8), 600)上生成單線態(tài)氧。而相比于三維的納米放療增敏劑,單層的二維結(jié)構(gòu)可以大大提高自由基的擴(kuò)散效率,進(jìn)一步提高放射-放射動力療效(Angew. Chem. 2017, 129 (40),12270-12274; J. Am. Chem. Soc., 2019, 140 (49), 16971-16975)。納米金屬有機(jī)框架材料(nanoscale metal-organic framework, nMOF),作為一種新興的分子納米材料,因其自身的多孔性,結(jié)構(gòu)規(guī)整性,后修飾方便,結(jié)構(gòu)及組成可調(diào)性強(qiáng)等優(yōu)點(diǎn),近年來在納米醫(yī)學(xué)領(lǐng)域得到廣泛關(guān)注。過去十多年里,芝加哥大學(xué)的林文斌課題組開拓了nMOF在納米醫(yī)學(xué)領(lǐng)域多個方向的應(yīng)用,其中包括癌癥診斷、藥物載運(yùn)與可控釋放、光動力治療與放射治療等。在此基礎(chǔ)上,林文斌課題組近幾年開發(fā)出了一種新型納的納米金屬有機(jī)單層(nanoscale metal-organic layer, nMOL)材料,將三維的nMOF的厚度降低到單層(<2nm), 極大提高原子利用率的同時(shí),提高了藥物的負(fù)載及活性氧物種的擴(kuò)散,在生物傳感與癌癥治療等領(lǐng)域具有廣泛的應(yīng)用前景。近日,林文斌課題組首次報(bào)道了基于直線型卟啉基橋連配體與重金屬鉿-氧團(tuán)簇作為金屬節(jié)點(diǎn)的nMOL用于增強(qiáng)放射-放射動力治療并證明了nMOL增強(qiáng)的局部治療可通過高效地引發(fā)免疫原性細(xì)胞死亡,提高腫瘤炎性,激活系統(tǒng)免疫,進(jìn)而協(xié)同增強(qiáng)系統(tǒng)性免疫檢查點(diǎn)阻斷治療。在具有肺轉(zhuǎn)移能力的三陰性乳腺癌模型上,研究人員觀察到聯(lián)合療法有效緩解脾臟腫大,進(jìn)而發(fā)現(xiàn)聯(lián)合治療組可有效降低脾臟,骨髓與肺內(nèi)的粒細(xì)胞型髓源抑制細(xì)胞(granulocytic myeloid-derived suppressor cells, gMDSCs),阻遏遠(yuǎn)端的間質(zhì)-上皮轉(zhuǎn)化過程(MET)從而抑制遠(yuǎn)端轉(zhuǎn)移灶的形成。
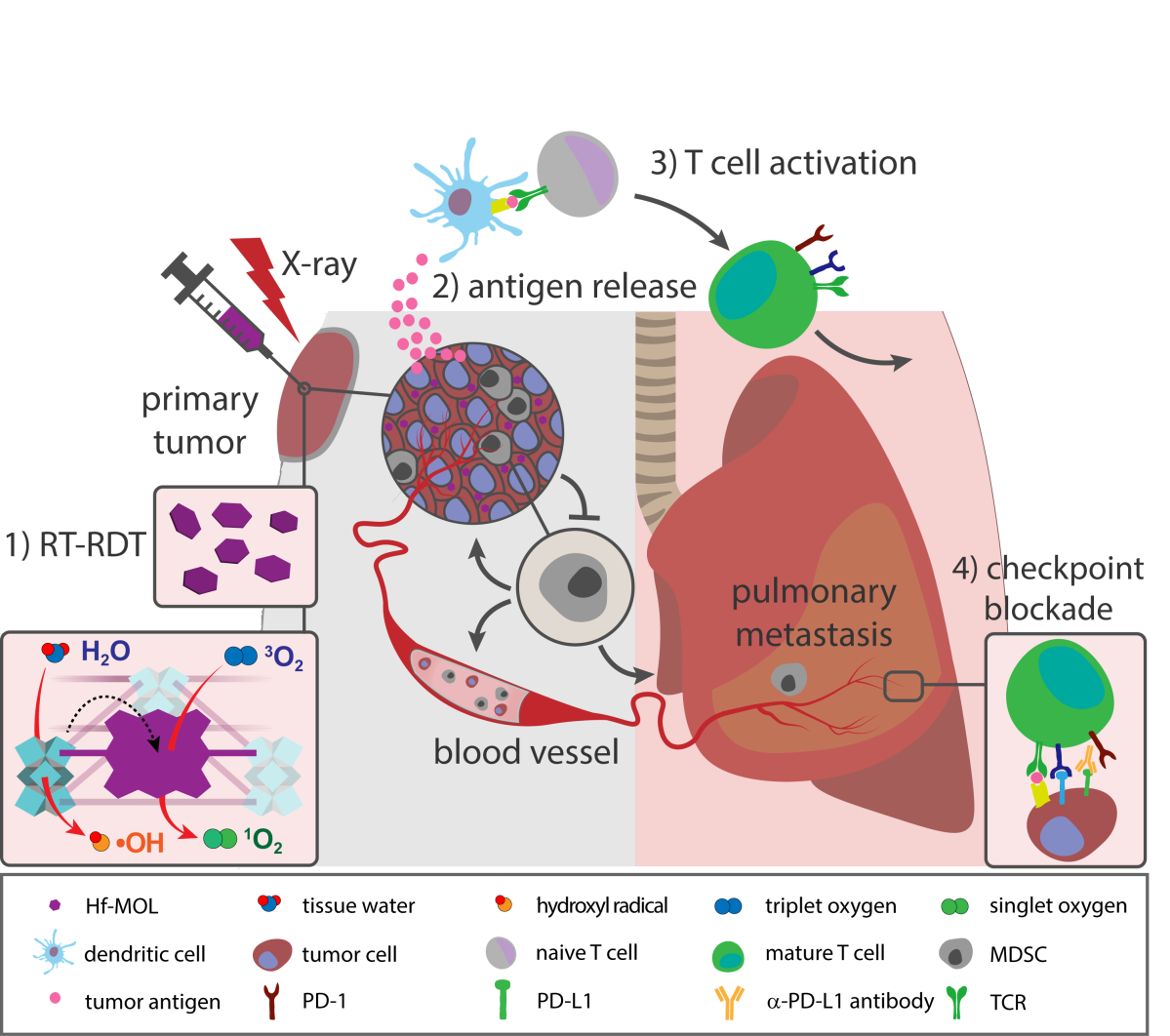
圖1. 二維金屬有機(jī)單層介導(dǎo)放射-放射動力治療并結(jié)合免疫檢測點(diǎn)阻斷治療實(shí)現(xiàn)抗癌癥轉(zhuǎn)移要點(diǎn)1:溶劑熱法制備單層結(jié)構(gòu)的Hf-MOL研究人員用溶劑熱法將鉿氧簇與直線型雙羧酸的卟啉配體(DBP)組裝合成,并通過調(diào)控溫度和濃度等參數(shù),得到具有單層結(jié)構(gòu)的Hf-MOL。與之前報(bào)道的Hf-DBP nMOF(Hf-MOF)相比,高分辨透射電鏡(HRTEM)與原子力顯微鏡(AFM)結(jié)果表明所合成Hf-MOL為直徑~200 nm,高度約1.6nm的納米單層,其厚度對應(yīng)一個二級結(jié)構(gòu)單元(secondary building unit, SBU)。而Hf-MOF為直徑~100 nm、厚度為10~20nm的納米板。SOSG譜圖表明,在相同光照下,Hf-MOL比Hf-MOF生成了更多可檢測的單線態(tài)氧,證明了單層結(jié)構(gòu)可避免底物與產(chǎn)物的擴(kuò)散限速從而提高自由基介導(dǎo)的局部療效。
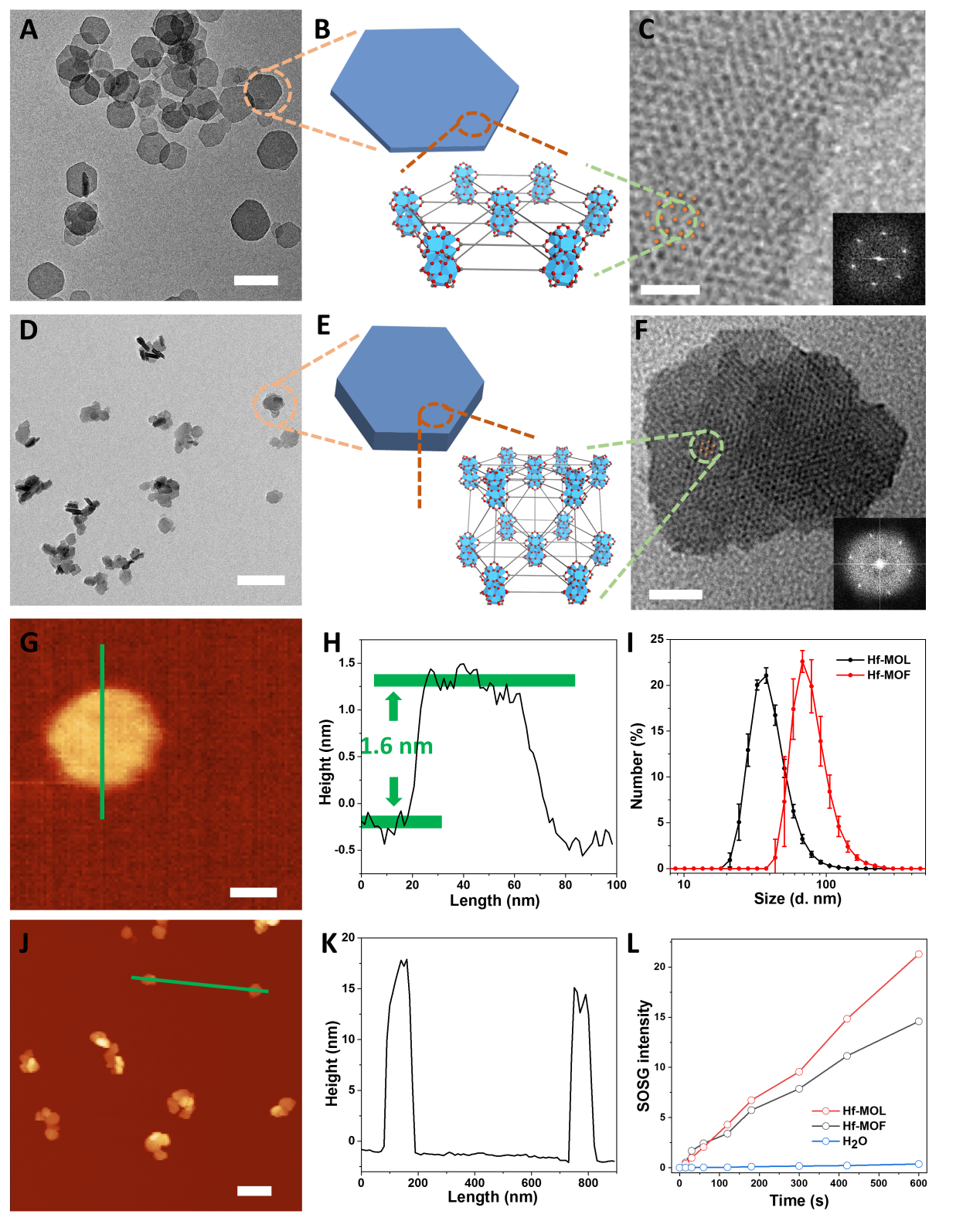
圖2. Hf-MOL的形貌與結(jié)構(gòu)表征。(A,B,C)Hf-MOL的TEM, 結(jié)構(gòu)示意圖,HRTEM與 FFT 圖樣。(A,B,C)Hf-MOF的TEM, 結(jié)構(gòu)示意圖,HRTEM與 FFT 圖樣。(G,H)Hf-MOL的原子力顯微鏡圖像及高度剖面。(J,K)Hf-MOF的原子力顯微鏡圖像及高度剖面。(I) Hf-MOL與Hf-MOF的動態(tài)光散射。(I) Hf-MOL與Hf-MOF的單線態(tài)氧產(chǎn)生。在證明Hf-MOL具有良好的生物環(huán)境穩(wěn)定性后,一種具有相同SBU但不能生成單線態(tài)氧的nMOF, Hf-DBA,作為對照來評價(jià)Hf-MOL介導(dǎo)的RT-RDT療效。在X射線(或伽馬射線)照射下,相比于Hf-DBA,Hf-MOL具有更強(qiáng)的細(xì)胞急性毒性與長期抑制分裂能力。機(jī)理研究顯示,Hf-MOL介導(dǎo)的RT-RDT通過單線態(tài)氧與羥基自由基兩種活性氧物種實(shí)現(xiàn)輻射增強(qiáng),破壞DNA雙鏈,誘導(dǎo)細(xì)胞凋亡并抑制腫瘤侵襲。
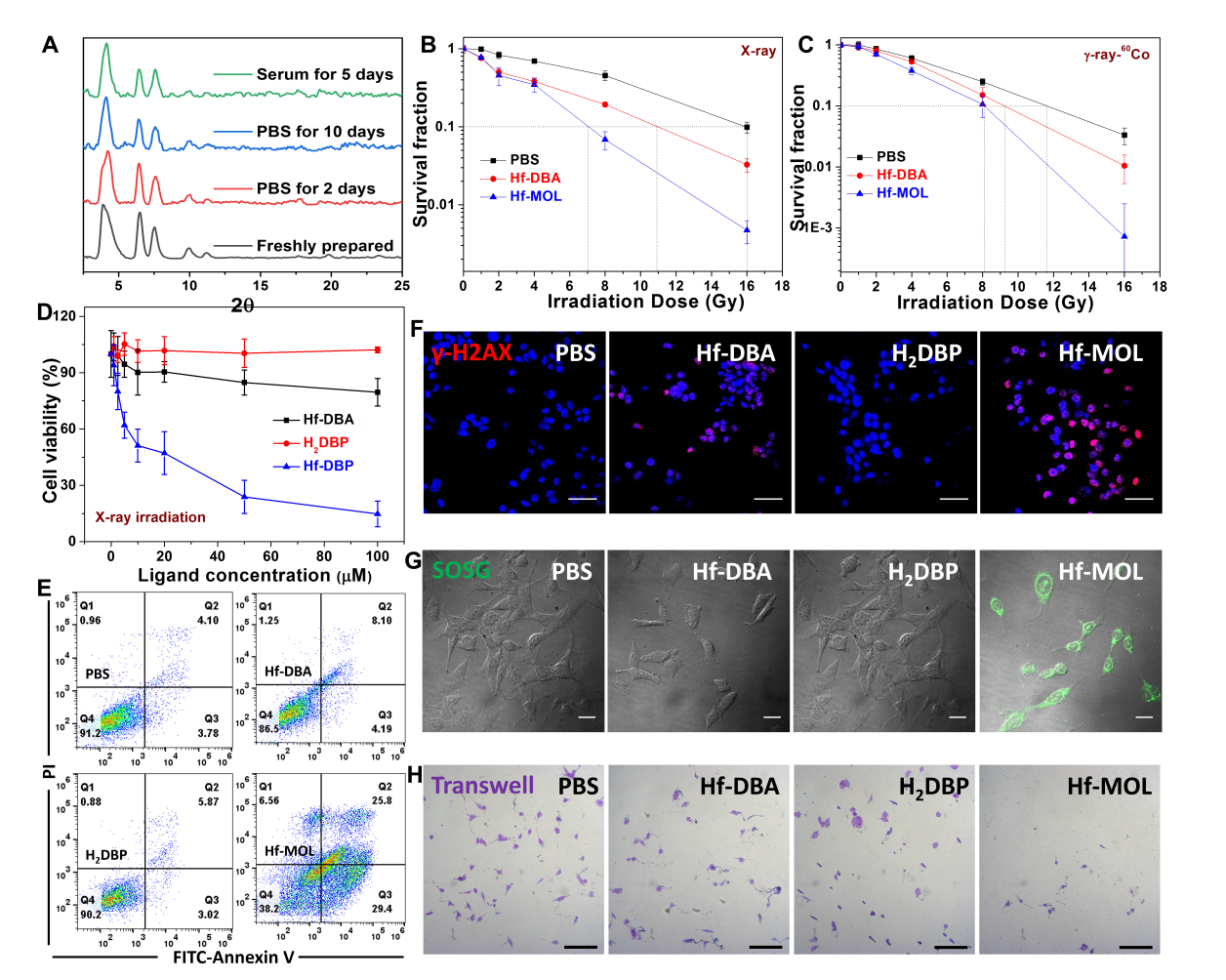
圖3. Hf-MOL的RT-RDT。(A)Hf-MOL的穩(wěn)定性測試。(B,C)X射線與伽馬射線下Hf-MOL的群落生成實(shí)驗(yàn)。(D,E)X射線下Hf-MOL的細(xì)胞毒性、細(xì)胞凋亡。(F,G,H)X射線下的DNA雙鏈斷裂檢測、單線態(tài)氧檢測與細(xì)胞侵襲檢測。要點(diǎn)3:評價(jià)Hf-MOL介導(dǎo)的RT-RDT的致免疫原性接著,研究人員評價(jià)了Hf-MOL介導(dǎo)的RT-RDT的致免疫原性。通過細(xì)胞層面上檢測鈣網(wǎng)蛋白(CRT),高遷移率族蛋白B1(HMGB-1)和三磷酸腺苷(ATP)三種指標(biāo),Hf-MOL介導(dǎo)的RT-RDT的致免疫原性顯著高于nMOF介導(dǎo)的放療。研究者將體外接受過RT-RDT治療的三陰性乳腺癌細(xì)胞4T1注射到小鼠皮下,一周再在另一邊注射正常活力的4T1細(xì)胞發(fā)現(xiàn),RT-RDT處理過的4T1細(xì)胞使小鼠具備了4T1癌細(xì)胞的抗性。
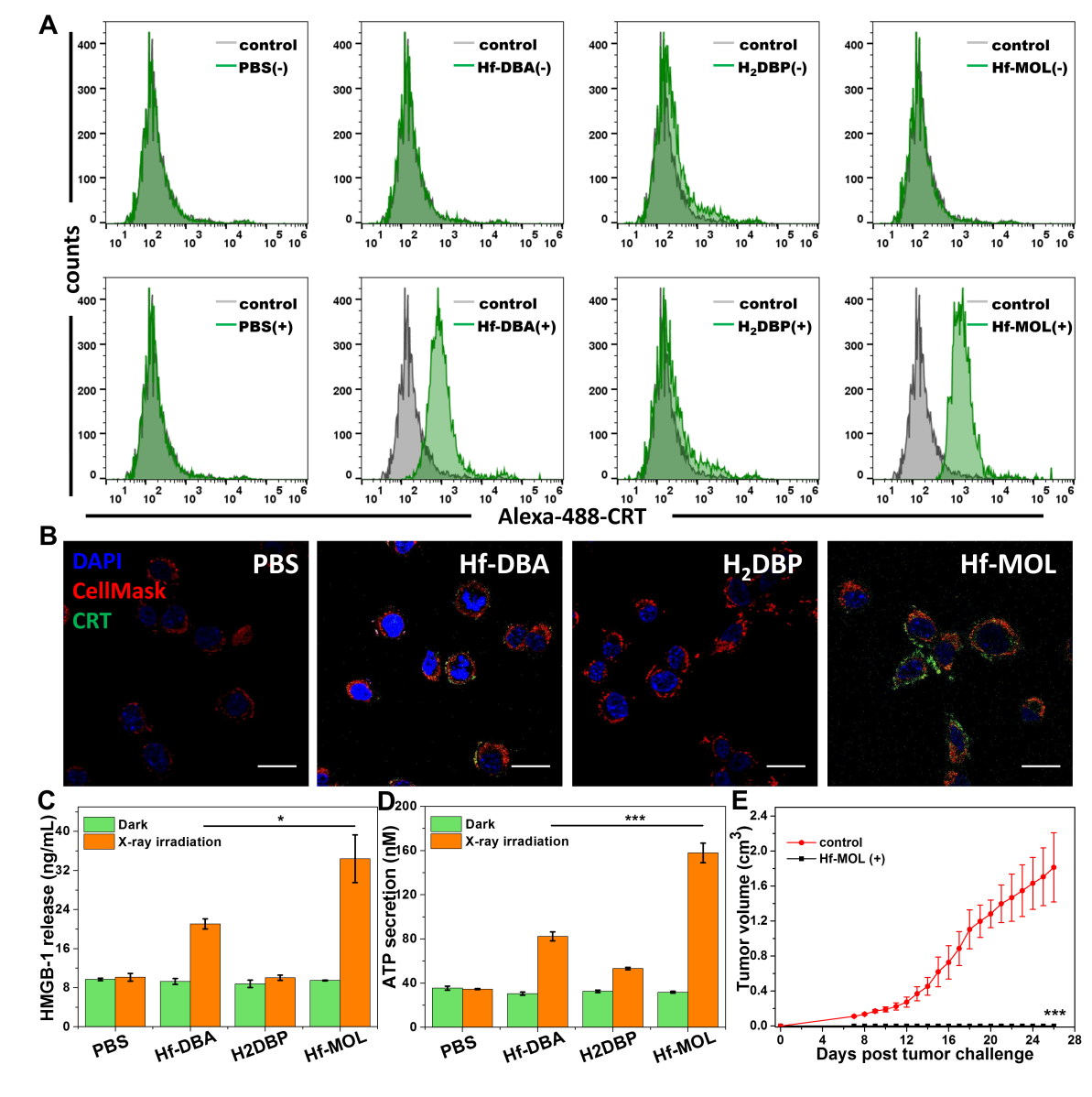
圖4. Hf-MOL介導(dǎo)RT-RDT的致免疫原性。(A,B)流式細(xì)胞術(shù)與共聚焦顯微成像檢測CRT。(C,D)X酶聯(lián)免疫檢測HMGB-1與ATP的細(xì)胞釋放。(E)接受癌癥疫苗小鼠的腫瘤再刺激。要點(diǎn)4:Hf-MOL可協(xié)同PD-L1抗體實(shí)現(xiàn)全身性的抑制腫瘤與抗轉(zhuǎn)移療效在細(xì)胞層面證明之后,實(shí)驗(yàn)人員通過在Balb/c小鼠上構(gòu)建伴肺部轉(zhuǎn)移的原位三陰性乳腺癌模型來證明Hf-MOL可協(xié)同PD-L1抗體實(shí)現(xiàn)全身性的抑制腫瘤與抗轉(zhuǎn)移療效。研究人員僅對原位乳腺瘤給予Hf-MOL注射和X射線照射。實(shí)驗(yàn)發(fā)現(xiàn),單獨(dú)施加Hf-MOL介導(dǎo)的RT-RDT能有效的抑制原位腫瘤,但無法實(shí)現(xiàn)對遠(yuǎn)端轉(zhuǎn)移的抑制;聯(lián)用Hf-MOL介導(dǎo)的RT-RDT與PD-L1抗體介導(dǎo)的CBI與不僅能極大消除原位腫瘤,更能有效的抑制遠(yuǎn)端轉(zhuǎn)移,實(shí)現(xiàn)了很好的遠(yuǎn)位效應(yīng)。這些實(shí)驗(yàn)表明,Hf-MOL介導(dǎo)的放射-放射動力治療聯(lián)合抗PD-L1免疫檢測點(diǎn)阻斷療法[Hf-MOL/?-PD-L1(+)]能顯著提高系統(tǒng)免疫響應(yīng),產(chǎn)生卓越的抗轉(zhuǎn)移療效。
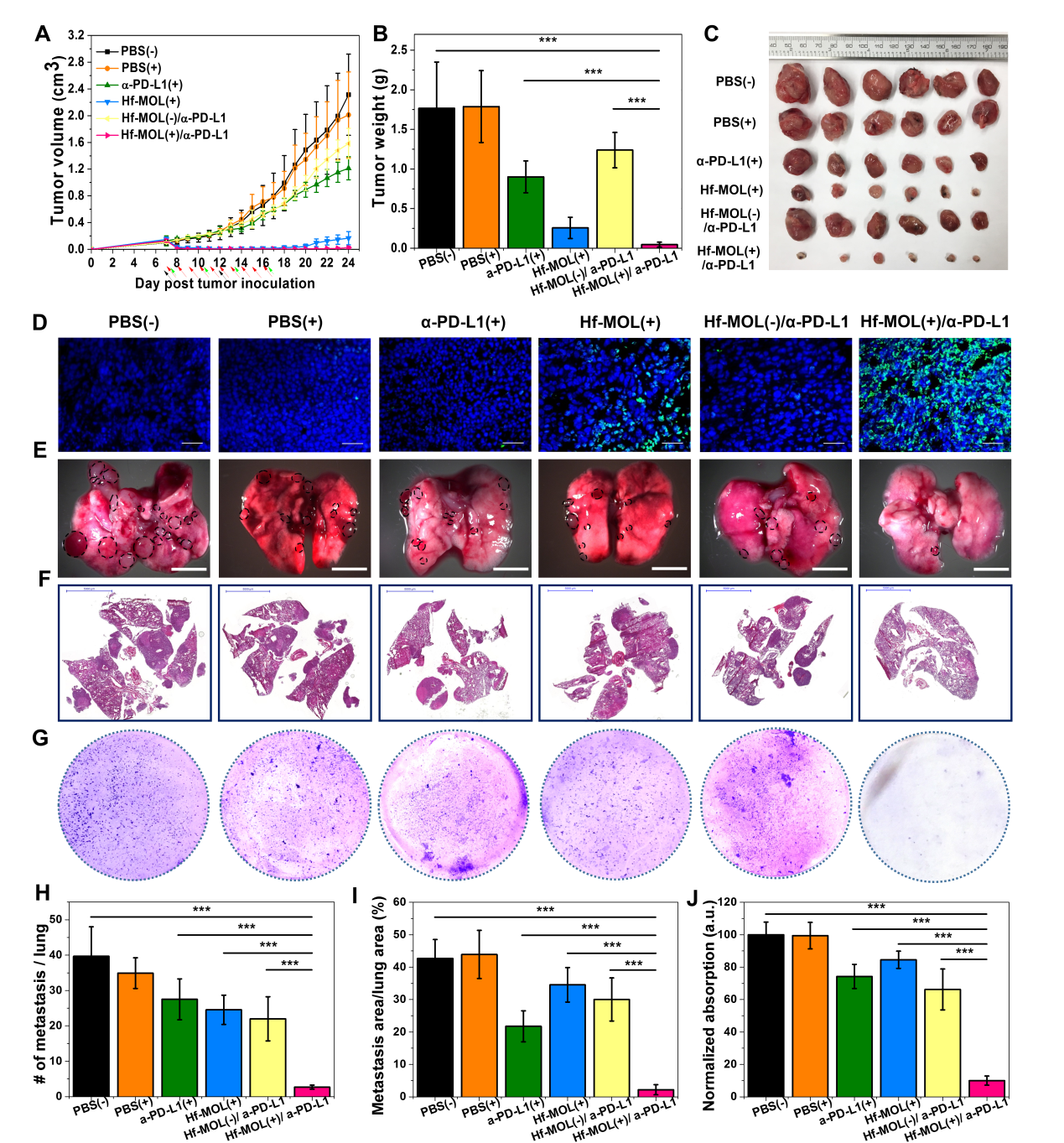
圖5. Hf-MOL介導(dǎo)RT-RDT的抗癌療效。(A,B,C)原位腫瘤生長、腫瘤照片與瘤重。(D)原位腫瘤的凋亡(TUNEL)切片免疫熒光染色。(E,F,G)肺部光學(xué)照片,H&E切片染色及克隆形成實(shí)驗(yàn)。要點(diǎn)5:聯(lián)合治療緩解免疫抑制和抑制遠(yuǎn)端轉(zhuǎn)移灶研究人員針對聯(lián)合治療后腫瘤微環(huán)境中免疫細(xì)胞的浸潤情況進(jìn)行分析,流式細(xì)胞檢測表明腫瘤中腫瘤特異性的效應(yīng)T細(xì)胞、輔助T細(xì)胞,自然殺傷(NK)細(xì)胞以及B細(xì)胞上調(diào),而肺中腫瘤特異性的效應(yīng)T細(xì)胞、輔助T細(xì)胞,自然殺傷(NK)細(xì)胞上調(diào)。更多的抗腫瘤免疫細(xì)胞可被認(rèn)為是肺部轉(zhuǎn)移緩解的一個因素。在運(yùn)用酶聯(lián)免疫斑點(diǎn)技術(shù)(ELISpot)檢測脾臟中腫瘤特異性IFN-?的生成細(xì)胞時(shí),研究人員發(fā)現(xiàn)未接受治療的荷瘤鼠脾臟顯著腫大,而接受聯(lián)合治療后脾臟恢復(fù)到正常水平。脾臟大小一般被認(rèn)為是免疫響應(yīng)強(qiáng)弱的象征,脾臟腫大被認(rèn)為免疫急性毒性的表現(xiàn)。通過查閱文獻(xiàn),研究人員發(fā)現(xiàn)鼠源乳腺癌模型中,轉(zhuǎn)移能力強(qiáng)的模型往往伴隨脾腫大現(xiàn)象。這是因?yàn)槠⑴K中具有更多可促進(jìn)MET過程的gMDSCs。因此研究人員研究了骨髓、脾臟與肺內(nèi)免疫細(xì)胞的表型后發(fā)現(xiàn),在聯(lián)合治療組中,骨髓與脾臟中g(shù)MDSCs顯著性下調(diào),說明系統(tǒng)性的免疫相應(yīng)緩解了免疫抑制的同時(shí)減少了促進(jìn)轉(zhuǎn)移灶形成的gMDSCs。肺部降低的gMDSCs則直接支持了這一猜測。
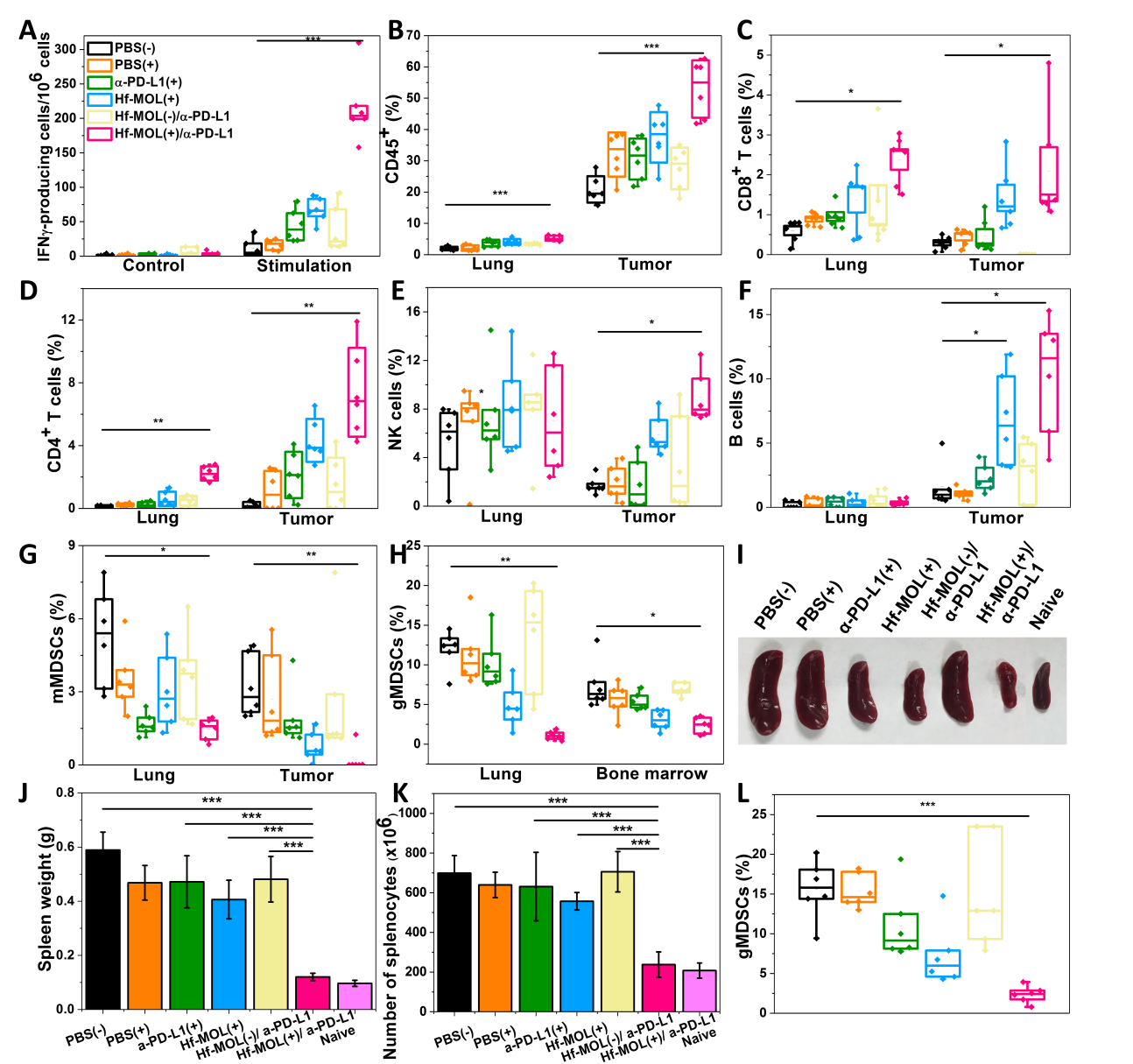
圖6. Hf-MOL介導(dǎo)RT-RDT的抗癌及抗轉(zhuǎn)移機(jī)理。(a) Hf-MOL/?-PD-L1(+)治療組中的腫瘤特異性IFN-?分泌細(xì)胞上調(diào)。(B-F)CD45陽性、CD4陽性T與CD8陽性T細(xì)胞在Hf-MOL/?-PD-L1(+)治療組的原位瘤與肺中上調(diào)。(G,H)Hf-MOL/?-PD-L1(+)治療組中原位瘤與肺中MDSCs下調(diào)。(I.J,K)脾臟光學(xué)照片、脾重與脾臟細(xì)胞數(shù)量。(L)接受Hf-MOL/?-PD-L1(+)治療組小鼠脾臟中g(shù)MDSCs下調(diào)。綜上所述,該工作報(bào)道了一種將系列鉿基構(gòu)成的nMOL用于增強(qiáng)放射-放射動力治療并與免疫檢測點(diǎn)阻斷療法聯(lián)合作用用于抗腫瘤轉(zhuǎn)移的新型療法。Kaiyuan Ni, Guangxu Lan, Christina Chan, Xiaopin Duan,Nining Guo, Samuel S. Veroneau, Ralph R. Weichselbaum, Wenbin Lin. Ultrathin metal-organic layer-mediated radiotherapy-radiodynamic therapy enhances immunotherapy of metastatic cancers, Matter.2019.DOI: 10.1016/j.matt.2019.06.007https://www.sciencedirect.com/science/article/pii/S2590238519300591

林文斌,美國芝加哥大學(xué)化學(xué)系和輻射與細(xì)胞腫瘤系的James Franck講座教授。林文斌教授在化學(xué)與生物化學(xué)及納米醫(yī)學(xué)方面有重要貢獻(xiàn),在包括Nat. Biomed. Eng.,Nat. Chem.,J. Am. Chem. Soc.,Angew. Chem. Int. Ed. 等世界頂級雜志上發(fā)表文章350余篇,文章被廣泛引用(h-index >100)。1999-2009 年度文章引用世界前十位化學(xué)家。湯森路透集團(tuán)2000-2010年全球頂尖一百化學(xué)家名人堂榜單第54名。林文斌團(tuán)隊(duì)研發(fā)的三個抗癌藥物已在進(jìn)行臨床試驗(yàn)并取得良好的初步結(jié)果。https://www.x-mol.com/university/faculty/1445http://linlab.uchicago.edu/