1. Angew:利用AIE探針對細胞質膜進行快速靈敏地成像
細胞質膜(PM)的異常是多種疾病的重要標志。因此,實現在復雜系統中對PM的可視化成像是目前生命科學領域中的一個重要研究方向。高麗大學Jong Seung Kim教授、四川大學李坤教授和余孝其教授合作,利用靜電和疏水相互作用以及AIE效應,開發了一種用于成像PM的可水溶特異性探針。
該探針具有出色的PM特異性和良好的生物相容性等眾多優點。研究通過對神經元的PM成像實驗證明了該探針在生物系統中具有很好的工作性能,這也是目前首次實現通過熒光法對腦內的紅細胞進行成像。
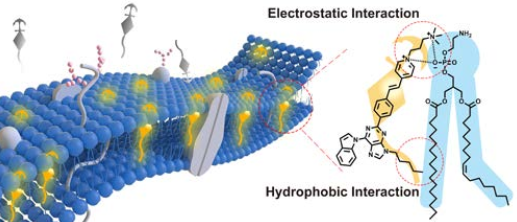
Lei Shi, Kun Li, Jong Seung Kim, Xiao-Qi Yu. et al. Rapid and ultrasensitive imaging of plasma membrane with AIE based probe in bio-systems. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201909498
https://onlinelibrary.wiley.com/doi/10.1002/anie.201909498
2. AFM綜述:用于可控遞送的光敏納米載體
光敏納米載體是一種可以實現按需遞送活性載荷的微創系統,并且通過調整光照的時間、強度、位置和波長可以對載荷的釋放進行精確的時空控制。與傳統的被動給藥系統相比,光敏納米載體可以對所包封的活性分子的釋放動力學的進行調控,這對于靶向給藥來說具有重要的臨床意義。
南洋理工大學段宏偉教授和江南大學梁麗教授合作,對基于光化學反應、光熱效應和活性氧介導的光敏響應這三種主要機制的光敏納米平臺的設計和制備進行了綜述;同時也對未來光敏納米材料發展的挑戰及其臨床醫學轉化進行了詳細的討論。
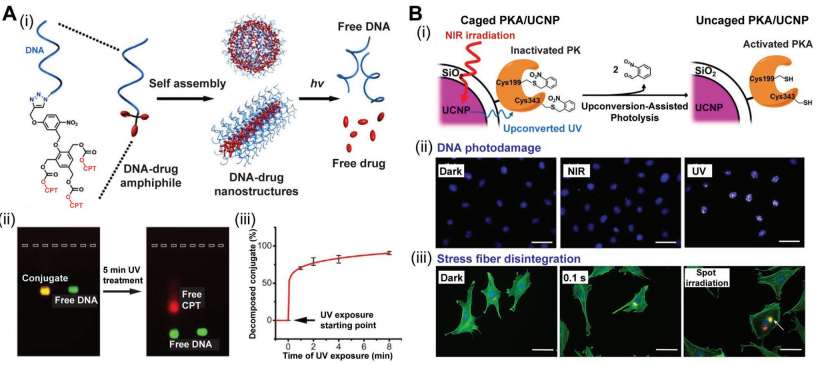
Qirong Xiong, Li Liang, Hongwei Duan. et al. Photoactive Nanocarriers for Controlled Delivery. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903896
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903896
3. Small:具有抗耐熱性的自然殺傷細胞用于增強光熱-免疫治療
雖然目前利用光熱療法(PTT)治療實體腫瘤已開始了臨床前的相關研究,但PTT尚不能完全治愈腫瘤,并且腫瘤細胞的耐熱性也會導致腫瘤復發,從而降低PTT的治療效率。福建醫科大學孟超肝膽醫院劉小龍教授和劉景豐教授合作設計了一種集光熱治療試劑(PTAs)、DNA酶和人工工程化的自然殺傷細胞(A-NK)為一體的納米平臺并將其用于肝癌的免疫治療。
實驗以四羥基蒽醌和Mn2+為配位體,合成了具有二維結構的新型PTAs(Mn-CONASHs),并進一步在其表面吸附聚醚酰亞胺和DNA酶,DNA酶@Mn-CONASHs具有良好的光熱轉換效率,并且腫瘤微環境可以增強其T1 MRI和抗熱的耐受性。實驗在該人工工程NK細胞修飾了可特異性靶向肝癌的TLS11a-適配體,證明了其可在PTT后清除殘留的腫瘤細胞,進而提高PTT的治療效果并可避免腫瘤的復發。
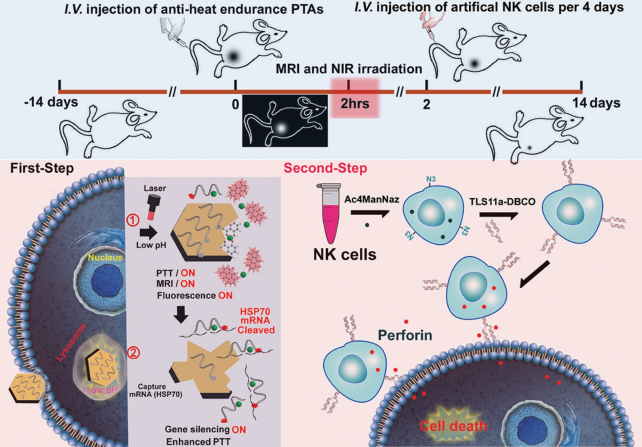
Da Zhang, Xiaolong Liu, Jingfeng Liu. et al. Artifcial Engineered Natural Killer Cells Combined with Antiheat Endurance as a Powerful Strategy for Enhancing Photothermal-Immunotherapy Efficiency of Solid Tumors. Small. 2019
DOI: 10.1002/smll.201902636
https://onlinelibrary.wiley.com/doi/10.1002/smll.201902636
4. Chem. Soc. Rev.:各向異性納米材料的理化性質及生物醫學應用
近年來,納米材料的形貌對其物理化學性質及和生物醫學應用的影響正越來越受到人們的關注。雖然已有很多研究對不同形貌的納米材料的合成方法或者它們的生物醫學應用進行了報道,但是往往都忽略了它們相互之間的作用和關系。
美國NIH陳小元教授和福州大學宋繼斌教授合作,從理論基礎、合成、性質、應用等方面對不同形貌的納米材料進行了全面的綜述;指出了形貌對不同類型納米材料的性能,理化性質和生物醫學應用的影響;最后也對這一領域研究所面臨的關鍵性問題和挑戰做了詳細的討論。
Lijiao Yang, Jibin Song, Xiaoyuan Chen. et al. Anisotropic nanomaterials for shape-dependent physicochemical and biomedical applications. Chemical Society Reviews. 2019
DOI: 10.1039/C9CS00011A
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00011a#!divAbstract
5. AFM綜述:將功能化納米材料整合到不同結構的材料中用于生物醫學
將功能化納米材料(NMs)整合到二維材料表面或三維水凝膠網絡中,是改善生物材料理化性質和功能性的一種新興方法。利用這種方法構建功能化材料,如自組裝的單分子膜(SAMs)和納米復合水凝膠等在許多生物醫學領域例如組織工程,藥物遞送和生物傳感等方面都有著重要的應用價值。
加州大學洛杉磯分校Ali Khademhosseini教授和德國明斯特大學Nermin Seda Kehr教授合作,對將功能化納米材料整合到不同結構的材料中并用于生物醫學的研究進行了系統的綜述。基于碳、金屬和硅的納米材料因具有獨特的性能,如磁性、電性能、刺激響應性、疏水性或親水性等,可以被集成到二維或三維的生物材料中。這種整合的過程可以改變納米生物材料的原始性質,并且有望實現增強的協同效應。
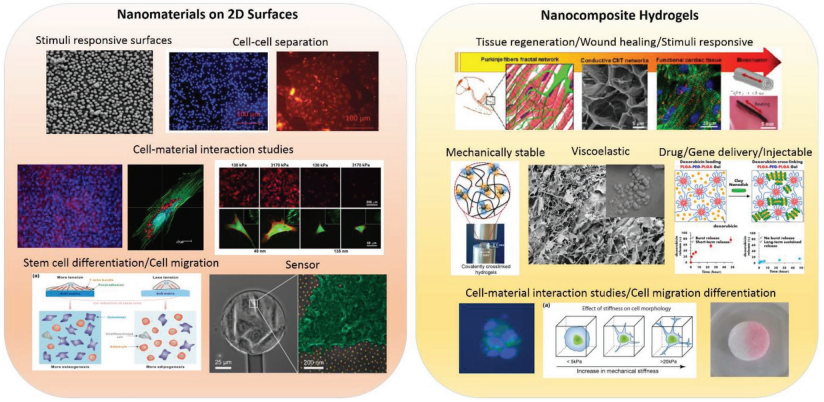
Rumeysa Tutar, Ali Khademhosseini, Nermin Seda Kehr. et al. Functional Nanomaterials on 2D Surfaces and in 3D Nanocomposite Hydrogels for Biomedical Applications. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201904344
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201904344
6. Small:仿生的類肽納米管用于腫瘤細胞成像和化學-光動力學治療
納米管具有非常大的內表面積和很高的長徑比,在生物成像和藥物遞送等生物醫學領域都有著重要的應用價值。然而,有機納米管在生物醫學上的應用還仍然很少。
華盛頓州立大學林躍河教授和太平洋西北國家實驗室陳春龍研究員合作,以被序列修飾的類肽和被配體標記的類肽為基礎,合成了兩種新型的類肽納米管(PepTs1和PepTs2)。這些納米管具有與無標記納米管相似的結構。實驗結果表明,這種類肽納米管可以很好地負載阿霉素類藥物,并且具有良好地靶向腫瘤細胞進行成像和實現化學-光動力學治療的性能。
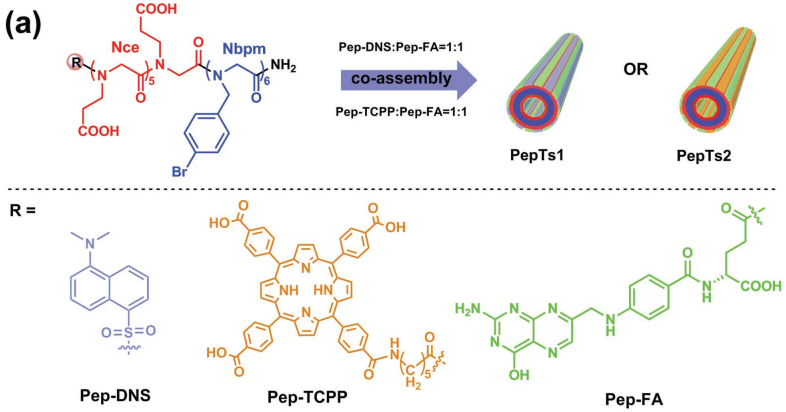
Yanan Luo, Chun-Long Chen, Yuehe Lin. et al. Bioinspired Peptoid Nanotubes for Targeted Tumor Cell Imaging and Chemo-Photodynamic Therapy. Small. 2019
DOI: 10.1002/smll.201902485
https://onlinelibrary.wiley.com/doi/10.1002/smll.201902485
7. Angew:超分子自由基二聚體用于近紅外II區光熱治療
利用近紅外(NIR)區(1000-1350 nm)激光進行的光熱治療因具有穿透深度高等優點而受到越來越多的關注。清華大學徐江飛博士和張希教授合作構建了一種新型的超分子自由基二聚體2MPT?+-CB[8],其在NIR II區有著很強的吸收性能。
實驗結果表明,2MPT?+-CB[8]具有高效的光熱轉化能力和很好的穩定性,其在穿過了雞胸組織的1064 nm激光照射下仍能有效抑制HegG2癌細胞的增殖。這一工作通過提供一種新的方法來構建NIR II光熱試劑,從而為實現高效的NIR II光熱治療提供了新的思路,并且2MPT?+-CB[8]在發光材料、光電子材料和生物傳感等領域也具有廣闊的應用前景。

Bohan Tang, Xi Zhang. et al. Supramolecular Radical Dimer: High-Efficiency NIR-II Photothermal Conversion and Therapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201910257
https://onlinelibrary.wiley.com/doi/10.1002/anie.201910257
8. AFM:負載異煙肼的WSSe/MnO2納米復合材料用于腫瘤的協同治療
北京科技大學董海峰教授團隊利用Mn2+可催化異煙肼(INH)產生羥基自由基(?OH)和WSSe納米片的光熱效應,制備了一種WSSe/MnO2-INH納米復合材料,并將其用于協同抗癌治療。實驗結果表明,WSSe/MnO2納米復合材料具有良好的光熱轉換效率,并且可以通過非芬頓反應的機理誘導產生?OH。
實驗利用可靶向線粒體的三苯基溴化膦(TPP)分子對其進行修飾,并使用癌細胞膜對其進行偽裝得到具有靶向癌細胞線粒體的WSSe/MnO2- INH-TPP@CM。并且該納米復合材料也具有對腫瘤進行CT成像和磁共振成像的能力。研究表明,WSSe/MnO2- INH-TPP@CM在體內外均表現出良好的抗癌治療效果,因此這一工作也為基于ROS的癌癥聯合治療提供了新的策略。
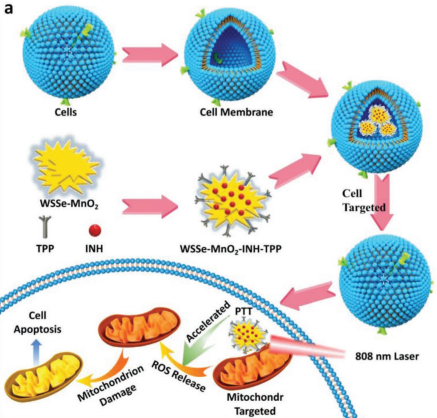
Yaru Cheng, Haifeng Dong. et al. Non-Fenton-Type Hydroxyl Radical Generation and Photothermal Effect by Mitochondria-Targeted WSSe/MnO2 Nanocomposite Loaded with Isoniazid for Synergistic Anticancer Treatment. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903850
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903850
9. Small:具有增強的腫瘤穿透性和鄰域效應的靶點響應型納米載體
透明質酸(HA)在腫瘤細胞外基質(ECM)中會過表達,這也使得納米藥物難以深入到達腫瘤組織。雖然利用透明質酸酶(HAase)對納米粒子(NPs)進行修飾有望克服這一問題,但要實現藥物在腫瘤部位的均勻分布仍然十分困難。中科院長春應化所Hongshuang Qin博士和曲曉剛研究員合作報道了一種能在酸性腫瘤微環境(pH為6.5)下釋放HAase的智能納米載體,它可以通過尺寸的減小實現鄰域效應,進而大大增強藥物在體內腫瘤的深度穿透。
實驗利用聚合物PEG-PAH-DMMA (ZDHD)將HAase包裹在 ZnO-DOX NP的表面。該聚合物在pH為6.5時釋放HAase并降解腫瘤ECM中的HA,而ZnO-DOX NPs可在pH為4.5的溶酶體中釋放DOX 并誘導細胞凋亡,同時通過縮小尺寸產生的鄰域效應感染鄰近的細胞。實驗結果表明,這種分級靶向釋放HAase和藥物的策略可以有效增強其在腫瘤中的穿透性并大大減少副作用。

Tingting Cui, Hongshuang Qin, Xiaogang Qu. et al. A Sequential Target-Responsive Nanocarrier with Enhanced Tumor Penetration and Neighboring Effect In Vivo. Small. 2019
DOI: 10.1002/smll.201903323
https://onlinelibrary.wiley.com/doi/10.1002/smll.201903323
10. Nature. Biotech.綜述:在腦中使用的精準電子醫學
哈佛醫學院Shaun R. Patel?教授和哈佛大學Charles M. Lieber?教授合作,對用于神經系統的電子學研究進行了詳細綜述。這一系列的研究不僅在基礎神經科學領域有著重要的研究價值,而且還有望能夠實現在細胞水平上進行靶向治療的目的。并且這些個性化的電子學治療方法也能為神經退行性疾病和神經精神疾病提供新的治療模式,甚至有望增強人類的認知能力,并為慢性神經疾病提供長期的有效治療。
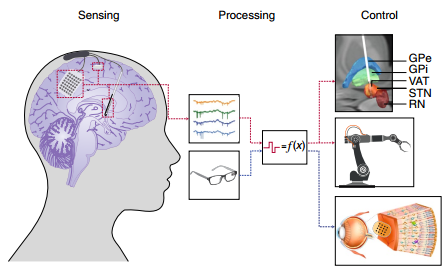
Shaun R. Patel?, Charles M. Lieber. Precision electronic medicine in the brain. Nature Biotechnology. 2019
https://www.nature.com/articles/s41587-019-0234-8
11. Angew:AIE分子-多肽偶聯物用于對胞內細菌感染的光學診療
對細胞內細菌進行檢測和清除仍然目前是一個很大的難題。其中的一個主要原因就是無法在早期對這些細菌感染實現高精確度的成像并加以有效的治療。新加坡國立大學劉斌教授團隊制備了一種AIE分子-多肽偶聯物探針,它能夠檢測細菌感染并通過動力學過程殺死在巨噬細胞中的細菌,其在被感染的巨噬細胞中會被半胱天冬酶-1激活產生熒光信號。
同時,該AIE探針也可作為一種產生活性氧(ROS)的光敏劑,其在感染區域內產生的ROS信號約為在細胞質內的2.7倍,因此說明它可以在高效殺滅細菌的同時也對巨噬細胞保持很低的細胞毒性。因此,這一研究開發的生物熒光探針也為實現有選擇性、敏感地檢測和根除細胞內細菌感染提供了一種新的方法。
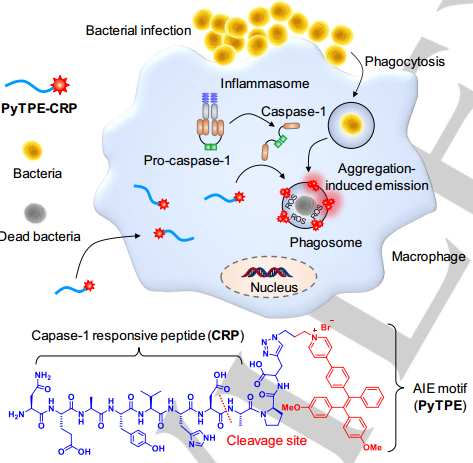
Guobin Qi, Fang Hu, Bin Liu. et al. AIEgen-Peptide Conjugate: Phototheranostics for Phagosome-Entrapped Bacteria. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201906099
https://onlinelibrary.wiley.com/doi/10.1002/anie.201906099
12. Small:具有特異性細胞毒性的納米復合物可增強T細胞浸潤并改善癌癥治療
開發可以選擇性地對癌細胞進行藥物遞送的策略對于治療轉移性乳腺癌來說至關重要。中科院上海藥物研究所尹琦博士和李亞平研究員合作,將化療藥物多西他賽(DTX)與硫酸肝素(HS)相結合,并把具有抗腫瘤轉移和增強腫瘤T細胞浸潤的阿司匹林(ASP)包裹在HS-DTX膠束中,隨后利用靜電作用將陽離子聚乙烯亞胺(PEI)-聚乙二醇(PEG)共聚物與其結合,構建了負載有ASP的HS- DTX膠束(AHD)/PEI-PEG納米復合物(PAHD)。
研究發現,PAHD在血液中具有較長的循環半衰期,并且在弱酸性的腫瘤微環境下,PEI-PEG會與AHD發生分離,而游離的PEI-PEG會通過提高細胞膜的通透性來增強細胞對AHD的攝取。隨后細胞過表達的肝素酶會使得HS降解并釋放ASP和DTX。實驗結果表明,PAHD對腫瘤細胞具有特異性毒性,并且對4T1荷瘤小鼠具有較強的抑制腫瘤生長和肺轉移的能力,并且腫瘤組織中CD8+ T細胞數量也有明顯增加。
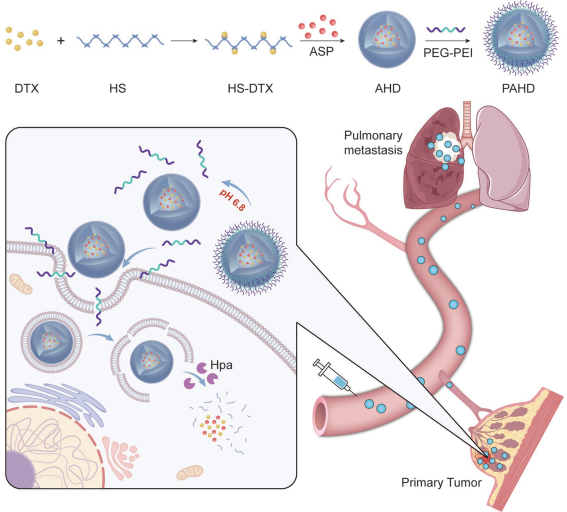
Yiran Liu, Qi Yin, Yaping Li. et al. In Vivo Environment-Adaptive Nanocomplex with Tumor Cell–Specifc Cytotoxicity Enhances T Cells Infltration and Improves Cancer Therapy. Small. 2019
DOI: 10.1002/smll.201902822
https://onlinelibrary.wiley.com/doi/10.1002/smll.201902822
13. Angew:可成像細胞內HSNO的雙響應性熒光探針
HSNO是一種最簡單的S-亞硝基硫醇分子,它也是連接H2S和NO兩種細胞氧化還原調控信號分子的關鍵中間體。然而,目前人們對HSNO的化學生物學作用仍然知之甚少,主要的原因在于缺乏可在生物系統中選擇性檢測HSNO的有效策略。
華盛頓州立大學Ming Xian教授團隊制備了首個用于檢測HSNO的熒光探針TAP-1。實驗結果表明,TAP-1在水介質和細胞中對HSNO都具有很高的檢測選擇性和敏感性。因此這一研究也為了解HSNO的生物學作用提供了一個新的高效工具。
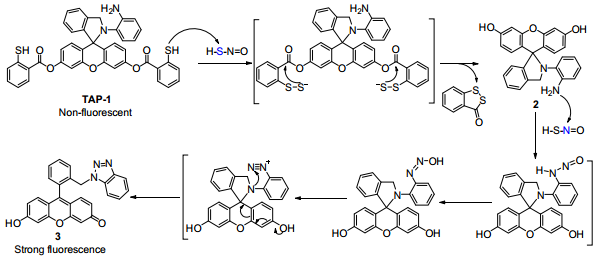
Wei Chen, Ming Xian. et al. Rational Design of a Dual-Reactivity Based Fluorescent Probe for Visualizing Intracellular HSNO. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201908950
https://onlinelibrary.wiley.com/doi/10.1002/anie.201908950
14. AFM:富含CXCR4的納米藥物用于預防乳腺癌轉移和光動力治療
乳腺癌的轉移與CXCR4-CXCL12密切相關,CXCR4陽性的癌細胞會被“募集”到富含CXCL12的組織當中。目前雖然已經有很多種抑制CXCR4的藥物被開發出來,但很少有研究去通過對CXCL12進行靶向干擾以控制乳腺癌的轉移。中國藥科大學顧月清教授團隊采用富含CXCR4的4T1 細胞膜(CMs)去負載銅銦硫化物的量子點(QDs)納米顆粒構建了一種納米藥物,并利用其對CXCL12進行靶向干擾以阻斷乳腺癌的肺轉移。
該納米藥物繼承了源細胞的CXCR4表達效果,因此它可以更加有效地和CXCR12蛋白結合,進而抑制CXCL12介導的癌細胞體外侵襲。體內熒光成像表明,該納米藥物會在CXCL12表達豐富的肺內優先富集。實驗通過在乳腺癌模型小鼠中預先注射該納米藥物,對其抑制腫瘤肺轉移的有效性進行了充分驗證。而對于已經形成的肺轉移腫瘤,該納米藥物可以通過調節α-平滑肌肌動蛋白來緩解乏氧,從而增強對轉移瘤的光動力治療效果。
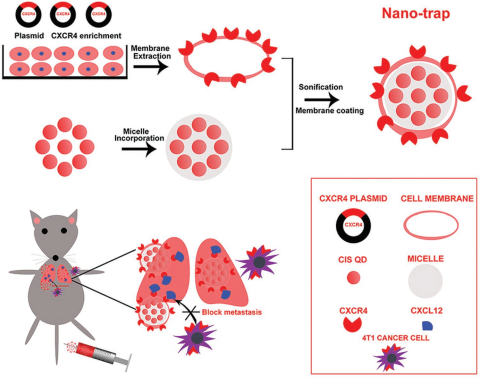
Zhaohui Wang, Yueqing Gu. et al. CXCR4-Enriched Nano-Trap Targeting CXCL12 in Lung for Early Prevention and Enhanced Photodynamic Therapy of Breast Cancer Metastasis. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201905480
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201905480
15. Nano Lett.:一氧化氮刺激納米系統釋放藥物用于治療耐多藥腫瘤
一氧化氮(NO)分子可通過降低P-糖蛋白(P-gp)的表達來逆轉癌細胞的耐多藥(MDR)效應,從而有效提高阿霉素(Dox)對耐藥癌細胞的治療效果。中科院長春應化所張海元研究員團隊設計了一個可被NO刺激的納米系統作為Dox的釋放載體。實驗在磷脂雙層結構中嵌入了一種可對NO響應并發生水解的含o-苯二胺脂質體,并進一步利用其對負載有L-精氨酸(L-Arg)和Dox的Au@CuS納米粒子進行包裹以形成ADLAu@CuS YSNPs。
在808 nm激光的照射下,ADLAu@CuS YSNPs可以發生共振能量轉移(RET)并生成活性氧(ROS),從而可以有效地將L-Arg轉化為NO,使磷脂雙層結構發生失穩并且釋放NO。而由于分子支架的限制,此時Dox尚不能從YSNPs中釋放出來。但是隨著NO釋放過多,對NO響應的脂質體會被嚴重破壞使得Dox得以被釋放。實驗表明,這種可順序釋放NO和Dox的ADLAu@CuS YSNPsNO可顯著抑制P-gp的表達,增強耐藥MCF-7/ADR細胞中Dox的積累效率,具有良好的體內外治療效果。
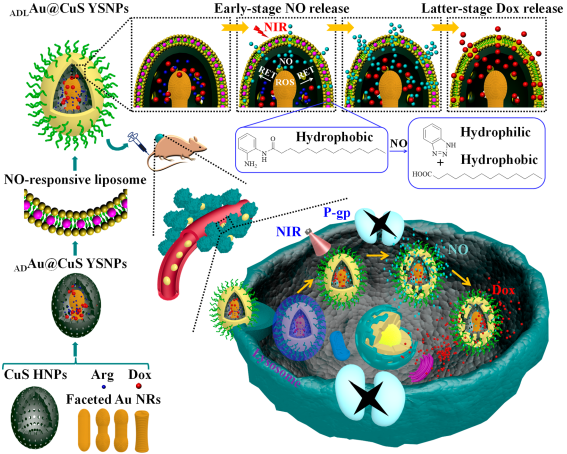
Li Wang, Haiyuan Zhang. et al. Nitric Oxide Stimulated Programmable Drug Release of Nanosystem for Multidrug Resistance Cancer Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b01869
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01869
16. Chem Rev.:用于預防和治療心力衰竭的納米技術
成年心肌在損傷后往往再生能力有限,而目前的臨床治療對與梗死心臟來說也效果一般,并會導致受損心臟發生擴大和重構以維持其生理功能。但是這些重構過程也會最終導致缺血性心肌病和心力衰竭(HF)。最近研究表明,一些新興的治療方法如再生療法和納米藥物治療等可以在動物模型上有效預防心衰后的心肌梗死。然而,這些臨床前的技術還無法直接用于對缺血性損傷患者進行治療,這是由于納米生物醫學和臨床應用之間還存在著一個巨大的鴻溝。
密歇根州立大學Morteza Mahmoudi團隊對開發高效的心臟再生療法所涉及的多個領域,包括心臟病學、細胞和分子生物學、生物化學、化學、機械和材料科學等方面的研究進行了綜述和總結,通過將多學科知識進行交叉也有助于為開發新的、更安全、更有效的方法來能夠降低HF患者的發病率和死亡率。
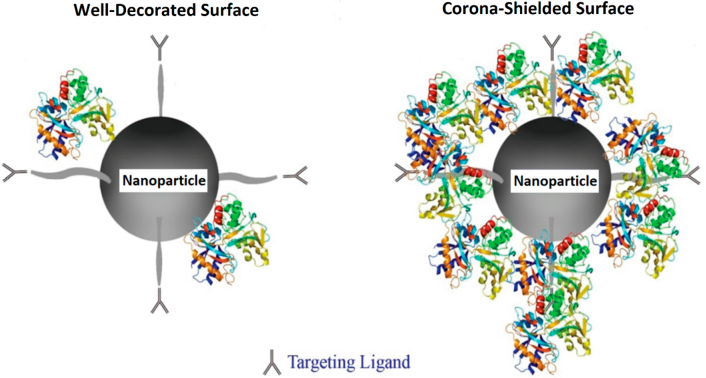
Mohammad Javad Hajipour, Morteza Mahmoudi. et al. Nanoscale Technologies for Prevention and Treatment of Heart Failure: Challenges and Opportunities. Chemical Reviews. 2019
DOI: 10.1021/acs.chemrev.8b00323
https://pubs.acs.org/doi/10.1021/acs.chemrev.8b00323
17. AM:基于益生菌孢子的可口服納米粒子發生器用于癌癥治療
孢子是益生菌的一種休眠形式,它的疏水性蛋白殼層會在腸道微環境中發生解體進而使其萌發為具有代謝活性的營養細胞。有鑒于此,鄭州大學王蕾教授、張振中教授和張云教授合作研制了一種可口服的納米粒子(NPs)發生器。
實驗利用脫氧膽酸(DA)對孢子進行修飾并利用其去負載化療藥物(DOX/SOR)從而構建了這種發生器。該發生器可以對負載的藥物進行保護,使其安全達到腸道環境。隨后,發生器的疏水蛋白殼層會發生分解,從而自主生成DOX/SOR/Spore-DA NPs并有效地穿透上皮細胞,從而增加其在基底外側的藥物釋放效率。體內外研究表明,該納米發生器可以在腸道內自主生成大量的NPs,從而也為癌癥治療提供了一種新的策略。
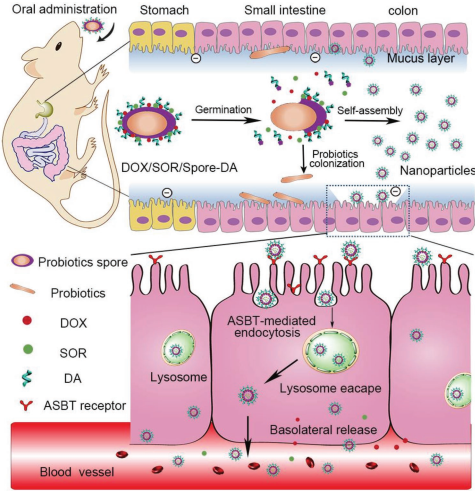
Qingling Song, Lei Wang, Zhenzhong Zhang, Yun Zhang. et al. A Probiotic Spore-Based Oral Autonomous Nanoparticles Generator for Cancer Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201903793
https://onlinelibrary.wiley.com/doi/10.1002/adma.201903793
18. AFM:用于藥物傳遞的介孔二氧化硅納米顆粒
近年來,作為納米前沿技術的納米醫學已經在生物醫學領域產生了巨大的影響。許多研究都致力于開發新的納米平臺來用于成像診斷和藥物遞送治療。而在目前已有可用的納米粒子中,無機介孔二氧化硅納米粒子因具有獨特的性能而成為了其中重要的一員。馬德里康普頓斯大學María Vallet-Regí團隊綜述了近年來關于介孔二氧化硅納米粒子的合成及其作為藥物載體的研究進展,詳細討論了這類納米粒子的最新發展趨勢及其在醫學中的應用前景。
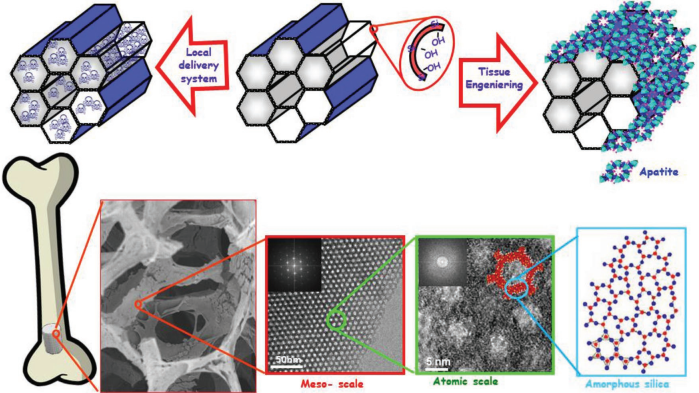
Miguel Manzano, María Vallet-Regí. et al. Mesoporous Silica Nanoparticles for Drug Delivery. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201902634
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201902634
19. Nature Commun.:負載mRNA的納米載體對巨噬細胞進行基因編程對抗腫瘤
腫瘤相關巨噬細胞(TAMs)通常表現為M2表型,這使得它們會產生免疫抑制并促進腫瘤生長。而若將這些TAMs重編程為M1表型則可以阻止它們的促癌活性并實現抗腫瘤免疫,但要實現這一目標往往也會引發是非特異性的系統性炎癥。美國弗雷德?哈欽森癌癥研究中心M.T. Stephan團隊制備了一種納米載體,它可以在不引起全身毒性的情況下,通過靶向遞送體外轉錄的mRNA來對TAMs進行重編程。
實驗在卵巢癌、黑色素瘤和膠質母細胞瘤模型上證明了通過注射負載干擾素調節因子5的mRNA的納米粒子可以活化激酶IKKβ來逆轉TAMs的免疫抑制和促腫瘤功能,并可對TAMs進行重編程使其具有抗腫瘤免疫的活性。研究進一步表明,這種納米試劑可以被安全地重復給藥,因此它有望在臨床應用中實現不破壞免疫穩態的全身治療。

F. Zhang, M.T. Stephan. et al. Genetic programming of macrophages to perform anti-tumor functions using targeted mRNA nanocarriers. Nature Communications. 2019
https://www.nature.com/articles/s41467-019-11911-5
20. JACS:在雜化的中空介孔有機硅納米顆粒上進行原位聚合用于精準診療
光學診療是指利用光化學手段對癌癥進行診斷和治療,包括成像指導的光熱/化療、光熱/光動力治療和光動力/化療等,它也是精準醫學領域的一個重要典范。中南大學容鵬飛教授、王維教授和美國NIH陳小元教授合作報道了一種特殊的原位骨架生長的方法,即在中空介孔有機硅(HMO)骨架內巧妙地將二亞胺(PDI)進行原位雜化,進而合成了一種新型的光學診療試劑。PDI與HMO的結合可以使二氧化硅納米顆粒(HMPDINs)具有較好的熒光和光聲信號,可用于進行增強的熒光和光聲成像。
同時,有機硅殼層可與也能64Cu同位素進行化學螯合從而實現PET成像。此外,實驗進一步在HMPDINs的中空結構中原位生長熱敏聚合物 (TP)以提高其負載能力,并可防止疏水藥物SN38的發生滲漏。而在近紅外激光照射下,該雜交PDI會產生熱量并觸發TP發生變形,從而在腫瘤區域內釋放藥物。這一研究開發的有機-無機混合納米藥物不僅具有更好的腫瘤診療效果,而且也為設計功能強大的診療平臺提供了新的方案。
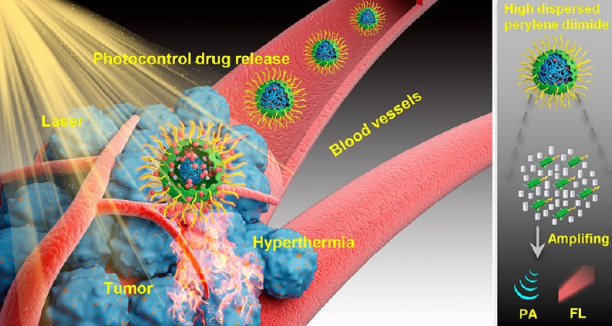
Zhen Yang, Wenpei Fan, Pengfei Rong, Wei Wang, Xiaoyuan Chen. et al. Precision Cancer Theranostic Platform by In Situ Polymerization in Perylene Diimide-Hybridized Hollow Mesoporous Organosilica Nanoparticles. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.9b06086
https://pubs.acs.org/doi/10.1021/jacs.9b06086
21. AM:納米免疫轉換器支架材料用于增強免疫檢查點阻斷治療
基于免疫檢查點阻斷(ICB)的癌癥免疫治療仍存在著效率較低和全身毒性大的問題。而為了解決這些問題,就需要開發一種新的治療平臺來將非免疫原性腫瘤轉化為免疫原性表型。成均館大學Yong Taik Lim團隊設計了一種支架材料,并利用其負載包裹有瑞喹莫德(iNCVs (R848))的納米免疫轉換器和阿霉素(dox)。
實驗結果表明,該支架可以持續釋放包封的iNCVs (R848)和阿霉素,因此它不僅可以減少腫瘤中的免疫抑制細胞,而且可以增強全身的抗腫瘤免疫反應并最大限度地降低全身毒性。綜上所述,這種可以重塑腫瘤微環境(TME)的支架材料可有效預防術后腫瘤的復發和轉移。
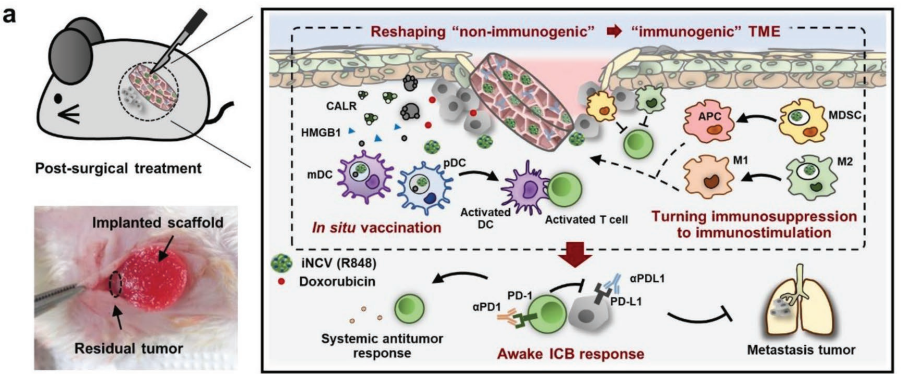
Hathaichanok Phuengkham, Yong Taik Lim. et al. A Designer Scaffold with Immune Nanoconverters for Reverting Immunosuppression and Enhancing Immune Checkpoint Blockade Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201903242











