
第一作者:Colleen N. Loynachan
通訊作者:SangeetaN. Bhatia,Molly M. Stevens
通訊單位:麻省理工學院,倫敦帝國理工學院
癌癥的早期診斷技術使得通過手術和放射治療等局部治療措施有效治療原發性腫瘤成為可能。早期檢測在很大程度上依賴于血液生物標志物,然而,大多數生物標志物從腫瘤中脫落的速度極低,且經過血液循環后被大幅度稀釋,以及存在生物標志物缺乏特異性等問題,阻礙了早期檢測準確性和靈敏性。
那么,怎么辦呢?考慮到大多數人類非傳染性疾病,包括癌癥、炎癥以及血栓形成等,會對蛋白酶的活性產生影響,因此將蛋白酶活性作為疾病的生物標志物,可有助于避免基于血液生物標志物診斷的缺陷。

然而,問題又來了!常用的檢測蛋白酶活性的工具往往依賴于繁瑣的基礎設施分析,如熒光、質譜或磁共振成像。在實踐中,這些技術通常需要昂貴的分析試劑,且在不同環境中通用性較差。要實現精準醫療在全球范圍內普及,就需要使用簡單而靈敏的診斷工具來監測蛋白酶的活性。
超小金納米團簇(AuNCs)具有很好的腫瘤富集和可被腎臟清除等特性,已經成為一種用于體內成像的靈敏探針。然而,目前還沒有研究利用AuNCs的催化活性來實現體內傳感。
有鑒于此,麻省理工學院Sangeeta N. Bhatia教授和倫敦帝國理工學院Molly M.Stevens教授合作,基于金納米團簇的催化活性,跨界實現了疾病體內快速診斷。
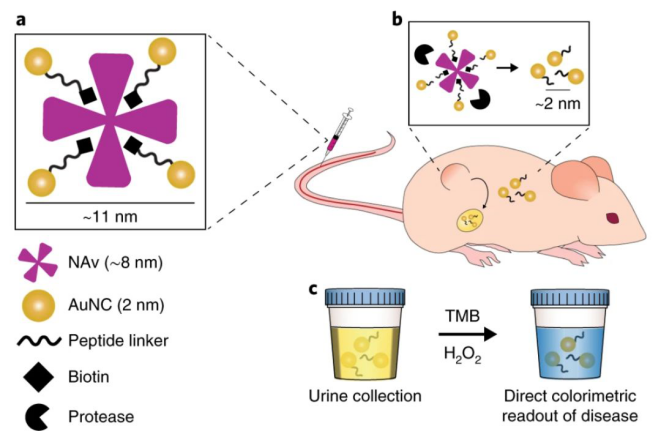
圖1. 基于Au納米團簇的納米傳感器示意圖
要點1:納米傳感器原理
Au納米團簇具有類過氧化物酶活性,并可被腎臟代謝等多重優勢,基于此,研究人員構建了一種多功能蛋白酶納米傳感器。研究人員利用多肽對Au納米團簇進行功能化,然后將Au納米團簇“綁定”到大的蛋白酶載體上。
在疾病區域,蛋白酶活性失調,納米傳感器組裝體解體,然后具有類過氧化物酶活性的2 nm Au納米團簇從尿液中排出。通過肉眼觀察尿液中納米團簇對TMB等顯色過氧化酶的催化活性所造成的顏色變化,可以肉眼判定疾病的有無以及疾病情況。
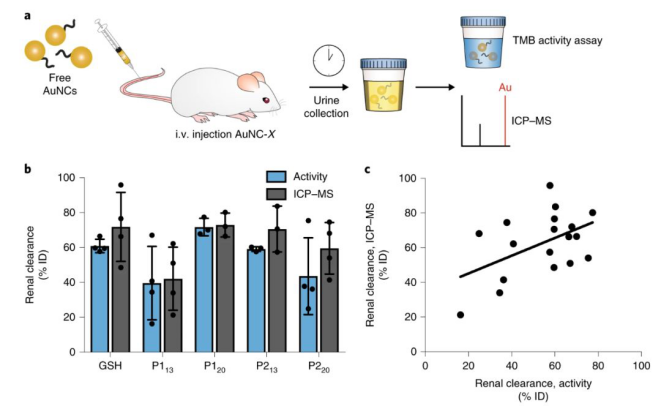
圖2. Au納米團簇經腎臟排出并保留催化活性
要點2:快速精準的診斷效果
這種納米傳感器可以對疾病微環境做出響應,從而在不到一小時的時間內產生比色信號讀數并對疾病狀態進行監測分析。實驗通過收集比較結直腸癌小鼠和正常小鼠尿液中AuNCs的催化活性,發現腫瘤小鼠比健康小鼠的比色信號增加了13倍。
這種傳感器對心血管病和腫瘤兩種不同的蛋白酶具有特異性,并且該納米傳感器在被注射后4周內會通過肝、腎而完全代謝,不會產生體內毒性。
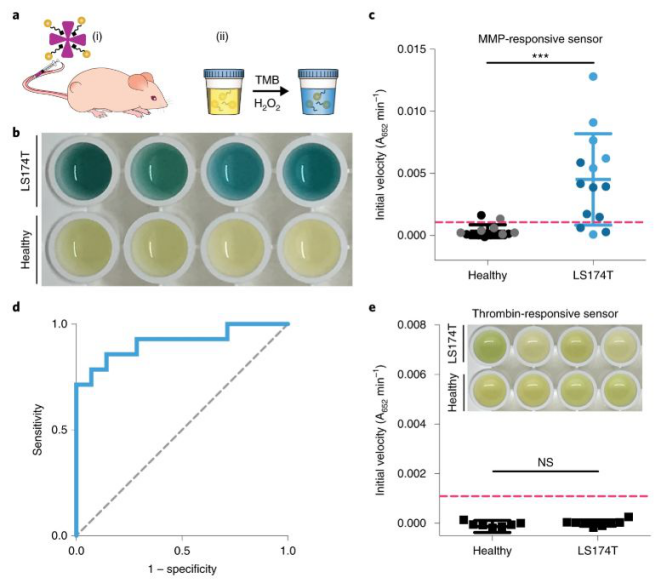
圖3. 基于Au納米團簇的納米傳感器的比色快速診斷
小結
總之,這項工作開辟了體內疾病診斷的新方法,并未納米催化醫學的發展提供了全新的思路。納米催化跨界到納米生物醫學,勢頭已經不可抑制,不要再猶豫了~~
參考文獻:
Colleen N. Loynachan,Sangeeta N. Bhatia, Molly M. Stevens. et al. Renal clearable catalytic goldnanoclusters for in vivo disease monitoring. Nature Nanotechnology.2019, 14, 883–890.
https://www.nature.com/articles/s41565-019-0527-6











