1. Nat. Rev. Cancer:利用納米技術(shù)改善癌癥免疫治療
利用患者的免疫系統(tǒng)來(lái)對(duì)抗腫瘤的癌癥免疫治療在2018年獲得了諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng),其效用也已在臨床得到了充分的驗(yàn)證。但是,目前對(duì)免疫治療有著良好響應(yīng)的患者比例卻仍然很低(約為15%)。這是因?yàn)槟[瘤有著多種的免疫逃避的機(jī)制。而通過(guò)對(duì)免疫系統(tǒng)進(jìn)行時(shí)空調(diào)控則有望實(shí)現(xiàn)最佳的治療效果。
納米顆粒和其他一些生物材料可以對(duì)免疫調(diào)節(jié)試劑的靶向位置、藥代動(dòng)力學(xué)和協(xié)同遞送進(jìn)行調(diào)整,因此將癌癥免疫治療和納米生物工程等技術(shù)進(jìn)行融合是一種非常好的策略。丹娜-法伯癌癥研究所Michael S. Goldberg教授對(duì)用于改善癌癥免疫治療的相關(guān)納米技術(shù)研究進(jìn)行了綜述,并對(duì)這一領(lǐng)域的發(fā)展方向做了詳細(xì)介紹。
Michael S. Goldberg. Improving cancer immunotherapy through nanotechnology. Nature Reviews Cancer. 2019
https://www.nature.com/articles/s41568-019-0186-9
2. AM綜述:用于個(gè)性化細(xì)胞治療的生物材料
細(xì)胞療法為治療頑固性疾病提供了一種新的方法,例如用于組織再生的間充質(zhì)干細(xì)胞、用于糖尿病治療的胰島移植和用于癌癥免疫治療的T細(xì)胞遞送等。而生物材料可以作為載體來(lái)維持細(xì)胞的存活和功能,并增強(qiáng)細(xì)胞治療的效果。隨著個(gè)性化醫(yī)療迅速發(fā)展,細(xì)胞療法也被證明其在這一領(lǐng)域具有巨大的應(yīng)用潛力。
它可以通過(guò)使用患者特異性細(xì)胞或生物材料來(lái)指導(dǎo)細(xì)胞活動(dòng),以滿足每個(gè)患者的需要,從而實(shí)現(xiàn)個(gè)性化醫(yī)療。麻省理工學(xué)院Daniel G. Anderson教授團(tuán)隊(duì)綜述了生物材料在組織再生、治療蛋白遞送和癌癥免疫治療中的作用,并重點(diǎn)介紹了用于個(gè)性化細(xì)胞治療的生物工程材料的性能及相關(guān)研究進(jìn)展。
Amanda L. Facklam, Daniel G. Anderson. et al. Biomaterials for Personalized Cell Therapy. Advanced Materials. 2019
DOI: 10.1002/adma.201902005
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902005
3. AFM綜述:用于靶向轉(zhuǎn)移瘤的細(xì)胞基納米系統(tǒng)
癌癥發(fā)生轉(zhuǎn)移是癌癥造成死亡的重要原因之一。目前,已有多種細(xì)胞基納米系統(tǒng)(CBNs)被開發(fā)出來(lái)用于靶向轉(zhuǎn)移瘤并進(jìn)行藥物遞送,這些CBNs可以將源細(xì)胞和納米顆粒的優(yōu)點(diǎn)相結(jié)合。
中科院上海藥物研究所張志文研究員和李亞平研究員合作,綜述介紹了對(duì)用于治療腫瘤轉(zhuǎn)移的CBNs的相關(guān)研究;對(duì)針對(duì)于腫瘤轉(zhuǎn)移的不同階段,如原發(fā)性腫瘤、循環(huán)腫瘤細(xì)胞(CTCs)、遠(yuǎn)處轉(zhuǎn)移以及腫瘤免疫微環(huán)境(TIM) 的CBNs進(jìn)行了討論;并就如何設(shè)計(jì)CBNs以提高腫瘤轉(zhuǎn)移治療過(guò)程中的藥物遞送效率提出了一些可行的觀點(diǎn)。
Xiang Gong, Zhiwen Zhang, Yaping Li. et al. Emerging Approaches of Cell-Based Nanosystems to Target Cancer Metastasis. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903441
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903441
4. AM綜述:設(shè)計(jì)用于胞內(nèi)遞送蛋白的納米載體
與小分子藥物相比,利用蛋白質(zhì)或抗體進(jìn)行的療法可以在極低的濃度下也保持高特異性和高活性,但它也存在著結(jié)構(gòu)脆弱、分子尺寸大和膜穿透性差等缺點(diǎn)。而為了這些問題,各種用于負(fù)載蛋白質(zhì)的納米載體,如脂質(zhì)納米膠囊,聚合物納米顆粒,無(wú)機(jī)納米顆粒和多肽等都被開發(fā)出來(lái)。
新加坡國(guó)立大學(xué)Shao Q. Yao教授、南京工業(yè)大學(xué)李林教授和黃維院士合作綜述了不同的胞內(nèi)遞送蛋白質(zhì)的策略;對(duì)設(shè)計(jì)路線、作用機(jī)制和治療方法進(jìn)行了詳細(xì)討論;最后對(duì)這一領(lǐng)域的發(fā)展前景進(jìn)行了展望。
Xiaofei Qin, Shao Q. Yao, Wei Huang. et al. Rational Design of Nanocarriers for Intracellular Protein Delivery. Advanced Materials. 2019
DOI: 10.1002/adma.201902791
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902791
5. AM:人造的自然殺傷細(xì)胞用于特異性腫瘤抑制和巨噬細(xì)胞再教育
自然殺傷(NK)細(xì)胞不僅能識(shí)別和消除異常細(xì)胞,還能對(duì)免疫細(xì)胞進(jìn)行募集和再教育以保護(hù)宿主。然而,NK細(xì)胞的功能在免疫抑制的腫瘤微環(huán)境(TME)中往往會(huì)受到限制。武漢大學(xué)張先正教授團(tuán)隊(duì)設(shè)計(jì)了一種人造的NK細(xì)胞(aNK),TME對(duì)aNK的限制作用很低,且它可以對(duì)巨噬細(xì)胞進(jìn)行再教育以抑制腫瘤。實(shí)驗(yàn)利用血紅細(xì)胞膜(RBCM)去包裹全氟正己烷(PFC)和葡萄糖氧化酶(GOX)構(gòu)建了aNK。
Ank可通過(guò)消耗葡萄糖和生成過(guò)氧化氫(H2O2)來(lái)直接殺死腫瘤細(xì)胞。并且生成的H2O2也可作為細(xì)胞因子和趨化因子來(lái)募集免疫細(xì)胞,并對(duì)存活的巨噬細(xì)胞進(jìn)行再教育,使其攻擊腫瘤細(xì)胞。此外,載氧的PFC可以增強(qiáng)GOX的催化反應(yīng),改善乏氧的TME。體內(nèi)外實(shí)驗(yàn)結(jié)果表明, aNK具有很好的腫瘤抑制和免疫激活作用。

Mei-Zhen Zou, Xian-Zheng Zhang. et al. Artifcial Natural Killer Cells for Specific Tumor Inhibition and Renegade Macrophage Re-Education. Advanced Materials. 2019
DOI: 10.1002/adma.201904495
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904495
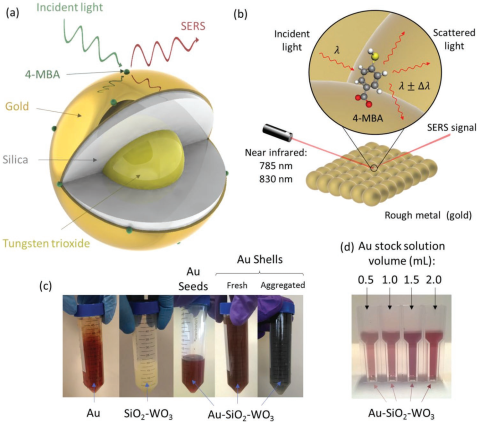
6. AFM:Au-SiO2-WO3核殼納米粒子用于表面增強(qiáng)拉曼光譜和細(xì)胞成像
隨著納米技術(shù)的快速發(fā)展,在納米尺度上檢測(cè)和控制單個(gè)物體并用于生物醫(yī)學(xué)已成為可能。在癌癥成像中,納米粒子(NPs)也具有識(shí)別單個(gè)癌細(xì)胞和精確標(biāo)記更大面積癌組織的能力。
英國(guó)埃克塞特大學(xué)朱艷秋教授團(tuán)隊(duì)報(bào)道了一種Au-SiO2-WO3納米粒子,它的表面增強(qiáng)拉曼散射(SERS)的增強(qiáng)因子可達(dá)103,對(duì)于硅晶實(shí)驗(yàn)結(jié)果表明,具有出色SERS增強(qiáng)功能的Au-SiO2-WO3在單分子檢測(cè)、細(xì)胞相容性和利用相干反斯托克斯-拉曼散射進(jìn)行的體外細(xì)胞成像方面具有顯著的優(yōu)勢(shì)。
Pablo Martinez Pancorbo, Yanqiu Zhu. et al. Novel Au–SiO2–WO3 Core–Shell Composite Nanoparticles for Surface-Enhanced Raman Spectroscopy with Potential Application in Cancer Cell Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201903549
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201903549
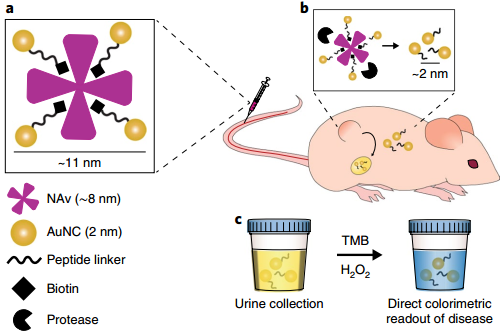
7. Nature. Nanotech.:可腎清除的催化性金納米簇用于體內(nèi)疾病監(jiān)測(cè)
超小金納米團(tuán)簇(AuNCs)具有很好的腫瘤富集和可被腎臟清除等特性,已經(jīng)成為一種用于體內(nèi)成像的靈敏探針。然而,目前還沒有研究去利用AuNCs的催化活性來(lái)實(shí)現(xiàn)體內(nèi)傳感。麻省理工學(xué)院Sangeeta N. Bhatia教授和倫敦帝國(guó)理工學(xué)院Molly M. Stevens教授合作,利用具有類過(guò)氧化物酶活性和可被腎臟代謝的AuNCs構(gòu)建了一種多功能蛋白酶納米傳感器,它可以對(duì)疾病微環(huán)境做出響應(yīng),從而在不到一小時(shí)的時(shí)間內(nèi)產(chǎn)生比色信號(hào)讀數(shù)并對(duì)疾病狀態(tài)進(jìn)行監(jiān)測(cè)分析。
實(shí)驗(yàn)通過(guò)收集比較結(jié)直腸癌小鼠和正常小鼠尿液中AuNCs的催化活性,發(fā)現(xiàn)腫瘤小鼠比健康小鼠的比色信號(hào)增加了13倍。并且該納米傳感器在被注射后4周內(nèi)會(huì)通過(guò)肝、腎而完全代謝,不會(huì)產(chǎn)生體內(nèi)毒性。
Colleen N. Loynachan, Sangeeta N. Bhatia, Molly M. Stevens. et al. Renal clearable catalytic gold nanoclusters for in vivo disease monitoring. Nature Nanotechnology. 2019
https://www.nature.com/articles/s41565-019-0527-6
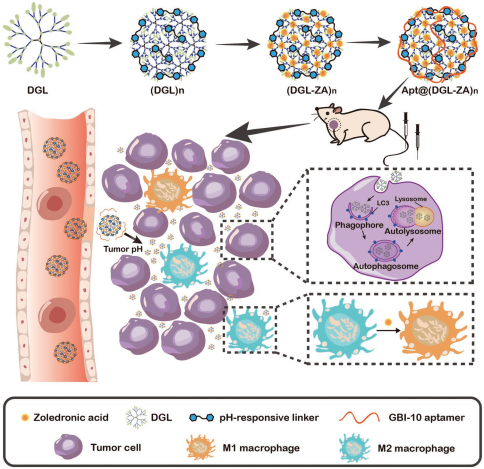
8. Adv. Sci.:類蒲公英的納米顆粒用于腫瘤微環(huán)境調(diào)節(jié)
腫瘤相關(guān)巨噬細(xì)胞(TAMs)占腫瘤細(xì)胞總數(shù)的50%以上,在腫瘤的發(fā)展和侵襲轉(zhuǎn)移中起著重要的作用。因此,通過(guò)調(diào)節(jié)TAM發(fā)生極化來(lái)重建腫瘤免疫微環(huán)境已成為一種新的治療策略。然而,這一策略也面臨著無(wú)法在腫瘤中充分滲透的問題。復(fù)旦大學(xué)蔣晨教授團(tuán)隊(duì)設(shè)計(jì)了一種可被酸誘導(dǎo)產(chǎn)生尺寸變化的納米顆粒Apt@(DGL-ZA)n NPs,它具有良好的腫瘤分布和增強(qiáng)的穿透能力。其中,樹突狀移植物多聚賴氨酸(DGLs) 是一種模擬天然異常蛋白的分子,可誘導(dǎo)腫瘤自噬,實(shí)驗(yàn)通過(guò)一種溫和的酸響應(yīng)連接劑將其交聯(lián)在NPs上。
因此該NPs在中性pH條件下可以抓住DGLs,而在腫瘤pH條件下會(huì)釋放DGLs,這種類似于蒲公英種子的行為特性使得NPs具有很長(zhǎng)的體內(nèi)循環(huán)和增強(qiáng)的腫瘤穿透性。實(shí)驗(yàn)進(jìn)一步將用來(lái)調(diào)節(jié)巨噬細(xì)胞的唑來(lái)膦酸(ZA)通過(guò)電荷吸引作用負(fù)載在DGLs上,最后通過(guò)修飾靶向肌腱蛋白- C的適配體GBI-10以實(shí)現(xiàn)腫瘤富集。體內(nèi)外實(shí)驗(yàn)結(jié)果表明,Apt@(DGL-ZA)n NPs在腫瘤組織中具有較強(qiáng)的穿透性,可以有效地對(duì)巨噬細(xì)胞進(jìn)行調(diào)控并增強(qiáng)腫瘤自噬,從而實(shí)現(xiàn)良好的體內(nèi)抗腫瘤效果。
Qin Guo, Chen Jiang. et al. Dandelion-Like Tailorable Nanoparticles for Tumor Microenvironment Modulation. Advanced Science. 2019
DOI: 10.1002/advs.201901430
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201901430
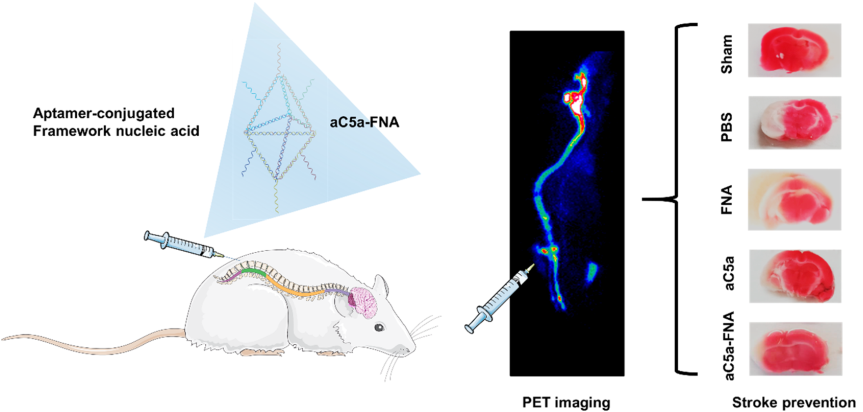
9. Nano Lett.:偶聯(lián)適配體的核酸骨架材料用于治療腦缺血再灌注損傷
如何保護(hù)瀕死神經(jīng)元免受腦缺血再灌注損傷(IRI)是治療缺血性中風(fēng)所面臨的一個(gè)重大難題。而氧化應(yīng)激和炎癥是導(dǎo)致IRI的主要原因。其中,C5a是加劇氧化應(yīng)激與炎癥反應(yīng)之間惡性循環(huán)的罪魁禍?zhǔn)字弧?strong>威斯康星大學(xué)麥迪遜分校Dawei Jiang博士和蔡偉波教授合作制備了一種與抗C5a適配體(aC5a)偶聯(lián)的核酸骨架 (FNA),它可以有選擇性地降低c5a介導(dǎo)的神經(jīng)毒性,并有效緩解腦內(nèi)氧化應(yīng)激。
實(shí)驗(yàn)采用鞘內(nèi)注射aC5a-FNA的方式對(duì)缺血性中風(fēng)大鼠進(jìn)行治療,并利用PET成像技術(shù)對(duì)aC5a-FNA在缺血性半影區(qū)的積累情況及治療效果進(jìn)行了研究。結(jié)果表明,aC5a-FNA在發(fā)生腦缺血再灌注后能快速穿透不同的腦區(qū),并能有效保護(hù)神經(jīng)元免受腦缺血再灌注損傷。
Shiyong Li, Dawei Jiang, Weibo Cai. Aptamer-Conjugated Framework Nucleic Acids for the Repair of Cerebral Ischemia-Reperfusion Injury. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02958
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02958
10. ACS Nano:源于腫瘤的細(xì)胞外囊泡可通過(guò)胞吞作用穿過(guò)完整的血腦屏障
血腦屏障(BBB)的存在給實(shí)現(xiàn)腦部藥物遞送造成了很大的困難,目前的納米藥物也都缺乏可以跨越血腦屏障的能力。已有研究表明,細(xì)胞外囊泡(EVs)對(duì)包括轉(zhuǎn)移性腦癌在內(nèi)的多種腦部疾病的發(fā)展起重要作用,因此也被認(rèn)為是一種很有前途腦部藥物遞送載體。但人們對(duì)于腫瘤源性的EVs破壞血腦屏障的能力及其機(jī)制尚不清楚。
波士頓兒童醫(yī)院Marsha A. Moses團(tuán)隊(duì)證明了腫瘤源性的EVs可以在體內(nèi)破壞完整的BBB,并且確定了胞吞作用是這一過(guò)程背后的主要機(jī)制。實(shí)驗(yàn)也利用高時(shí)空分辨率的顯微鏡證明了內(nèi)皮細(xì)胞的內(nèi)吞循環(huán)通路會(huì)參與這種細(xì)胞外轉(zhuǎn)運(yùn)。這一研究工作表明,腫瘤源性的EVs可以在體內(nèi)破壞完整的BBB,這也為實(shí)現(xiàn)向腦部遞送藥物和腦部疾病治療提供了新的策略。
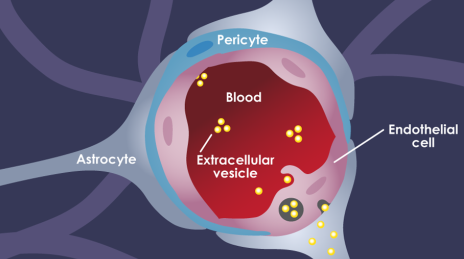
Golnaz Morad, Marsha A. Moses. et al. Tumor-Derived Extracellular Vesicles Breach the Intact Blood?Brain Barrier via Transcytosis. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04397
https://pubs.acs.org/doi/10.1021/acsnano.9b04397
11. Nano Lett.:將病毒光粒子轉(zhuǎn)化為靶向腫瘤的納米載體用于藥物遞送
從子代病毒中分離出來(lái)的溶瘤病毒光納米粒子(L-particles)是由病毒的包膜和一些被膜蛋白組成的,不含有核蛋白殼。非感染性的L-particles與成熟的溶瘤病毒粒子經(jīng)歷了相同的內(nèi)化過(guò)程,是一種很好的靶向診療平臺(tái)。然而,由于缺乏有效的方法,目前基于L-particles的診療平臺(tái)還很少見。
武漢大學(xué)龐代文教授團(tuán)隊(duì)提出了一種可以將L-particles轉(zhuǎn)化為近紅外(NIR)熒光Ag2Se量子點(diǎn)(QD)標(biāo)記的腫瘤靶向納米載體的方法,并將其用于實(shí)時(shí)原位成像和藥物遞送。實(shí)驗(yàn)采用電穿孔技術(shù)將近紅外熒光Ag2Se量子點(diǎn)標(biāo)記到L-particles上,標(biāo)記效率約為85%,而負(fù)載抗腫瘤藥物的效率約為87%。實(shí)驗(yàn)結(jié)果表明,病毒L-particles可以在不被進(jìn)一步修飾的情況下識(shí)別并進(jìn)入腫瘤細(xì)胞,因此可以作為一種主動(dòng)靶向腫瘤的納米診療平臺(tái)。

Cheng Lv, Dai-Wen Pang. et al. Transformation of Viral Light Particles into Near-Infrared Fluorescence Quantum Dot-Labeled Active Tumor-Targeting Nanovectors for Drug Delivery. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02483
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02483
12. Adv. Sci.:Janus納米子彈用于增強(qiáng)協(xié)同的抗腫瘤轉(zhuǎn)移免疫療法
光動(dòng)力療法(PDT)可以有效治療原發(fā)性腫瘤,但對(duì)遠(yuǎn)處的轉(zhuǎn)移瘤往往無(wú)效。大連理工大學(xué)孫文博士和中科院蘇州生物醫(yī)學(xué)工程技術(shù)研究所董文飛研究員合作,利用免疫原性納米顆粒介導(dǎo)的聯(lián)合PDT和磁熱治療來(lái)協(xié)同增強(qiáng)抗腫瘤轉(zhuǎn)移的免疫療法。
實(shí)驗(yàn)利用腫瘤細(xì)胞膜對(duì)該Janus納米子彈進(jìn)行包裹得到M-MONs@Ce6,它具有良好的腫瘤靶向效果和較長(zhǎng)的血液循環(huán)時(shí)間。結(jié)果表明,PDT和磁熱療法相結(jié)合后具有很強(qiáng)的協(xié)同抗癌活性,并會(huì)引發(fā)免疫原性細(xì)胞死亡,從而產(chǎn)生腫瘤特異性免疫反應(yīng)。在進(jìn)一步結(jié)合抗CTLA-4抗體后,該仿生納米顆粒可顯著清除原發(fā)和轉(zhuǎn)移性腫瘤。
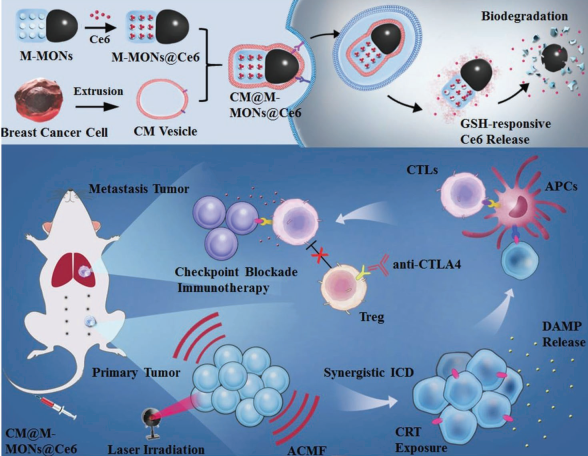
Zheng Wang, Dan Shao, Wen Sun, Wen-Fei Dong. et al. Janus Nanobullets Combine Photodynamic Therapy and Magnetic Hyperthermia to Potentiate Synergetic Anti-Metastatic Immunotherapy. Advanced Science. 2019
DOI: 10.1002/advs.201901690
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901690
13. AM綜述:3D打印技術(shù)在精準(zhǔn)醫(yī)學(xué)中的應(yīng)用
數(shù)據(jù)分析、基因組學(xué)和影像學(xué)等技術(shù)的進(jìn)步大大推動(dòng)了精準(zhǔn)醫(yī)學(xué)的發(fā)展,可以有效地針對(duì)個(gè)體患者實(shí)現(xiàn)個(gè)性化治療。而3D打印技術(shù)可通過(guò)設(shè)計(jì)具有個(gè)性化形狀、結(jié)構(gòu)和材料的精準(zhǔn)可植入材料或開發(fā)具有患者特異性的體外模型來(lái)實(shí)現(xiàn)精準(zhǔn)醫(yī)學(xué)。賓夕法尼亞大學(xué)Jason A. Burdick教授團(tuán)隊(duì)對(duì)關(guān)于3D打印技術(shù)的最新研究進(jìn)展及其在精準(zhǔn)醫(yī)學(xué)領(lǐng)域的應(yīng)用進(jìn)行了詳細(xì)綜述,并對(duì)這一領(lǐng)域所面臨的挑戰(zhàn)和發(fā)展前景進(jìn)行了介紹。
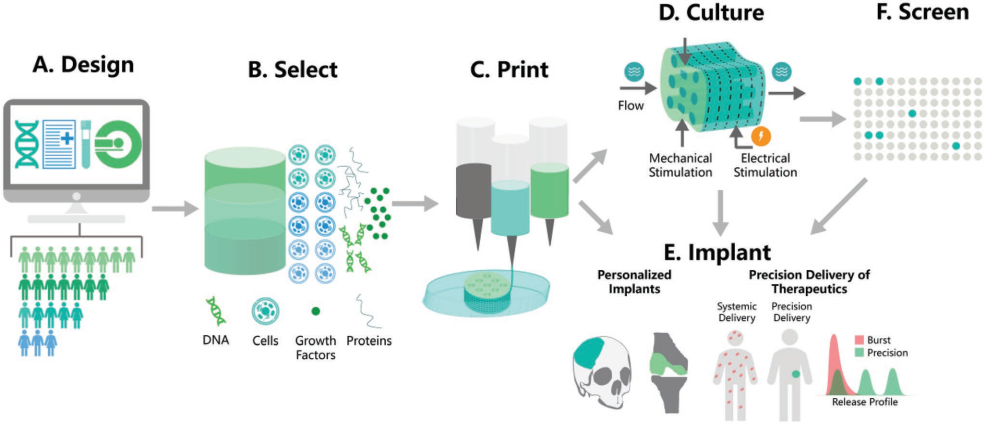
Margaret E. Prendergast, Jason A. Burdick. et al. Recent Advances in Enabling Technologies in 3D Printing for Precision Medicine. Advanced Materials. 2019
DOI: 10.1002/adma.201902516
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902516
14. ACS Nano:仿生磁性納米結(jié)構(gòu)用于針對(duì)淋巴瘤的診斷治療應(yīng)用
B-細(xì)胞淋巴瘤細(xì)胞依靠膽固醇維持著增殖和生存信號(hào),因此對(duì)淋巴瘤細(xì)胞進(jìn)行靶向的膽固醇消耗是一種很有潛力的治療策略。美國(guó)西北大學(xué)Vinayak P. Dravid教授團(tuán)隊(duì)制備了一種仿生高密度脂蛋白磁性納米結(jié)構(gòu)(HDL-MNSs),它可以結(jié)合具有高親和力的HDL受體和清除劑受體B1 (SR-B1),進(jìn)而消耗腫瘤細(xì)胞的膽固醇。
而MNS的內(nèi)核可以在外部射頻場(chǎng)下產(chǎn)生熱量,誘導(dǎo)熱休克蛋白的表達(dá)從而激活抗原呈遞細(xì)胞,進(jìn)而實(shí)現(xiàn)適應(yīng)性的抗腫瘤免疫反應(yīng)。研究通過(guò)多種方式證明了S HDL-MNSs具有細(xì)胞特異性的靶向效果,可以有效地消耗膽固醇并誘導(dǎo)熱激活介導(dǎo)的抗腫瘤免疫反應(yīng),同時(shí)也具有很好的MRI成像性能,是一種很好的針對(duì)于淋巴瘤的診療平臺(tái)。
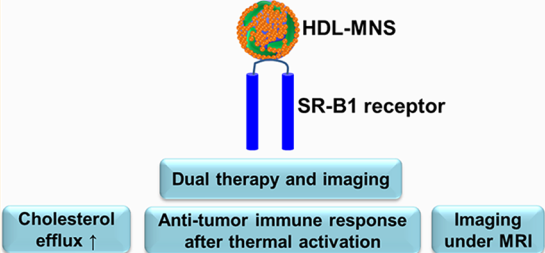
Abhalaxmi Singh, Vinayak P. Dravid. et al. Biomimetic Magnetic Nanostructures: A Theranostic Platform Targeting Lipid Metabolism and Immune Response in Lymphoma. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03727
https://pubs.acs.org/doi/10.1021/acsnano.9b03727
15. Small:內(nèi)源性H2S觸發(fā)Au@Cu2O實(shí)現(xiàn)增強(qiáng)的光聲成像和光熱治療
可被內(nèi)源性H2S觸發(fā)的智能診療試劑可以通過(guò)結(jié)合光聲成像和光熱治療來(lái)提高對(duì)結(jié)腸癌的診斷和治療效果。然而,目前這些試劑在被H2S觸發(fā)后的診療性能往往很低,這也大大限制了它們的進(jìn)一步應(yīng)用。
上海師范大學(xué)田啟威博士和楊仕平教授合作研究了可被內(nèi)源性H2S觸發(fā)的Au@Cu2O對(duì)結(jié)腸癌進(jìn)行診斷和治療的性能。與Cu2O相比,Au@Cu2O在近紅外區(qū)域的吸收能力明顯增強(qiáng),其光熱轉(zhuǎn)換效率也提高了1.2倍。實(shí)驗(yàn)結(jié)果表明,Au@Cu2O在體內(nèi)也具有良好的光聲成像和光熱性能,因此在非常低的注射劑量下也能有效治療結(jié)腸癌。
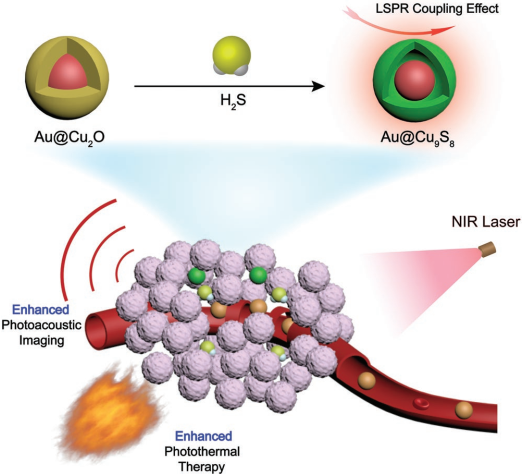
Cheng Tao, Qiwei Tian, Shiping Yang. et al. Surface Plasmon Resonance–Enhanced Photoacoustic Imaging and Photothermal Therapy of Endogenous H2S-Triggered Au@Cu2O. Small. 2019
DOI: 10.1002/smll.201903473
https://onlinelibrary.wiley.com/doi/10.1002/smll.201903473
16. AM綜述:與神經(jīng)系統(tǒng)相連接的電子學(xué)設(shè)備
開發(fā)能夠與神經(jīng)系統(tǒng)相連接的電子學(xué)設(shè)備是目前基礎(chǔ)科學(xué)和臨床醫(yī)學(xué)領(lǐng)域中的一個(gè)重要研究方向。這種含有陣列電極的設(shè)備既可用于研究正在培養(yǎng)生長(zhǎng)的細(xì)胞,也可通過(guò)植入受損或功能失調(diào)的組織以使其恢復(fù)正常功能。并且一旦被植入,這些設(shè)備中所含有的細(xì)胞就會(huì)融入組織,成為電極-組織界面的中介。
劍橋大學(xué)Damiano G. Barone教授團(tuán)隊(duì)根據(jù)不同的宿主位置(中樞神經(jīng)系統(tǒng)、中樞神經(jīng)系統(tǒng)或特殊感官)對(duì)目前關(guān)于生物混合設(shè)備的研究概況進(jìn)行了綜述,介紹了其發(fā)展的歷史背景;最后也總結(jié)了該技術(shù)所面臨的主要挑戰(zhàn)和未來(lái)的研究方向。

Amy E. Rochford, Damiano G. Barone. et al. When Bio Meets Technology: Biohybrid Neural Interfaces. Advanced Materials. 2019
DOI: 10.1002/adma.201903182
https://onlinelibrary.wiley.com/doi/10.1002/adma.201903182
17. Chem. Soc. Rev.:納米顆粒在疾病中與血管系統(tǒng)相互作用
無(wú)機(jī)納米粒子(NPs)在生物醫(yī)學(xué)中被廣泛用于成像和藥物遞送系統(tǒng)。在癌癥治療中,納米藥物可依賴于EPR效應(yīng)通過(guò)內(nèi)皮細(xì)胞遞送抗癌藥物。然而,這種響應(yīng)往往依賴于腫瘤微環(huán)境,并且不是在所有類型的腫瘤中都能持續(xù)觀察的到。與此同時(shí),越來(lái)越多的人也開始利用無(wú)機(jī)NPs來(lái)誘導(dǎo)內(nèi)皮細(xì)胞發(fā)生滲漏,進(jìn)而為控制藥物在內(nèi)皮細(xì)胞內(nèi)的遞送提供了可能。
這種主動(dòng)靶向的方法與EPR效應(yīng)十分類似,而它的藥物傳遞應(yīng)用并不局限與癌癥治療,而已經(jīng)擴(kuò)展到對(duì)其他血管相關(guān)疾病的治療中。新加坡國(guó)立大學(xué)David Tai Leong教授團(tuán)隊(duì)總結(jié)概述了對(duì)EPR效應(yīng)的最新發(fā)現(xiàn),并對(duì)其在抗癌藥物遞送系統(tǒng)中的應(yīng)用局限性進(jìn)行了評(píng)估;同時(shí)也對(duì)NPs誘導(dǎo)的內(nèi)皮細(xì)胞泄漏(NanoEL)現(xiàn)象進(jìn)行了介紹,討論了NanoEL效應(yīng)的主要機(jī)制特征和其在治療血管相關(guān)疾病以及癌癥中的適用性。
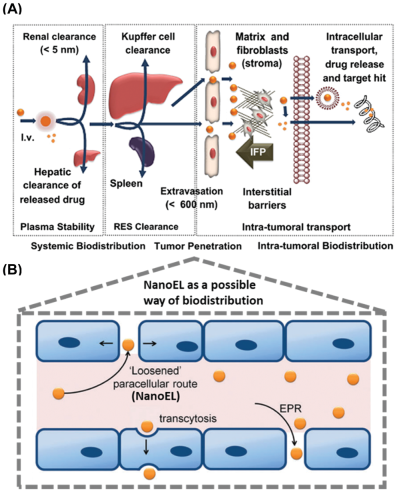
Jie Kai Tee, David Tai Leong. et al. Nanoparticles’ interactions with vasculature in diseases. Chemical Society Reviews. 2019
DOI: 10.1039/C9CS00309F
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00309f#!divAbstract
18. ACS Nano:線粒體內(nèi)兩親性肽的異質(zhì)組裝用于超分子癌癥治療
韓國(guó)科學(xué)技術(shù)院Sehoon Kim、蔚山國(guó)家科學(xué)技術(shù)研究院Sang Kyu Kwak和Ja-Hyoung Ryu合作,利用癌細(xì)胞線粒體內(nèi)的兩親性多肽的異質(zhì)組裝,構(gòu)建了具有精確的形態(tài)學(xué)和生物學(xué)特性的納米結(jié)構(gòu)。
實(shí)驗(yàn)利用具有線粒體靶向特性的Mito-FF和Mito-FF在細(xì)胞內(nèi)進(jìn)行自組裝,發(fā)現(xiàn)二者的協(xié)同作用可以在體內(nèi)外引起癌細(xì)胞線粒體的破壞。這以工作充分證明了手性控制對(duì)生物系統(tǒng)內(nèi)肽的自組裝會(huì)有顯著影響,從而也為設(shè)計(jì)肽生物材料提供了一個(gè)新的有效策略。
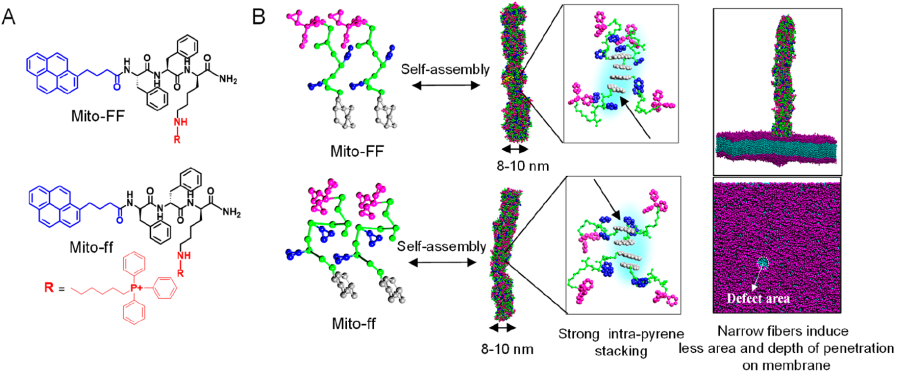
M. T. Jeena, Sang Kyu Kwak, Sehoon Kim, Ja-Hyoung Ryu. et al. Heterochiral Assembly of Amphiphilic Peptides Inside the Mitochondria for Supramolecular Cancer Therapeutics. ACS Nano. 2019
DOI: 10.1021/acsnano.9b02522
https://pubs.acs.org/doi/10.1021/acsnano.9b02522
19. AM:對(duì)腦內(nèi)和腫瘤內(nèi)血管進(jìn)行NIR-II光激發(fā)的雙光子成像
對(duì)腦內(nèi)或腫瘤內(nèi)血管的形態(tài)和動(dòng)力學(xué)進(jìn)行具有高穿透深度、高信號(hào)背景比(SBR)腫瘤活體熒光成像,對(duì)于研究血管相關(guān)疾病和癌癥來(lái)說(shuō)具有重要的意義。南京工業(yè)大學(xué)劉杰博士和新加坡國(guó)立大學(xué)劉斌教授合作設(shè)計(jì)了一種高亮度熒光團(tuán)(BTPETQ),它具有長(zhǎng)波長(zhǎng)吸收和聚集誘導(dǎo)近紅外(NIR)發(fā)射(最大波長(zhǎng)為700 nm)的特性,可以用于在NIR- II光(1200 nm)激發(fā)下對(duì)小鼠的大腦和腫瘤血管進(jìn)行活體雙光子熒光(2PF)成像。
實(shí)驗(yàn)通過(guò)納米沉淀法制備的BTPETQ在水介質(zhì)中粒徑均勻,量子產(chǎn)率高達(dá)19 1%。研究進(jìn)一步利用BTPETQ對(duì)小鼠大腦血管結(jié)構(gòu)進(jìn)行2PF成像,可以得到一個(gè)為924 μm的三維血管網(wǎng)絡(luò)。此外,由于腫瘤部位血管具有滲漏的結(jié)構(gòu)特點(diǎn),BTPETQ可在其中實(shí)現(xiàn)增強(qiáng)的2PF,這也有助于實(shí)現(xiàn)對(duì)正常血管和深部腫瘤組織血管進(jìn)行區(qū)分。
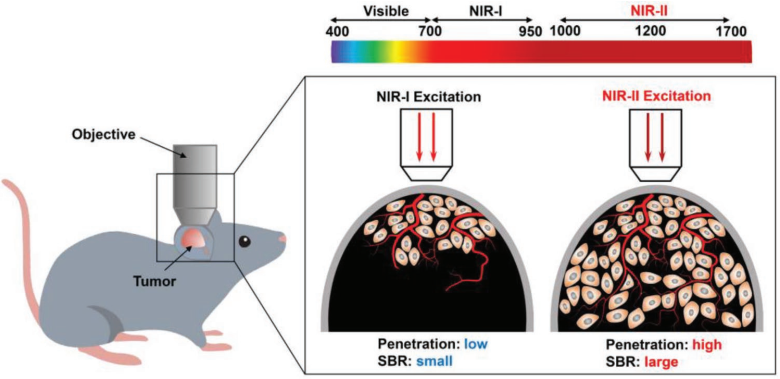
Shaowei Wang, Jie Liu, Bin Liu. et al. NIR-II-Excited Intravital Two-Photon Microscopy Distinguishes Deep Cerebral and Tumor Vasculatures with an Ultrabright NIR-I AIE Luminogen. Advanced Materials. 2019
DOI: 10.1002/adma.201904447
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904447
20. Adv. Sci.:非平面芳香烴誘導(dǎo)的DNA損傷用于選擇性殺傷癌細(xì)胞
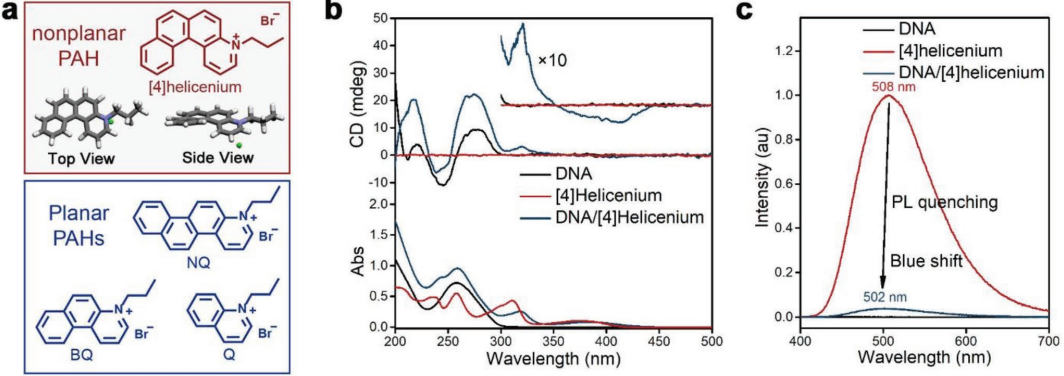
化療藥物可以通過(guò)抑制癌細(xì)胞的DNA合成來(lái)阻止腫瘤的生長(zhǎng)。近年來(lái)的研究發(fā)現(xiàn),許多平面多環(huán)芳烴(PAHs)衍生物可以通過(guò)與DNA交聯(lián)而產(chǎn)生抗癌活性。然而,由于這些多環(huán)芳烴對(duì)大多數(shù)腫瘤的治療效率和選擇性都較低,其實(shí)際應(yīng)用也受到了很大的限制。上海交通大學(xué)邱惠斌教授和劉培峰教授合作報(bào)道了一種具有抗癌特性的非平面多環(huán)芳烴[4] helicenium,與正常細(xì)胞相比,它對(duì)肝癌、肺癌和白血病細(xì)胞等都具有高度選擇性的細(xì)胞毒性。
因此,[4] helicenium對(duì)荷瘤小鼠的腫瘤生長(zhǎng)有明顯的抑制作用,而對(duì)正常小鼠則無(wú)明顯副作用。實(shí)驗(yàn)結(jié)果表明,[4] helicenium對(duì)腫瘤細(xì)胞DNA的損傷程度會(huì)高于正常細(xì)胞,導(dǎo)致腫瘤細(xì)胞周期阻滯和凋亡增加。這一研究充分揭示了多環(huán)芳烴在選擇性殺傷腫瘤細(xì)胞中的作用和分子機(jī)制,從而為腫瘤的精準(zhǔn)治療提供了有效的新策略。
Yan Zhou, Huibin Qiu, Peifeng Liu. et al. Selective Killing of Cancer Cells by Nonplanar Aromatic Hydrocarbon-Induced DNA Damage. Advanced Science. 2019
DOI: 10.1002/advs.201901341
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901341
21. Small:靶向遞送isoDGR標(biāo)記的納米金以實(shí)現(xiàn)免疫協(xié)同治療
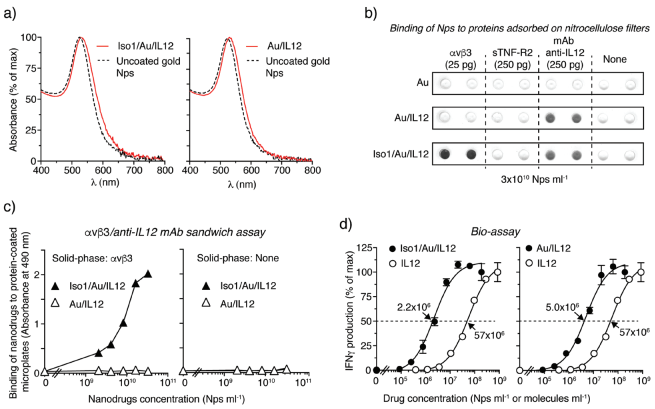
白細(xì)胞介素-12 (IL12)是一種具有強(qiáng)大免疫治療抗癌活性的細(xì)胞因子,但是其臨床應(yīng)用也受到較大的全身毒性的限制。IRCCS圣拉斐爾科學(xué)研究所Angelo Corti 教授和Flavio Curnis博士合作,利用環(huán)化肽CGisoDGRG (Iso1)和小鼠IL12對(duì)金納米球進(jìn)行功能化,所得到的Iso1 / Au / IL12是單分散且穩(wěn)定,且具有識(shí)別αvβ3和IL12受體的能力。
研究結(jié)果表明,注射低劑量的Iso1/Au/IL12(相當(dāng)于18-75 pg的IL12)可以在纖維肉瘤和乳腺癌小鼠模型中誘導(dǎo)產(chǎn)生顯著的抗腫瘤作用,并且不會(huì)引發(fā)毒性。而注射同等劑量的Au/IL12(缺乏Iso1的納米藥物)則不能抑制腫瘤的生長(zhǎng),游離的IL12也只有在達(dá)到15000 pg時(shí)才能達(dá)到類似的效果。并且,Iso1/Au/IL12可以顯著增強(qiáng)天然免疫細(xì)胞(如NK、iNKT細(xì)胞、單核細(xì)胞、中性粒細(xì)胞)對(duì)腫瘤的影響。這一研究表明,將IL12與isoDGR標(biāo)記的納米金進(jìn)行偶聯(lián)是提高IL12治療效果和維持過(guò)繼性細(xì)胞免疫治療的一種有效策略。
Anna Maria Gasparri, Angelo Corti, Flavio Curnis. et al. Boosting Interleukin-12 Antitumor Activity and Synergism with Immunotherapy by Targeted Delivery with isoDGR-Tagged Nanogold. Small. 2019
DOI: 10.1002/smll.201903462
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.201903462











