
第一作者:Xiao Han、Shufang Shen
通訊作者:汪超、劉莊、顧臻
通訊單位:蘇州大學
研究亮點:
1. 發展了一種來源安全的納米紅細胞體,通過膜融合方式載入抗原,無需化學反應方式。
2. 利用衰老或受損的RBC是巨噬細胞和脾臟樹突狀細胞的清除目標的特點,將納米紅細胞體靶向至體內這兩種主要的抗原呈遞細胞。
3. 實現了個性化治療
免疫檢查點阻斷治療
免疫檢查點阻斷(ICB)治療啟動了患者的免疫系統,導致各種類型的腫瘤消退。但是,在一些惡性腫瘤中,免疫應答率仍然很低,并且在ICB治療后可能發生免疫相關的不良事件,這表明該方法需要改進以在降低毒性的同時使活性最大化。
通過ICB與其他治療方法的結合已被證明可以提高應答率。其中,一些臨床試驗已經證實,癌癥疫苗可以在癌癥患者中引發免疫反應,但是客觀臨床反應的實現仍然具有挑戰性。
可能的原因包括腫瘤微環境的免疫抑制特性(如腫瘤細胞的程序性死亡配體1(PD-L1)的高表達)。另外,在抗原呈遞細胞(APC)上的PD-L1表達不能誘導T細胞增殖而能夠誘導調節性T細胞。因此,抗PD-L1(aPDL1)與癌癥疫苗的組合可能是有益的。
另外,腫瘤抗原向專職性APCs在體內的低效率遞送會導致癌癥疫苗的效力降低。在過去的幾十年中,已經在動物模型中報道了各種抗原遞送系統。與游離抗原相比,微納米制劑和大尺寸的生物材料作為有效的抗原遞送工具和作為改善免疫反應的佐劑可以產生強大的抗腫瘤免疫反應。
但是,其中許多是合成材料,需要化學結合。由于臨床實踐中與生理相互作用和新陳代謝,此類遞送系統的安全性仍需考慮。
成果簡介
因此,蘇州大學汪超教授、劉莊教授、加州大學洛杉磯分校顧臻教授等人報道了一種基于紅細胞膜和aPDL1阻斷劑的組合癌癥疫苗,利用受損的RBC將腫瘤相關抗原(TAAs)輸送至關鍵的次級淋巴器官的APCs,可有效增強癌癥免疫療法。
研究人員通過將腫瘤細胞膜相關抗原與納米紅細胞融合在一起,將腫瘤抗原加載到納米紅細胞上。這種載有腫瘤抗原的納米紅細胞體(nano-Ag@erythrosome)在體內引起抗原反應,并與抗程序性死亡配體1(PD-L1)阻斷相結合,抑制了B16F10和4T1腫瘤模型中的腫瘤生長。在生成的一個腫瘤模型中顯示通過融合紅細胞和手術切除的腫瘤可以實現“個性化nano-Ag@erythrosome”,從而有效地減少了手術后的腫瘤復發和轉移。
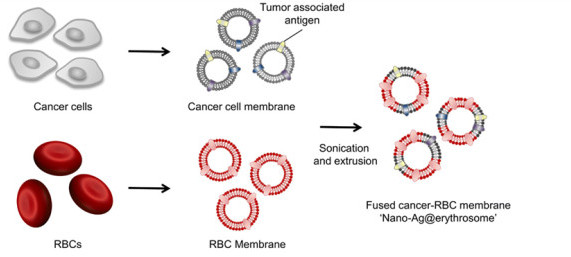
圖1. Nano-Ag@erythrosome的制備示意圖
要點1:Nano-Ag@erythrosome的制備與DC細胞的攝取
研究人員通過超聲和物理擠壓方法獲得了紅細胞膜和腫瘤膜融合的nano-Ag@erythrosome,SDS-PAGE凝膠電泳和Western blot實驗都表明了抗原成功地載到了nano-Ag@erythrosome,即兩種膜融合在一起。通過與樹突狀細胞(DC)共孵育,激光共聚焦和流式結果證明nano-Ag@erythrosome能被DC細胞攝取并且上調了CD80和CD86的表達。
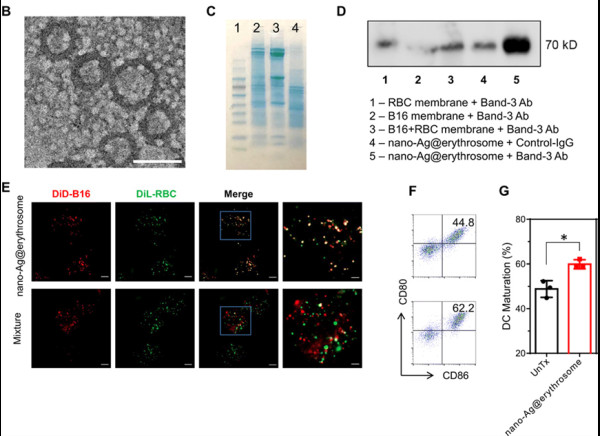
圖2. Nano-Ag@erythrosome的表征
要點2:Nano-Ag@erythrosome激活各種免疫細胞
為了評估nano-Ag@erythrosome對APCs體內靶向的作用,研究人員根據蛋白質重量調節RBC膜與腫瘤細胞膜(R:T)的比例。實驗表明R:T=20:1時,nano-Ag@erythrosome可以很好的靶向到脾。通過檢測注射nano-Ag@erythrosome后體內的免疫細胞的各種因子的表達情況。這些結果表明nano-Ag@erythrosome有效激活了體內各種免疫細胞。
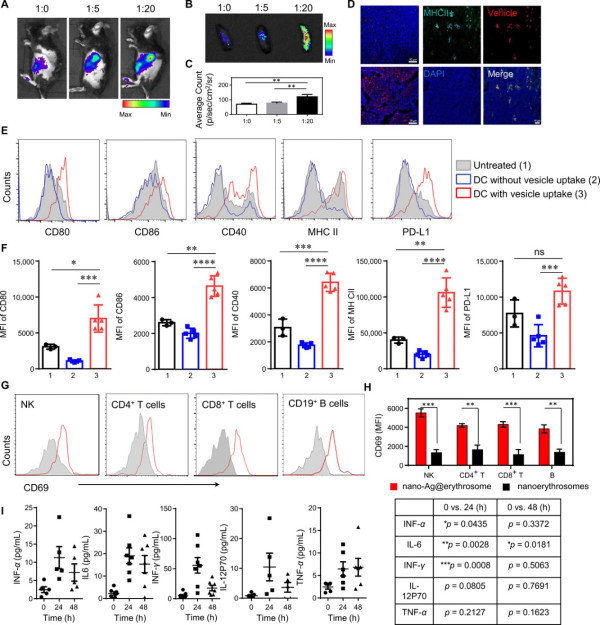
圖3. Nano-Ag@erythrosome靶向脾APC并誘導免疫細胞活化
要點3. Nano-Ag@erythrosome聯合PD-L1阻斷劑的治療功效
緊接著,研究人員測試了nano-Ag@erythrosome在荷瘤C57BL/6小鼠中的治療效果。在B16F10-Luc腫瘤模型中,小鼠接受了三劑含或不含aPDL1的nano-Ag@erythrosome。盡管腫瘤生長不受單獨的nano-Ag@erythrosome的影響,但與aPDL1的組合是有效的。
通過檢測腫瘤中環境,發現腫瘤浸潤性淋巴細胞增多進一步導致IFN-γ上升,并會上調PD-L1,然而通過檢測非造血細胞(CD45?細胞)上的PD-L1表達,發現與aPDL1治療聯合使用時,腫瘤在CD45?細胞上具有較低的PD-L1表達,這表明在腫瘤微環境中對PD-L1介導的T細胞衰竭具有抑制作用。總體而言,這些結果表明,通過aPDL1處理可增大由nano-Ag@erythrosome的抗癌免疫應答。
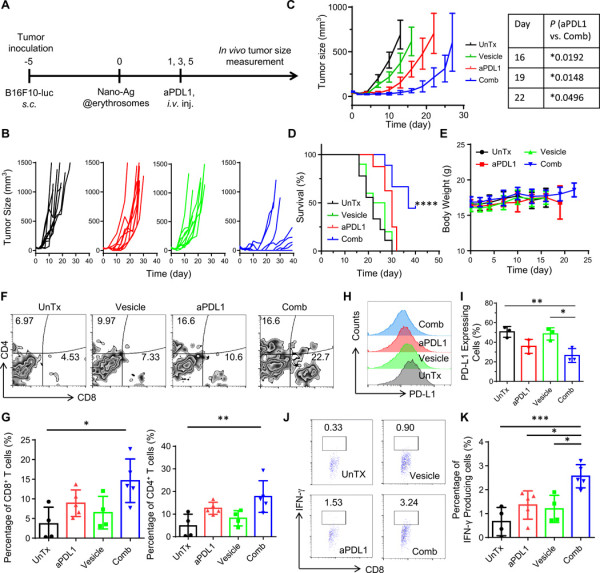
圖4.用于體內抑制B16F10-Luc黑色素瘤生長的聯合免疫療法
要點4:個性化治療
在癌癥患者中,個性化的癌癥疫苗可能至關重要,因為每個患者的基因突變都會導致表達獨特的腫瘤新抗原的產生。因此,研究人員還實施了一個模型模型,以評估所開發的方法在切除原發腫瘤后是否能夠抑制腫瘤的復發和轉移擴散。
通過手術切除腫瘤后,獲得單細胞懸液,并從相同的荷瘤小鼠中收集RBC,以產生自體nano-Ag@erythrosome。結果表明,nano-Ag@erythrosome聯合aPDL1治療組控制了繼發性腫瘤的生長并在手術后延長了生存期,且與對照組相比沒有明顯的副作用。
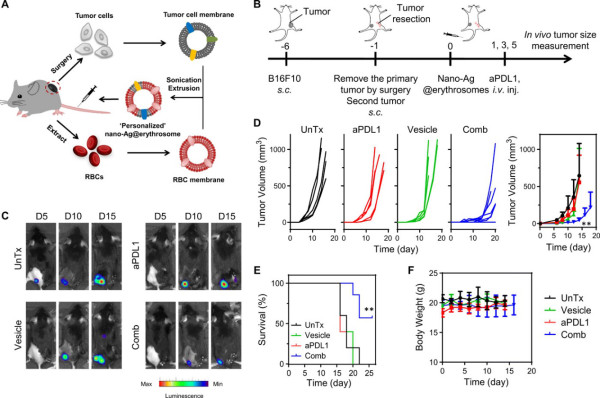
圖5.自組裝納米結構抑制腫瘤生長研究
小結
綜上所述,這項工作開發了一種使用納米紅細胞體將TAAs遞送至脾臟DC的新方法,且擴展該方法以開發個性化的腫瘤疫苗。此外,這種基于紅細胞體的技術可以與其他具有特定物質的膜融合在一起,以治療不同的疾病。
參考文獻:
Han, X.; Shen, S.; Fan, Q.; Chen, G.; Archibong, E.; Dotti, G.; Liu, Z.; Gu, Z.; Wang, C., Red blood cell–derived nanoerythrosome for antigen delivery with enhanced cancer immunotherapy. Science Advances2019, 5 (10), eaaw6870.
https://advances.sciencemag.org/content/5/10/eaaw6870











