第一作者:霍帥東、宮寧強
通訊作者:霍帥東、梁興杰
通訊單位:國家納米科學中心
研究亮點:
1. 打破常規,設計了一種類似向陽花納米結構的多級次納米藥物遞送系統。
2. 基因沉默只能通過近紅外輻射激活,僅在腫瘤部位發生,而對正常組織無副作用。
3. 納米向陽花可以保護基因/藥物免于在細胞質中降解/失活,并通過釋放的超小載體直接傳遞到細胞核中,使其直接滲透到核孔復合體中。
基因治療中,納米藥物的尺寸該如何設計
基因治療在不孕不育,HIV,癌癥等疾病治療中,展示出巨大的潛力。例如在癌癥治療中,基因治療的成功主要取決于有效基因遞送載體的開發。在傳遞過程中,基因載體必須穿越多個生物屏障和細胞膜,并逃脫核內體的包裹和核酸酶的降解。與基于病毒的傳遞策略相比,非病毒基因傳遞方法不僅在DNA / RNA的裝載和釋放,靶向傳遞和細胞內攝取方面面臨著重大挑戰,而且還涉及生物相容性和免疫應答等問題。
當前,納米技術為工程設計將基因轉移到癌細胞的更穩定和有效的載體提供了巨大的潛力。由于其獨特的物理化學特性,許多納米材料已被用于基因傳遞中。其中,具有特定大小和表面功能化的金納米顆粒(Au NPs)可以克服基因在與細胞、體內局部和系統遞送相關層面的障礙,這已成為體外和體內研究最多的基因載體系統之一。
但是,目前的Au NPs載體仍然面臨一些缺陷。一方面,由于細胞的胞吐作用,超小NPs的凈攝取量仍然很低,導致治療效果降低。另一方面,有效地從體內清除NPs是臨床實踐中NPs安全翻譯的關鍵要求。
為了既利用小NPs可增強核內在化,又利用大NPs增強的腫瘤累積/滯留,科學家開發了刺激響應的藥物輸送系統,該載體通過對內部腫瘤微環境的反應(酶,低 pH等)或外部刺激(紫外線(UV),近紅外(NIR)輻射,磁場等)來縮小尺寸,以實現該目的。
成果簡介
有鑒于此,國家納米科學中心梁興杰課題組設計并構建了DNA介導自組裝的Au-DNA向陽花狀多級次納米結構(納米向陽花)。在體外近紅外光的調控響應下,使大尺寸顆粒(~200 nm)被動靶向到腫瘤部位,中等尺寸顆粒(~50 nm)滲透進腫瘤內部,小尺寸顆粒(<10 nm)被腫瘤細胞高效攝取,最終實現了良好的基因調控效果。
納米向陽花表現出較強的NIR吸收和光熱轉化能力。在近紅外輻射下,大尺寸的納米結構可以分解并釋放出超小的金納米顆粒。c-myc癌基因沉默序列修飾的2 nm NPs的釋放改善了NPs的細胞核通透性,從而提高了轉染效率。研究表明,通過協同控制體外預培養時間,體內循環時間和照射時間,可實現細胞攝取量的增加,基因沉默功效可調節,并抑制腫瘤的效果。可變形的納米向日葵為納米載體的設計提供了極好的模型,該載體系統在生物醫學應用中具有巨大的潛力。
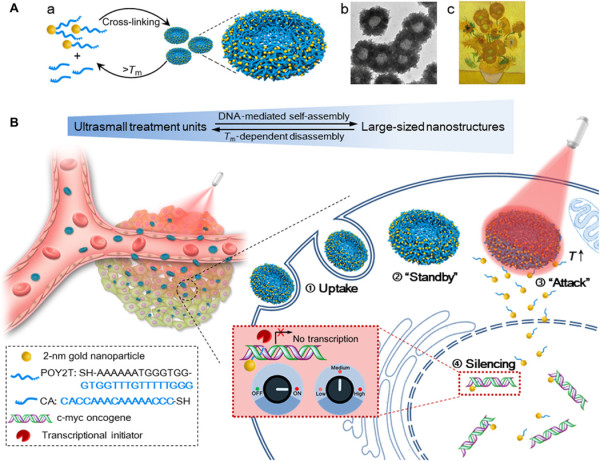
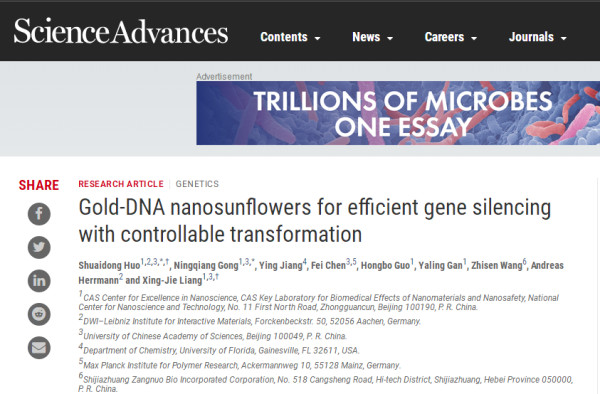
圖1. 設計原理
要點1:納米向陽花的設計合成
研究人員使用首先配體交換方法合成了巰基-寡核苷酸(SH-POY2T)覆蓋2 nm金納米顆粒(Au-TIOP NPs),POY2T可與c-myc癌基因的P2啟動子結合形成三鏈體結構并下調癌細胞的c-myc表達。
同時,設計了另一條單鏈序列名為CA,以與POY2T序列的尾部互補雜交,從而阻斷了POY2T與c-myc癌基因結合的能力。最終,2 nm Au-POY2T NPs和CA序列自組裝成大尺寸的向日葵狀結構。TEM和bio-TEM結果表明,Au-TIOP NPs呈現200 nm大小的向日葵狀的納米結構。
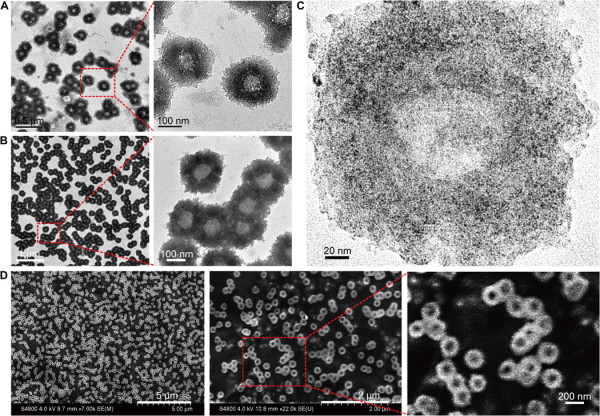
圖2. 多級次納米向陽花的表征
要點2:納米結構的表面等離子體共振和光熱表征
先前的研究表明,金納米顆粒的表面等離子體效應可能由于自組裝或團聚而改變。結果顯示,相比于單分散的單個2 nm Au-POY2T NPs,在DNA介導的自組裝過程之后獲得的納米結構在NIR區域顯示出寬而強的吸收。
在NIR照射下,有明顯的光熱效果。而且,均勻的大尺寸納米向陽花具有光熱分解特性。在熱誘導NIR輻射的作用下,大尺寸結構分解為較小的部分,并生成了超小尺寸單元(Au-POY2T NPs)。
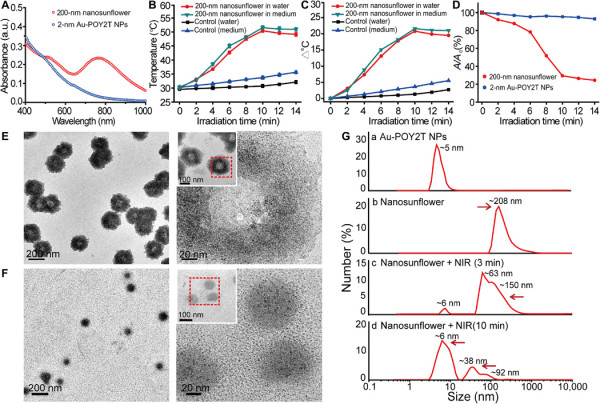
圖3.自組裝納米結構的光熱性質和分解行為研究
要點3. 細胞攝取
研究人員用過細胞經過2 nm Au-POY2T NP、自組裝納米結構和自組裝納米結構+NIR處理,在不同的預孵育時間(1、3、6和12小時)提取細胞核用于ICP-MS分析 細胞攝取情況。
這些結果表明,通過調節細胞預培養時間和NIR照射時間點,可以很好地控制Au-POY2T NP在細胞核中的分布。同時,結果也表明,與游離POY2T序列和單個Au-POY2T NP相比,可變形納米結構在c-myc癌基因和癌蛋白沉默中具有出色的能力。
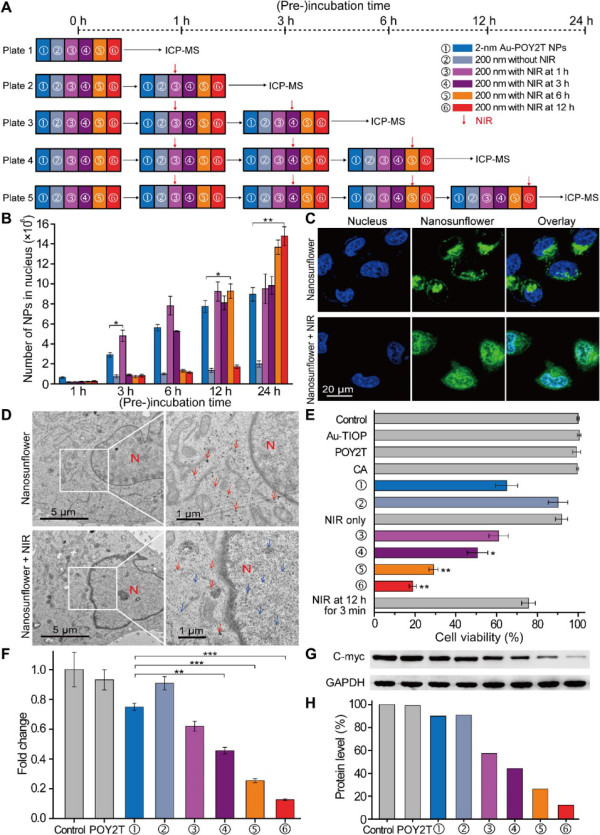
圖4.自組裝納米結構的體外細胞定位和基因沉默研究
要點4:腫瘤生長抑制研究
接著,研究人員使用在BALB/c上構建的MCF-7乳腺腫瘤模型來證明可控的納米向日葵在體內的抗腫瘤作用。在構建模型后的9,12,15天注射各組納米粒子,并在注射后1, 3, 6, 12 h給予NIR光照。
研究結果發現,在靜脈注射后12h照射的納米向日葵治療組中顯示出顯著的抗腫瘤作用,對比發現,腫瘤體積約為對照組的1/10,表明沉默基因單位被有效遞送至腫瘤部位。而且納米向日葵對正常組織沒有明顯的毒副作用,而對腫瘤有優異的治療能力。
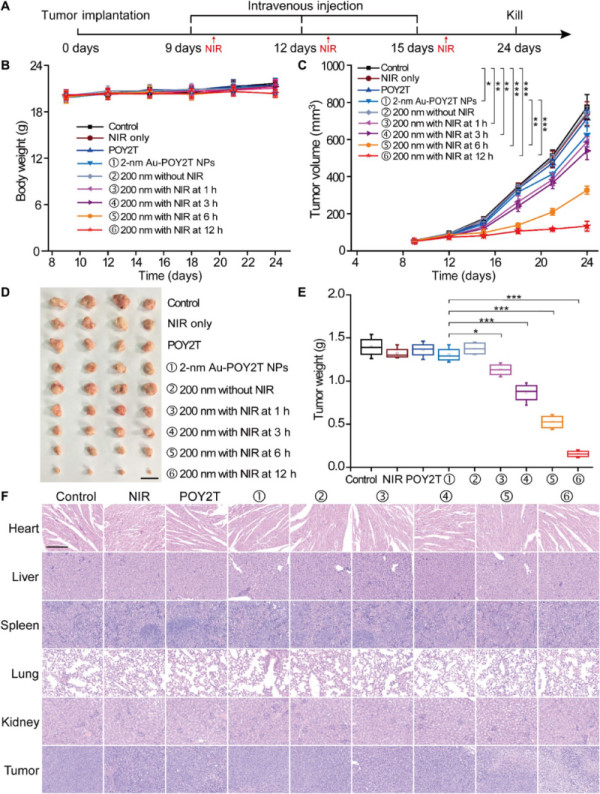
圖5. 自組裝納米結構抑制腫瘤生長研究
小結
綜上所述,這項工作設計并構建了一種DNA介導的自組裝納米結構用于進行腫瘤基因治療,為構建可通過外部條件控制調節基因表達水平的可變形基因載體提供了新的借鑒,而且也進一步證明了Au納米藥物的可行性。
參考文獻:
Huo, S. et al. Gold-DNA nanosunflowers for efficient gene silencing with controllable transformation.Science Advances 2019, 5, eaaw6264.
https://advances.sciencemag.org/content/5/10/eaaw6264
課題組介紹:

梁興杰,國家納米科學中心研究員,博士生導師。主要從事納米藥物在生物體系中的構效機制,優化納米藥物的成藥性并且用于臨床研究。
國家杰出青年基金獲得者(生物材料和納米醫學),中國科學院納米材料的生物醫學效應和納米安全重點實驗室副主任, 中國科學院納米科學卓越中心納米藥物組組長。《Biophysics Reports》 和 《Biomaterials》 雜志副主編, 《ACS Nano》 建議編委會雜志編委, 《Current Nanoscience》, 《Theranostics》, 《Biomaterials Research》等雜志編委及《Biotechnology Advances》雜志客座編委。
課題組網站
http://www.nanoctr.cas.cn/liangxingjie/











