1. AM:仿生納米硅-膠原支架用于原位骨再生
目前用于骨組織工程(BTE)的納米硅-膠原(nSC)復合材料往往實現均勻的表面功能化,因此在“復制”天然骨的復雜結構和生物活性時能力有限。哈佛大學醫學院Jinjun Shi教授、中科院化學研究所Xing Wang博士和北京大學第三醫院余家闊教授合作利用一種生物硅化策略使多孔膠原支架具有均勻穩定的骨誘導表性面,因此合成的nSC復合材料具有天然骨樣的多孔結構和納米硅包覆層。
實驗發現,nSC支架的骨誘導活性與硅包覆層的表面粗糙度和硅含量密切相關。在不使用外源性細胞和生長因子(GFs)的情況下,nSC支架可以對兔的顱骨缺損模型進行成功地修復,這是由于該nSC支架可協同激活與間充質干細胞募集和骨再生相關的多種信號通路。綜上所述,這一研究所提出的表面生物硅化方法也可用于制備其他大尺寸、復雜的多孔結構和具有不同的骨誘導活性的BTE支架,具有很好的臨床應用前景。
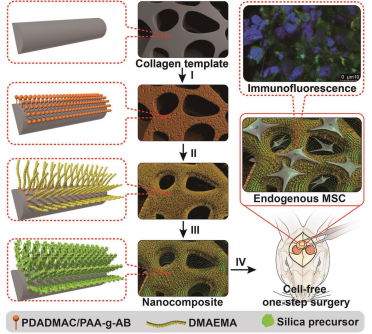
Shao-Jie Wang, Jinjun Shi, Xing Wang, Jia-Kuo Yu. et al. Biomimetic Nanosilica–Collagen Scaffolds for In Situ Bone Regeneration: Toward a Cell-Free, One-Step Surgery. Advanced Materials. 2019
DOI: 10.1002/adma.201904341
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904341
2. ACS Nano:鞘內給藥納米簇用于保護神經元免受氧化應激作用
氧化應激是腦缺血再灌注(I/R)損傷的主要原因之一,而實現抗氧化劑在腦部的高效積累則有望有效防止大腦出現I/R損傷。威斯康星大學麥迪遜分校Dalong Ni博士和蔡偉波教授合作利用正電子發射斷層成像(PET)技術,對納米抗氧化劑多金屬氧酸鹽(POM)在大腦中的攝取進行了非侵入性地實時監測。
研究結果表明,POM納米簇在被鞘內注射后會迅速到達缺血半暗區并有效清除活性氧(ROS),進而抑制氧化應激并使得腦I/R損傷模型的腦梗死面積顯著縮小,神經功能恢復。這一研究表明,通過鞘內注射納米抗氧化劑是改善腦I/R損傷的一種新型高效的治療策略。
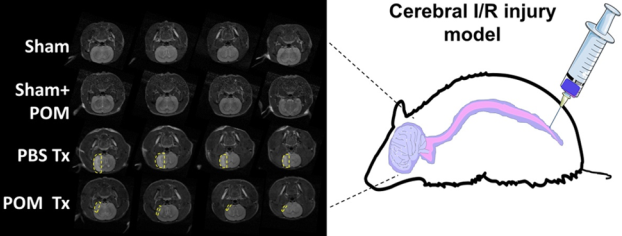
Shiyong Li, Dalong Ni, Weibo Cai. et al. Intrathecal Administration of Nanoclusters for Protecting Neurons against Oxidative Stress in Cerebral Ischemia/Reperfusion Injury. ACS Nano. 2019
DOI: 10.1021/acsnano.9b06780
https://pubs.acs.org/doi/10.1021/acsnano.9b06780
3. Nano Lett.:納米RNP可以克服腫瘤治療中的異質性問題
腫瘤的異質性是導致傳統癌癥治療失敗的重要因素之一,其出現的原因是在腫瘤發展過程中,腫瘤細胞亞群的遺傳差異會不斷地積累。由于腫瘤生長過程中遺傳突變的多樣性,聯合使用多種藥物對異種腫瘤進行治療的效果也往往很有限。哈爾濱醫科大學蔣傳路教授、天津醫科大學康春生教授、南開大學史林啟教授和劉陽教授合作使用攜帶有sgRNAs、基于CRISPR/ cas9的納米RNP來有效地解決腫瘤治療中的異質性問題。
這種納米RNP是由Cas9核糖核酸蛋白、sgRNAs以及響應性聚合物組合而成,它具有很好的體內循環穩定性、增強的腫瘤積累效果和在靶向的腫瘤細胞中進行高效基因編輯的能力。由于結合了可以靶向STAT3和RUNX1的sgRNAs,該納米RNP可以在異質性腫瘤模型中高效地破壞基因表達并影響腫瘤細胞增殖,從而顯著抑制異質性腫瘤的增長。
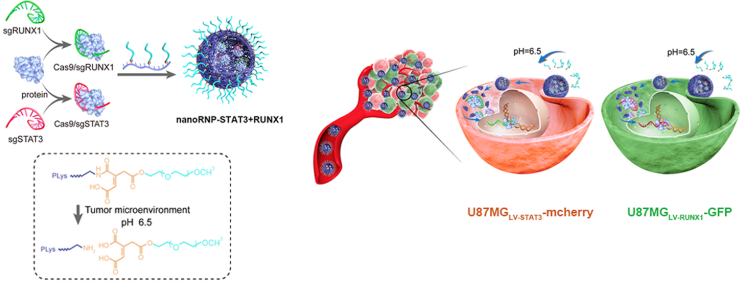
Qi Liu, Chuanlu Jiang, Linqi Shi, Chunsheng Kang, Yang Liu. et al. NanoRNP Overcomes Tumor Heterogeneity in Cancer Treatment. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02501
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02501
4. AFM:超聲激活的納米系統用于調節腫瘤微環境并增強聲動力治療
聲動力治療(SDT)是一種非侵入性、具有高穿透深度的治療方法,在治療深部實體腫瘤時具有很好的應用前景。然而,SDT的有效性往往也受到實體腫瘤乏氧微環境的限制。中科院上海硅酸鹽研究所祝迎春研究員和上海交通大學郝永強教授合作,將高鐵酸鹽(VI)和原卟啉IX整合到可生物降解的中空介孔有機硅納米材料中,然后將其和相變材料月桂酸進行組裝開發了一種可被超聲激活的納米系統。
高鐵酸鹽(VI)與水以及腫瘤細胞中過表達的過氧化氫和谷胱甘肽(GSH)會發生反應,從而在腫瘤微環境中產生氧氣并消耗GSH,活性氧(ROS)的產生則是通過原卟啉增強的SDT和細胞內發生的類芬頓反應來實現的。并且,超聲誘導的溫和熱療也可使得月桂酸發生相變,進而實現利用超聲對氧和ROS的釋放、GSH的消耗等過程的控制。研究結果表明,該納米系統可以發揮生成氧氣、原位消耗GSH和生成ROS等過程的協同作用來增強SDT對乏氧腫瘤的療效,在體內外對骨肉瘤的生長都有顯著的抑制效果。
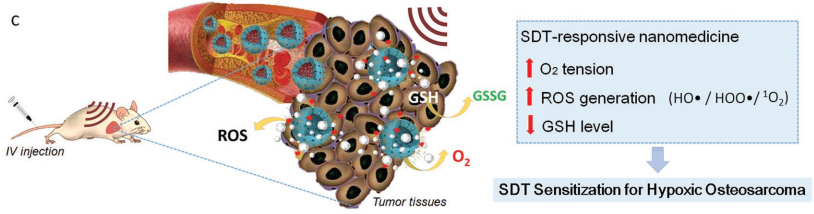
Jingke Fu, Yingchun Zhu, Yongqiang Hao. et al. Ultrasound-Activated Oxygen and ROS Generation Nanosystem Systematically Modulates Tumor Microenvironment and Sensitizes Sonodynamic Therapy for Hypoxic Solid Tumors. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201906195
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201906195
5. Small:功能化DNA對外泌體和囊泡進行編程進而用于腫瘤診療
外泌體是一種調節許多生理和病理過程的重要信息載體。中山大學廖玉輝教授和黃曦教授合作,將功能化DNA作為鉸鏈來將量子點(QDs)錨定在外泌體表面,進而設計了一種溫和的生物標記策略。研究發現,被QDs標記的外泌體會迅速被腫瘤細胞吞噬,因此它可以作為一種標記腫瘤的特異性試劑。
此外,實驗也通過氣動脂質體擠出器構建了M1巨噬細胞(M1mv)的人工囊泡,結果發現M1mv可以有效殺死腫瘤細胞,實現理想的生物治療效果。實驗為了增強M1mv的抗腫瘤作用和藥物釋放的特異性,構建了靶向給藥系統并實現了對特異性mRNA響應的藥物遞送和可視化腫瘤治療。這一工作開發的策略大大促進了對外泌體和囊泡的標記以及功能化的效率,同時也構建了具有生物治療和化療功能的藥物遞送囊泡,從而為腫瘤的診療提供了新的思路。
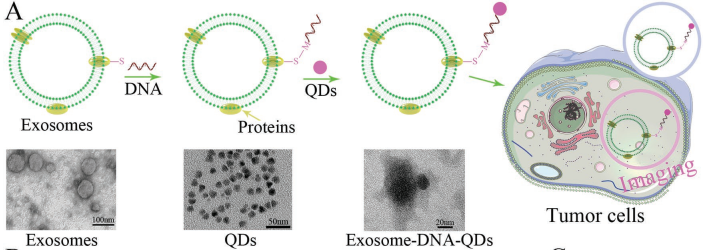
Zhijin Fan, Yuhui Liao, Xi Huang. et al. Functionalized DNA Enables Programming Exosomes/Vesicles for Tumor Imaging and Therapy. Small. 2019
DOI: 10.1002/smll.201903761
https://onlinelibrary.wiley.com/doi/10.1002/smll.201903761
6. Nat. Rev. Cancer:腦瘤和腦轉移瘤中存在的血腦屏障和血瘤屏障
治療血源性癌癥的試劑要發揮作用,必須穿過血管壁并克服癌細胞周圍局部微環境的阻力才能到達更多的癌細胞中。而大腦的微環境則會嚴重阻礙藥物對原發性腦腫瘤和腦轉移瘤的治療效果。已有研究表明,血腦屏障(BBB)的細胞和分子成分是一種用于維持大腦內環境穩定的神經血管單元。而腫瘤會破壞血腦屏障的完整性,從而產生一種被稱為血瘤屏障(BTB)血管系統。
佐治亞理工學院Costas D. Arvanitis博士和哈佛大學醫學院Rakesh K. Jain院士合作,對治療腦瘤和腦部轉移瘤時存在的血腦屏障和血瘤屏障進行了綜述介紹;對血腦屏障及其對藥物遞送的影響、細胞類型對血腦屏障功能的影響以及血瘤屏障在疾病的發展和治療中的作用進行了討論;最后重點介紹了用于改善血腦屏障和藥物遞送的一些新型分子、細胞和生理學策略,并討論了它們對改進免疫檢查點抑制劑和工程化T細胞等傳統和新興治療方法的作用。
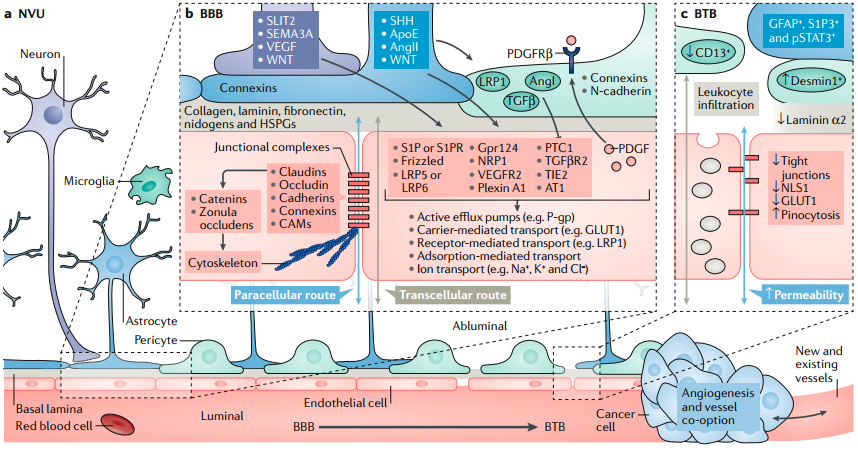
Costas D. Arvanitis, Rakesh K. Jain. et al. The blood–brain barrier and blood–tumour barrier in brain tumours and metastases. Nature Reviews Cancer. 2019
https://www.nature.com/articles/s41568-019-0205-x
7. Nature Mater.:弗林蛋白酶介導的奧沙拉嗪胞內自組裝用于增強腫瘤診療
通過合理的設計使得探針或藥物在和腫瘤特異性酶反應后不被泵出細胞,是目前增強造影劑或抗癌藥物在腫瘤內的保留效果的策略之一。有鑒于此,約翰霍普金斯大學醫學院Jeff W. M.Bulte團隊將抗癌藥物奧沙拉嗪 (Olsa)與細胞穿透肽RVRR相結合得到Olsa-RVRR,隨后利用一種在生物學上很容易發生的縮合反應,使得單個Olsa-RVRR分子可以在與腫瘤相關的弗林蛋白酶的介導下在細胞內自組裝成大的納米顆粒。
由于Olsa具有可交換的羥基質子,因此Olsa-RVRR和Olsa納米顆粒均可以實現化學交換飽和轉移(CEST)磁共振成像(MRI)。實驗使用HCT116和LoVo異種移植腫瘤小鼠模型進行體內研究,結果表明與沒有RVRR的傳統Olsa相比,結合有RVRR的Olsa在自組裝后的CEST信號和抗腫瘤治療效果分別增強了6.5倍和5.2倍,并且其成像信號和治療響應(即歸一化的腫瘤尺寸)之間也有著極好的線性相關 (R2 = 0.97)。綜上所述,這一研究所開發的以弗林蛋白酶為靶點的磁共振成像平臺具有對腫瘤的侵襲、藥物的積累和治療的響應進行有效評估的良好應用潛力。
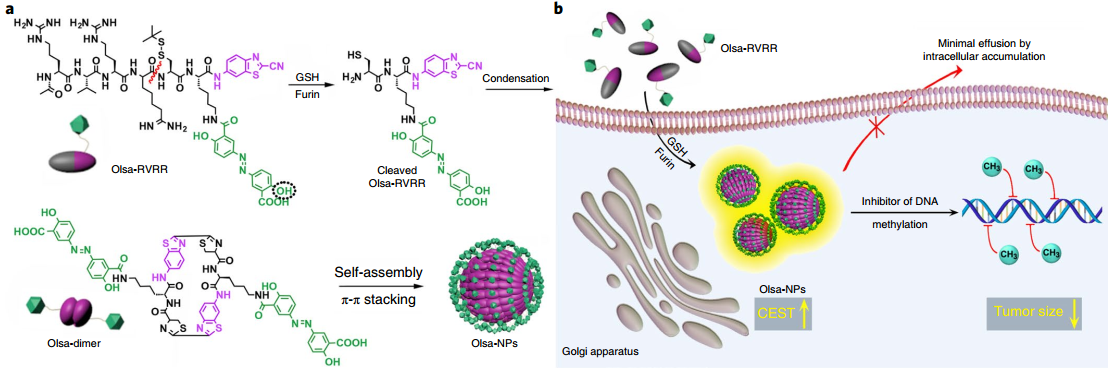
Yue Yuan, Jeff W. M. Bulte. et al. Furin-mediated intracellular self-assembly of olsalazine nanoparticles for enhanced magnetic resonance imaging and tumour therapy. Nature Materials. 2019
https://www.nature.com/articles/s41563-019-0503-4
8. Angew:可激活的NIR II納米探針用于對外傷性腦損傷進行體內早期實時診斷
外傷性腦損傷(TBI)是一種具有高致殘率和高致死率的急性疾病,并且目前的方法很難在早期對其進行有效診斷,也無法對其病理過程的進行有效的實時反饋。廈門大學李子婧博士和中科院蘇州納米所王強斌研究員合作制備了一種用于對TBI進行體內NIR II光學成像的靶向可激活熒光納米探針(V&A@Ag2S)。由于從Ag2S和A1094發色團之間發生了能量轉移,V&A@Ag2S的熒光在最開始是關閉的狀態。
在被靜脈注射后,V&A@Ag2S會通過血管細胞粘附分子1(VCAM1)介導的內吞作用在TBI炎癥血管內皮迅速地積聚,隨后通過TB I的前體生物標記物過氧亞硝酸鹽(ONOO)對A1094進行漂白,使得Ag2S量子點(QDs)的NIR II熒光得以快速恢復。實驗結果表明,該納米探針通過利用NIR-II熒光成像的深組織穿透性和高信噪比以及對ONOO的高特異性、快速響應能力,為實現TBI的體內早期實時診斷提供了一種新的方法。
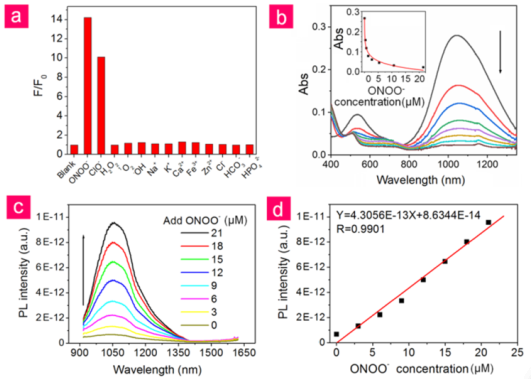
Chunyan Li, Wanfei Li, Zijing Li, Qiangbin Wang. et al. An Activatable NIR-II Nanoprobe for In Vivo Early Real-Time Diagnosis of Traumatic Brain Injury. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201911803
https://onlinelibrary.wiley.com/doi/10.1002/anie.201911803
9. Chem. Sci.:光致變色上轉換納米結構用于生物成像和雙光控生成單線態氧
對單態氧(1O2)的生成進行精確控制是生物學和精準醫學領域的研究熱點。中科院國家納米科學中心李樂樂研究員和趙宇亮院士合作,通過對包覆有介孔硅的上轉換納米顆粒(UCNP)進行控制合成構建了一種納米結構,同時在其硅壁上共價嵌入了卟啉光敏劑(PSs),并將對NIR (808 nm)響應的二芳基乙基烯(DAE)光致變色開關負載到納米孔中,因此它可以被雙近紅外光控制并產生1O2。
在980 nm NIR光照射下,內核的UCNP會吸收低能量的光子并將能量傳遞給硅壁上的PSs從而高效生成1O2。與此同時,當在納米孔中的DAE處于閉環狀態時,1O2的生成會被抑制,而當其受到808 NIR光照射后則會變成開環狀態,從而使得該納米結構生成1O2生成能力得以完全恢復。

Yongsheng Mi, Yuliang Zhao, Lele Li. et al. Photochromic upconversion nanoarchitecture: towards activatable bioimaging and dual NIR light-programmed singlet oxygen generation. Chemical Science. 2019
DOI:10.1039/C9SC03524A
https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc03524a#!divAbstract
10. AM:低劑量x射線激發凹面納米立方體產生持久發光用于對肝臟腫瘤的成像
摻雜有鉻的沒食子酸鋅ZnGa2O4:Cr3+ (ZGC)是一種能夠持久發光(LLL)熒光材料,可以在體內成像檢測中避免組織自身熒光干擾。ZGC在聚集態下是立方尖晶石結構,但納米ZGC往往則是球形而非立方形,并且要在納米尺度上使得ZGC保持良好的立方結構也是一個不小的難題。
國家同步輻射研究中心Hwo-Shuenn Sheu博士、高雄長庚紀念醫院Chia-Hao Su博士和國立成功大學Chen-Sheng Yeh教授合作制備了具有良好分散性的凹面立方ZGC,與無法被低劑量(0.5 Gy)x射線激發的聚集態ZGC相比,立方ZGC在紫外和x射線激發下都表現出更強的LLL性能。并且該立方ZGC會在肝臟中發生特異性積累,并對原位肝腫瘤具有很好的被動靶向性,因此在被x射線激發結束后使用0.5 Gy的劑量就足以產生持久發光來對肝臟深部腫瘤進行成像。

Zheng-Zhe Chen, Chia-Hao Su, Hwo-Shuenn Sheu, Chen-Sheng Yeh. et al. Low Dose of X-Ray-Excited Long-Lasting Luminescent Concave Nanocubes in Highly Passive Targeting Deep-Seated Hepatic Tumors. Advanced Materials. 2019
DOI: 10.1002/adma.201905087
https://onlinelibrary.wiley.com/doi/10.1002/adma.201905087
11. ACS Nano:外滲的中性粒細胞會打開血管屏障并改善脂質體的藥物遞送效果
脂質體是在腫瘤治療中應用最廣泛的一種納米載體。然而,盡管這些載體相對于游離的藥物來說具有一定的優勢,但其藥物傳遞效率和靶向性仍有待進一步提高。俄羅斯國立科技大學Victor A. Naumenko團隊使用活體熒光顯微鏡來對熒光脂質體在移植瘤模型(小鼠乳腺癌4T1、黑色素瘤B16和人類前列腺癌22Rv1模型)和正常皮膚中的行為進行研究并確定了兩種主要的藥物外滲模式:(1)微滲漏是一種在血管周圍發生的局部納米顆粒沉積的情況,它在惡性和健康組織中都會存在;(2)而宏滲漏則會深入組織并主要位于腫瘤-宿主界面。
雖然中性粒細胞沒有攝取脂質體,但它們的外滲卻會引發微滲漏和宏滲漏。研究結果發現,在接近中性粒細胞的地方往往更容易發現滲漏點,并且在研究的腫瘤類型中,中性粒細胞的數目也與滲漏的頻率相關。這一研究表明,影響脂質體的外滲途徑有望改善現有的治療策略并為開發有效的腫瘤治療納米藥物提供幫助。
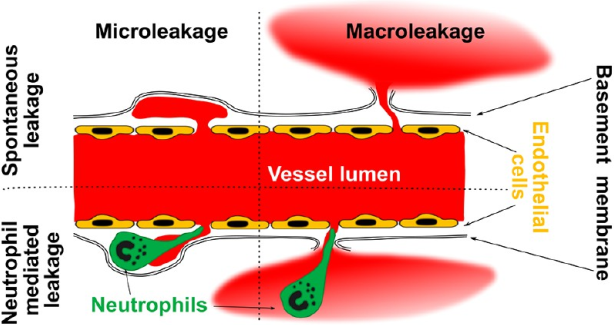
Victor A. Naumenko, Kseniya Yu. Vlasova. et al. Extravasating Neutrophils Open Vascular Barrier and Improve Liposomes Delivery to Tumors. ACS Nano. 2019
DOI: 10.1021/acsnano.9b03848
https://pubs.acs.org/doi/10.1021/acsnano.9b03848
12. ACS Nano:NIR II光照激發材料生成的熱和自由基用于增強腫瘤治療
腫瘤細胞的代謝和腫瘤血管的增殖與正常細胞不同,由此產生的腫瘤微環境往往是乏氧的狀態,這也極大限制了氧自由基的產生以及光動力治療的療效。中科院長春應化所林君研究員、哈爾濱工程大學馮莉莉博士和楊飄萍教授合作開發了一種不依賴氧的自由基生成納米系統(CuFeSe2-AIPH@BSA),它在NIR I和NIR II區具有雙峰吸收,因此可以用于進行成像指導的腫瘤協同治療。
得益于這種特殊的吸收模式,該納米系統在NIR I和NIR II區都有著很高的光熱轉換效率,因此其在近紅外光照射下所產生的熱量可使得AIPH釋放并分解生成氧自由基,進而有效地殺死癌細胞。對比研究的結果表明,NIR II光相較于NIR I光來說有著更好的療效,這主要是由于其具有更深的組織穿透和更高的安全劑量。體內研究表明,在腫瘤缺氧微環境中,利用NIR-II激光照射所產生的光熱效應和毒性自由基可以很好地誘導癌細胞發生凋亡,進而抑制腫瘤的生長。
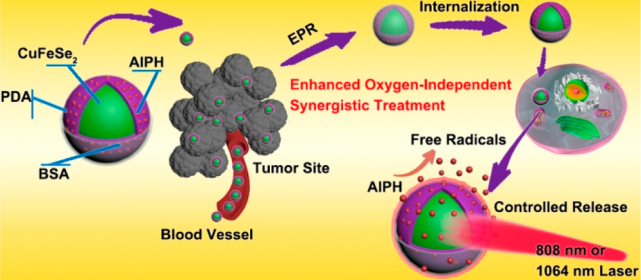
Jun Yang, Rui Xie, Piaoping Yang, Jun Lin. et al. Hyperthermia and Controllable Free Radical Coenhanced Synergistic Therapy in Hypoxia Enabled by Near-Infrared-II Light Irradiation. ACS Nano. 2019
DOI: 10.1021/acsnano.9b05985
https://pubs.acs.org/doi/10.1021/acsnano.9b05985
13. Nano Lett.:可聚集的納米顆粒結合抗PD-L1抗體用于改善膠質瘤治療
由于化療藥物在膠質瘤中的積累效率有限,且其自身存在多種生存機制如自噬和程序性細胞死亡配體1 (PD-L1)表達的上調等,因此通過靶向化療對膠質瘤進行治療的效果一直差強人意。四川大學高會樂教授團隊提出了一種基于功能化金納米顆粒(AuNPs)的、可以將化療、自噬抑制和阻斷PD-L1免疫檢查點治療相聯合的治療方案。實驗設計了一種對豆莢蛋白響應的AuNPs (D&H-AA&C),它可以被動地靶向到膠質瘤部位,并在豆莢蛋白的作用下形成原位聚集物,進而增強DOX和HCQ在膠質瘤部位的積累。
HCQ可以抑制DOX誘導的細胞保護自噬,使膠質瘤細胞對DOX變得更加敏感。并且,抑制自噬也能抑制膠質瘤干細胞形成自噬相關的血管生成擬態(VM)。體內研究表明,D&H-A-A&C具有良好的抗膠質瘤作用,而通過和抗PD-L1抗體進行協同治療后也能夠逆轉免疫抑制的腫瘤微環境,從而實現免疫響應,這樣不僅可以進一步增強抗膠質瘤的效果,也能有效地預防腫瘤復發。綜上所述,這一研究工作也為開發更有效、更個性化的膠質瘤聯合治療方案提供了新的思路。
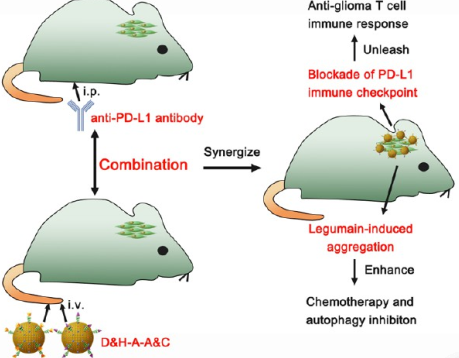
Shaobo Ruan, Huile Gao. et al. Aggregable Nanoparticles-Enabled Chemotherapy and Autophagy Inhibition Combined with Anti-PD-L1 Antibody for Improved Glioma Treatment. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b03968
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03968
14. AFM:Z型異質結功能化納米片用于調節腫瘤微環境和增強腫瘤治療作用
具有高電子-空穴分離效率和增強氧化還原電位的Z型異質結材料在光學診療領域有著很好的應用潛力。中山大學夏德華教授、梅林教授和姬曉元教授合作,在不同的溶液和空氣環境下制備了新型的FeS2內核和Fe2O3外殼的二維納米片(TOPY NSs)。TOPY NSs 的Fe2O3外殼和其內部的Fe3+/Fe2+均可通過消耗谷胱甘肽和產生O2來調節腫瘤微環境,并通過類芬頓反應產生·OH。
同時,FeS2內核和Fe2O3外殼也構成了一種Z型異質結,Fe2O3導帶(CB)中的電子與FeS2價帶(VB)中的空穴會發生重組,因而FeS2的CB和Fe2O3 的VB會具有更強的氧化還原電位。在650 nm激光照射下,O2和OH-會分別在FeS2的CB和Fe2O3的VB上生成·O2和·OH;而在808 nm激光照射下,NSs也可產生熱量來用于進行光熱治療。并且該NSs也具有熒光、光聲和光熱成像等性能,因此是一種很好的多模態成像指導的癌癥治療平臺。
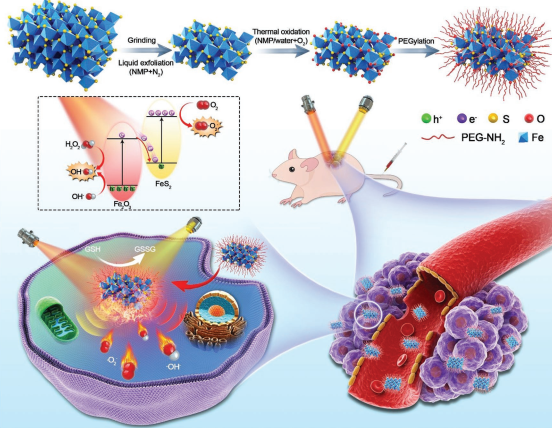
Chao Pan, Dehua Xia, Lin Mei, Xiaoyuan Ji. et al. Z-Scheme Heterojunction Functionalized Pyrite Nanosheets for Modulating Tumor Microenvironment and Strengthening Photo/Chemodynamic Therapeutic Effects. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201906466
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201906466
15. ACS Nano:聚合物脂質納米顆粒利用淋巴結放大效應增強腸道和全身免疫反應
由于淋巴細胞會被局限于啟動組織,因此腸外接種的疫苗無法同時激發產生有效的全身和胃腸道免疫保護效應。江南大學高曉東教授、中科院過程工程研究所吳頡研究員和馬光輝研究員合作利用聚合物脂質納米顆粒(PLNPs)去協同遞送atRA、CpG和抗原,這樣可以利用引流淋巴結(DLNs)的放大功能來實現腸道歸巢并激活免疫。PLNPs在被肌肉注射后會在注射處形成一個免疫增強的環境,而其誘導啟動的樹突狀細胞(DCs)會被指定轉移到DLNs中。
DLNs的免疫增強環境可以顯著增強免疫細胞間抗原的遞呈和歸巢受體的轉換,同時刺激活化的淋巴細胞在周圍組織和胃腸道組織內發生優先耗散。與目前含atRA的制劑相比,PLNPs不僅可以促進外周組織中IgG的分泌和T細胞的活化,而且在卵清蛋白和EV71疫苗接種實驗中也能增強胃腸道中T細胞的歸巢和抗原特異性IgA的水平。這一研究表明,利用DLN的放大效應可以刺激產生全身和胃腸道響應,從而進行更加有效的腸道疫苗接種。
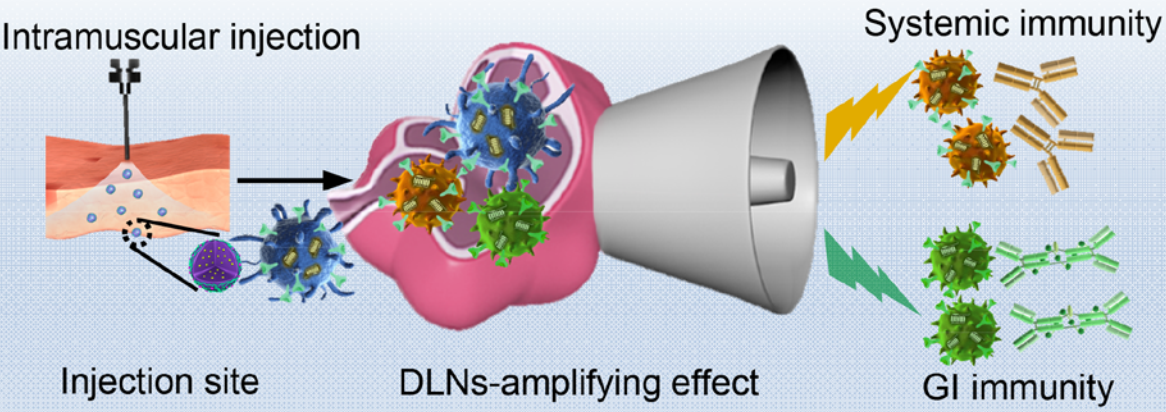
Yiqun Du, Yufei Xia, Jie Wu, Xiao-Dong Gao, Guanghui Ma. et al. Exploiting the Lymph-Node-Amplifying Effect for Potent Systemic and Gastrointestinal Immune Responses via Polymer/Lipid Nanoparticles. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04071
https://pubs.acs.org/doi/10.1021/acsnano.9b04071
16. Chem. Sci.:利用拉曼對光熱治療誘導細胞凋亡的分子信號通路進行觀察
等離激元納米顆粒(NP)介導的光熱治療(PPTT)是一種很好的微創癌癥治療方法,目前也已經發展到臨床試驗的早期階段。而了解PPTT的細胞和分子響應對提高其治療效果和臨床應用進展至關重要。南京大學朱俊杰教授、南京師范大學吳萍教授和蔡稱心教授合作,將核靶向的金納米星(Au NSs)作為光熱試劑去特異性誘導癌細胞發生凋亡;同時Au NSs也可作為表面增強拉曼光譜(SERS)的探針,對凋亡MCF-7細胞的時變SERS光譜進行監測。
實驗利用這一策略,對PPTT誘導凋亡的分子信號通路進行了研究,包括細胞色素c的釋放,蛋白質降解和DNA碎裂等。研究結果表明,PPTT誘導的細胞凋亡會經歷一個線粒體介導的凋亡通路,而這一通路也被進一步證實是由僅含BH3區域的蛋白BID啟動的。這一研究不僅有助于提高對PPTT誘導細胞凋亡的分子機制的基礎認識,也有助于改善對PPTT的調控以進一步推動其臨床應用。
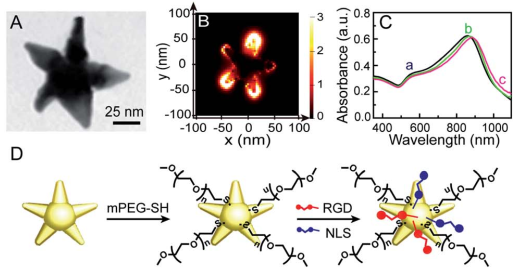
Yingfang Xing, Ping Wu, Chenxin Cai, Jun-Jie Zhu. et al. Raman observation of a molecular signaling pathway of apoptotic cells induced by photothermal therapy. Chemical Science. 2019
DOI:10.1039/C9SC04389F
https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc04389f#!divAbstract
17. Nano Lett.:生物礦化溶瘤病毒用于雙模態成像指導的腫瘤治療
溶瘤腺病毒(OA)可以在腫瘤細胞中發生特異性復制,因此是一種很好的用于臨床抗癌治療的病毒。北京理工大學謝海燕教授團隊創新性地利用鈣錳碳酸鹽 (MnCaCs)生物礦化層中對OA進行包裹,這樣可以使得OA病毒不會被對宿主免疫系統清除,并延長其在體內的循環時間。
并且MnCaCs在腫瘤部位積累后會在酸性的微環境下溶解并釋放出Mn2+,進而可將內源性的H2O2分解產生氧氣(O2),從而增強OA的復制能力并顯著提高其抗腫瘤療效。同時,該材料也具有磁共振成像(MRI)和光聲成像(PAI)的性能,可以在治療過程中提供實時監測的信息。
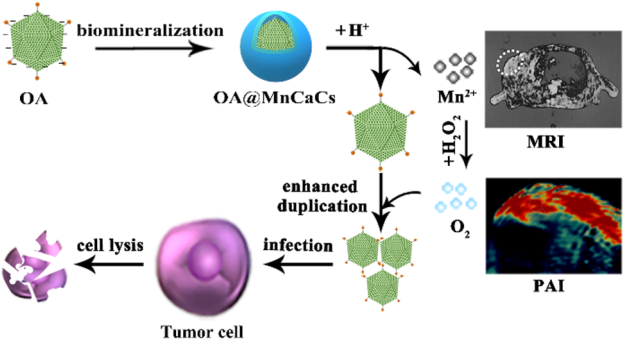
Li-Li Huang, Hai-Yan Xie. et al. MnCaCs-Biomineralized Oncolytic Virus for Bimodal ImagingGuided and Synergistically Enhanced Anticancer Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b03193
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03193
18. ACS Nano:NIR II分子靶向納米探針用于免疫細胞的體內雙色共聚焦成像
對體內的免疫細胞進行特異性監測可以有效地提高免疫治療效果。武漢理工大學張明曦教授、武漢大學孫志軍教授和崔然博士合作利用基于量子點(QD)的NIR II納米探針來對免疫細胞(骨髓衍生抑制細胞(MDSC))進行體內雙色熒光分子成像。
實驗將NIR-IIa和NIR-IIb QDs分別與兩種MDSC的特異性抗體進行結合,進而可以共靶向體內的MDSCs。由于NIR II光具有被抑制的光子散射和弱的自發熒光,因此通過該納米探針進行雙色熒光共聚焦成像可以對MDSCs在不同器官和組織中的分布進行研究。高分辨率成像實驗結果則進一步對MDSCs在腫瘤免疫微環境中的確切分布進行了。這一研究的結果表明,具有分子靶向能力的NIR-II熒光納米探針可以為實時監測體內免疫細胞群的動態變化提供有力的幫助,進而也為指導臨床用藥的選擇和療效評價提供了新的方法。
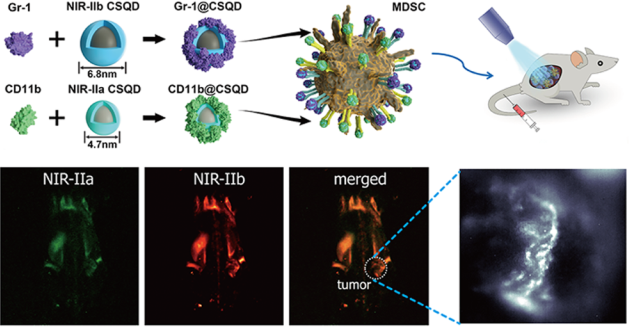
Guang-Tao Yu, Meng-Yao Luo, Zhi-Jun Sun, Ran Cui, Mingxi Zhang. et al. Molecular Targeting Nanoprobes with NonOverlap Emission in the Second Near-Infrared Window for in Vivo Two-Color Colocalization of Immune Cells. ACS Nano. 2019
DOI: 10.1021/acsnano.9b05038
https://pubs.acs.org/doi/10.1021/acsnano.9b05038
19. ACS Nano:共遞送蜂毒肽和光敏劑的納米載體用于光動力-免疫聯合治療
光動力治療(PDT)是一種通過誘導產生活性氧(ROS)來治療癌癥的方式,并且ROS也會引發免疫原性細胞死亡(ICD)。為了同時提高PDT介導的細胞內ROS生成和ICD水平,湖北大學徐祖順教授、華中科技大學金紅林博士和楊坤禹教授合作設計了一種血清白蛋白(SA)包裹的勃姆石(B)納米載體,并利用其負載光敏劑Ce6 (Ce6)和蜂毒肽(MLT)。Ce6/MLT@SAB的粒徑約為180 nm,相對于游離的MLT來說,Ce6/MLT@SAB可顯著降低溶血現象,同時也能在體外實現MLT增強的PDT抗腫瘤效果。
與Ce6@SAB相比,Ce6/ MLT@SAB可以改善Ce6對癌細胞的穿透,從而在660 nm光照下增強細胞內ROS的生成。并且經光照后,被Ce6/MLT@SAB處理的細胞的ICD水平會有顯著提高,同時也能有效激活樹突狀細胞。體內研究表明,在沒有激光照射的情況下,與對照組相比,多次注射Ce6/MLT@SAB可使皮下小鼠腫瘤的生長被有效地抑制。當聯合激光照射后,單次注射Ce6/MLT@SAB即可根除三分之一的小鼠皮下腫瘤。而若進一步聯合免疫檢查點阻斷劑則能更好地增強其抗腫瘤作用,提高在腫瘤中產生的CD4+和CD8+ T細胞數量,同時減少骨髓衍生抑制細胞。
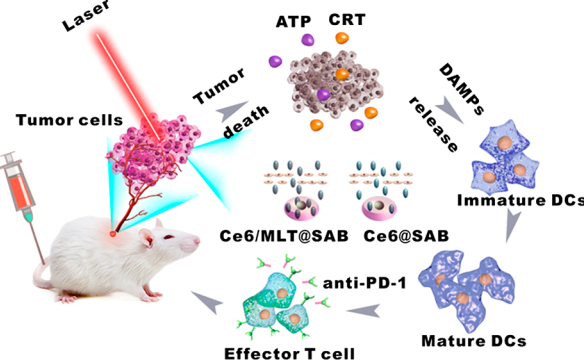
Haojie Liu, Yan Hu, Zushun Xu, Honglin Jin, Kunyu Yang. et al. Co-delivery of Bee Venom Melittin and a Photosensitizer with an Organic?Inorganic
Hybrid Nanocarrier for Photodynamic Therapy and Immunotherapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04181
https://pubs.acs.org/doi/10.1021/acsnano.9b04181
20. Angew:MOF介導的光動力治療和CpG遞送以增強抗原遞呈和癌癥免疫治療
檢查點阻斷免疫治療(CBI)可以喚醒宿主固有的免疫系統,通過重新激活細胞毒性T細胞來引起癌癥患者的持續性響應。芝加哥大學林文斌教授團隊制備了一種陽離子納米MOF材料W-TBP,它可以通過進行免疫原性光動力治療(PDT)和促進樹突狀細胞(DCs)的成熟來促進腫瘤抗原的表達。由雙核的WVI二級構建單元和光敏劑卟啉(TBP)配體組成的陽離子W-TBP可以通過介導PDT來釋放腫瘤相關抗原,并向DCs遞送免疫刺激的CpG寡脫氧核苷酸。
研究結果表明,通過增強抗原呈遞與CBI的協同作用可以使細胞毒性T細胞恢復活力并擴散,從而在雙側乳腺癌模型中實現極好的抗癌效果,可以有效地治愈(>97%)腫瘤。
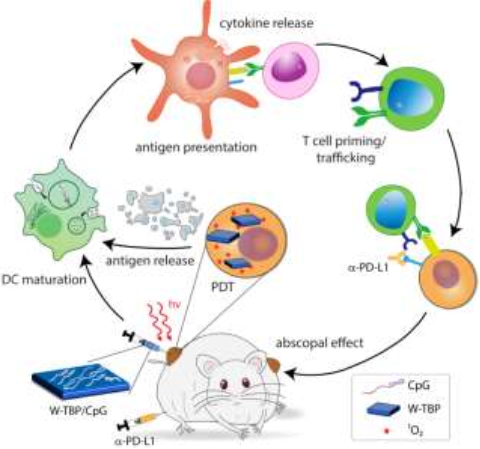
Kaiyuan Ni, Wenbin Lin. et al. Nanoscale Metal-organic Frameworks Mediate Photodynamic Therapy and Deliver CpG Oligodeoxynucleotides to Enhance Antigen Presentation and Cancer Immunotherapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201911429
https://onlinelibrary.wiley.com/doi/10.1002/anie.201911429
21. Adv. Sci.綜述:胞外囊泡在腫瘤免疫微環境和腫瘤免疫治療中的作用
幾乎所有的細胞都可以分泌胞外囊泡(EVs)。EVs可以將母體細胞的蛋白質、脂質和核酸遞送給受體細胞,因此EVs也起著細胞間通訊和分子轉移的中介作用。外泌體是EVs的一個小亞群,它會參與多種生理和病理過程,并且在腫瘤發生和轉移前就會參與腫瘤免疫微環境的重建。同時,來自腫瘤細胞和宿主細胞的外泌體也會介導參與它們的相互作用過程,從而影響癌癥治療的響應性。而源于腫瘤的循環外泌體也被認為是早期診斷腫瘤的一種非侵入性的生物標志物。
基于外泌體的腫瘤治療也正逐漸發展成為一種很有前途的新型策略,可用于抑制腫瘤發展或者增強抗腫瘤免疫。蘇州大學周芳芳教授團隊綜述了外泌體及其在調節免疫響應中的關鍵作用和的治療應用;同時也指出了當前研究的一些局限性并對未來的研究方向進行了展望。
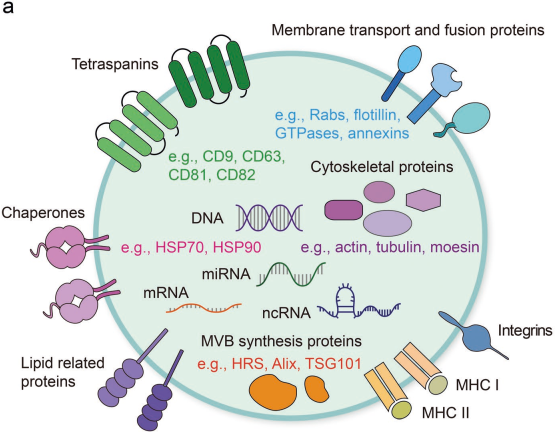
Feng Xie, Fangfang Zhou. et al. Extracellular Vesicles in Cancer Immune Microenvironment and Cancer Immunotherapy. Advanced Science. 2019
DOI: 10.1002/advs.201901779
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201901779
22. AFM:將細菌-光熱治療和抗PD -1肽結合以增強晚期癌癥的免疫治療
光熱治療(PTT)是一種很有前途的癌癥治療方法,但迄今為止它只能在相對較小的皮下腫瘤模型上才能成功,而治療較大的腫瘤(200 mm3)則較為困難,這是因為大多數的PTT試劑都無法有效地到達腫瘤中心。并且免疫抑制的腫瘤微環境也會阻止T細胞去對抗殘余的腫瘤細胞,從而導致腫瘤的復發和轉移。四川大學孫遜教授團隊將廣泛使用的PTT材料聚多巴胺包覆在兼性厭氧菌VNP20009的表面,使其可以深入到更大的腫瘤中。
實驗將包被的細菌進行靜脈注射并隨后在腫瘤部位進行近紅外激光照射,同時局部接種含有抗程序化細胞死亡-1(PD -1)肽AUNP-12的磷脂相分離凝膠。該凝膠可以持續釋放AUNP-12(42天)以逆轉免疫抑制的腫瘤微環境。實驗使用小鼠黑素瘤模型證明了這種將生物療法、PTT和可持續的PD-1封鎖相結合的聯合治療可以在80天內對50%的動物產生強大的抗腫瘤免疫響應并有效治愈相對較大的腫瘤。
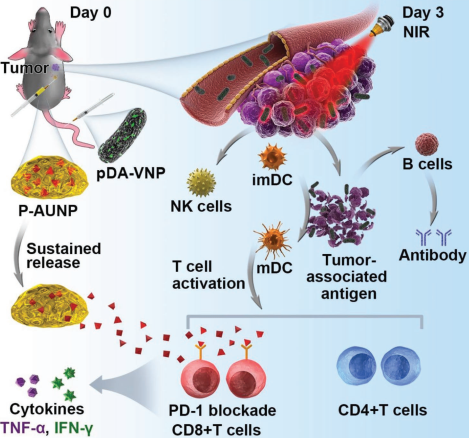
Wenfei Chen, Xun Sun. et al. Combination of Bacterial-Photothermal Therapy with an Anti-PD-1 Peptide Depot for Enhanced Immunity against
Advanced Cancer. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201906623











