
第一作者:田龍龍
通訊作者:劉莊
通訊單位:蘇州大學
研究亮點:
1. 用簡單混合方式制備由Zn2+和無螯合劑放射性標記的臨床藥物構建的2D納米片。
2. 利用原位Cerenkov發光觸發NO釋放。
3. 調節腫瘤微環境以增強放射性同位素-免疫療法,抑制腫瘤轉移。
研究背景:
放射療法(RT),包括局部束放射療法和放射性同位素療法,通常用于治療局部腫瘤。正如在臨床前動物實驗和臨床實踐中所觀察到的,放療能夠觸發一定水平的免疫介導的抗腫瘤作用,通過免疫療法可以進一步增強遠距離轉移性腫瘤治療的特殊異位效應。RT與免疫檢查點封鎖(ICB)療法的結合已在臨床中得到廣泛試驗。這種RT-ICB聯合療法的最終目標是在局部腫瘤的放射治療后達到全身性治療反應,以抑制轉移性腫瘤。
盡管RT-ICB聯合療法具有非常大的前景,但是RT和ICB療法的療效與腫瘤微環境(TME)密切相關。TME的特征是缺氧和酸性pH。由于氧是增強放射線誘導的DNA損傷的必要分子,因此低氧TME是導致腫瘤對RT產生抵抗力的重要原因。另一方面,已經發現缺氧和酸性的TME會導致實體瘤內的免疫抑制。因此,為了提高RT和免疫療法的療效,調節TME不僅克服與低氧有關的放射療法的抵抗力,而且保持免疫抑制性TME。
在多種TME調節方式中,使用一氧化氮(NO)是一種有效且獨特的方法。高濃度的NO將通過減輕腫瘤缺氧和抑制缺氧誘導因子α(HIF-α)的表達來調節TME,而成為一種殺死腫瘤的分子和放射增敏劑。此外,NO也被認為是一種免疫調節分子。然而,大多數光響應性NO供體會受到外部光(尤其是短波長光)的激發,但組織穿透力有限,從而阻礙了其進一步的臨床應用。
成果簡介:
有鑒于此,蘇州大學劉莊課題組將抗高血壓藥物硝普鈉(Na2Fe(CN)5NO)作為NO供體與Zn2+混合,通過微乳化方法構建了厚度小于1nm的二維納米片(ZnNO納米片)。然后,通過與32PO43-陰離子簡單混合,得到ZnNO(32P)納米片。具有β射線發射的32P有效地活化了水以生成強烈的切倫科夫發光(CL),隨后刺激納米片釋放持久性NO。NO的釋放不僅通過抑制HIF-1-α表達并緩解腫瘤缺氧來增強放射性同位素治療的療效,而且還調節免疫抑制TME以利于抗腫瘤免疫。因此,該研究開發了一種獨特類型的生物相容性2D納米片,可通過調節不利的TME進行增強的RT-ICB聯合治療。
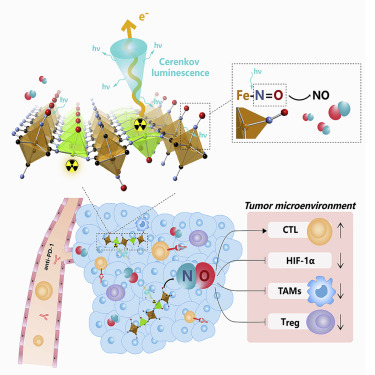
圖1. DPIP用于癌癥治療的合成途徑和方案示意圖
要點1:簡單方法制備ZnNO納米片
ZnNO納米片是通過微乳化方法制備的,只需將Zn2+離子與硝普鈉簡單混合即可。制成的納米片在水和生理緩沖液中顯示出極大的溶解性,無需進一步的表面修飾。TEM和AFM結果表明,成功制備得到 1 nm厚度二維納米片。
通過比較納米球、納米立方體和納米片三種ZnNO結構,結果只有片狀能在紫外線照射下持續釋放NO。原因可能是ZnNO納米片中的亞硝基存在于其表面,因此很容易被激活。因此,Na2Fe(CN)5NO單層納米片的光響應NO釋放行為歸因于納米片的獨特2D結構。
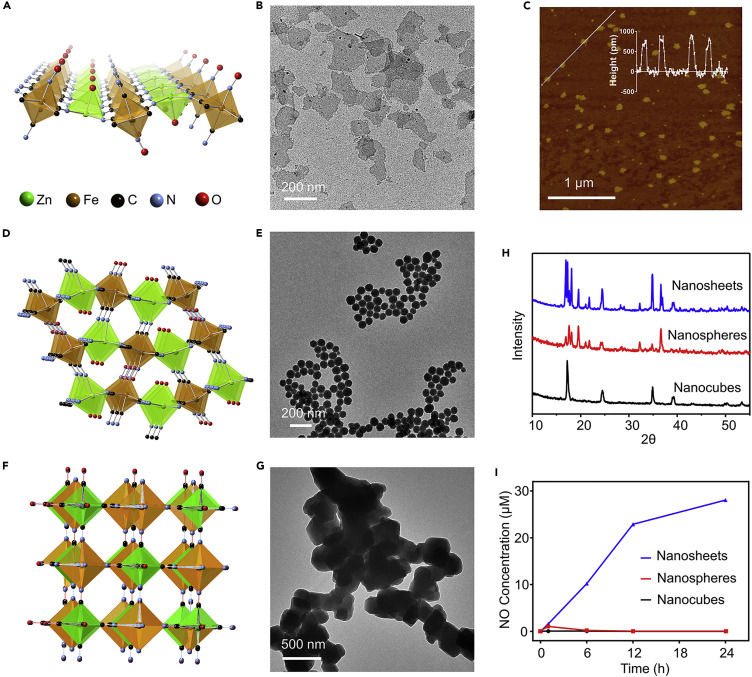
圖2. 材料表征
要點2:納米片的放射性標記和CL觸發的NO釋放
通過無螯合劑將放射性同位素直接附著到納米顆粒上已被認為是一種更方便,更可靠的方法。研究人員通過在50℃混合1 h,可以輕易地用32PO43-形式將ZnNO納米片標記上治療性放射性核素32P,實現90%以上的標記產率。通過檢測CL刺激產生NO,研究發現ZnNO(32P)樣品中的NO濃度在72小時后甚至更高,這表明在很長一段時間內由CL釋放觸發的ZnNO(32P)會持續不斷的NO釋放。
接下來,研究人員研究了釋放NO的ZnNO(32P)納米片的體外細胞毒性。用MTT法測定體外細胞毒性,實驗表明ZnNO納米片可以大大提高放射性同位素32P殺傷細胞的能力。通過測試了細胞培養上清液中的NO濃度。結果顯示ZnNO(32P)組中的NO濃度遠高于其他組,這表明CL誘導ZnNO(32P)納米片釋放NO是導致放射性同位素32P大大提高治療效果的原因之一。
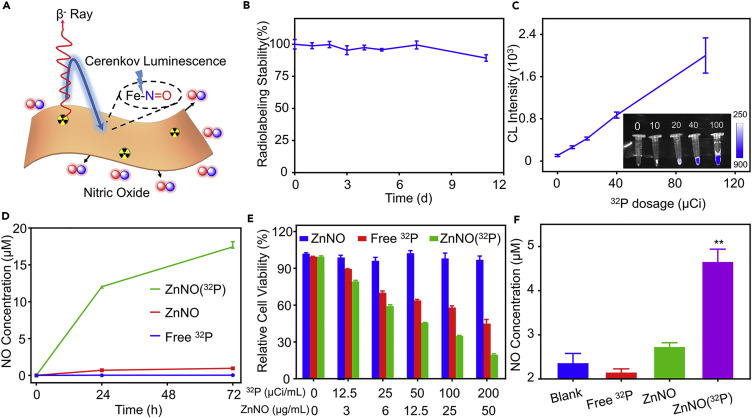
圖3. CL刺激ZnNO(32P)納米片的NO釋放
要點3. 體內NO增強放射性同位素治療
在局部注射后追蹤放射性同位素的分布,監測游離放射性同位素擴散到其他正常器官。體內實驗結果顯示,ZnNO(32P)能長期的在腫瘤積累,而沒有明顯滲入正常器官。研究人員繼續研究其體內治療功效,在單次注射ZnNO(32P)納米片后發現該組完全破壞了這些腫瘤,并且所有腫瘤在約24天內完全消退了,且治療后長達72天均未見復發。H&E染色進一步證實了ZnNO(32P)處理對腫瘤細胞造成了最大的損害。

圖4. 體內NO增強放射性同位素治療
要點4:可調節腫瘤微環境
為了證明體內NO的釋放,研究人員使用針對硝基酪氨酸的抗體和抗HIF-1α抗體對腫瘤切片進行了免疫熒光染色。如預期的那樣,與所有其他組相比,ZnNO(32P)組在腫瘤內有效的NO釋放和有效抑制HIF-1α的表達。
通過對各種治療后腫瘤中CD8陽性細胞毒性T淋巴細胞(CTL)的進行了測試。結果表明CL觸發的NO釋放將顯著增強T細胞向RT治療的腫瘤中的浸潤。同時,通過繼續檢測調節性T細胞,結果證明32P CL刺激的ZnNO(32P)釋放NO確實在免疫調節中起關鍵作用。
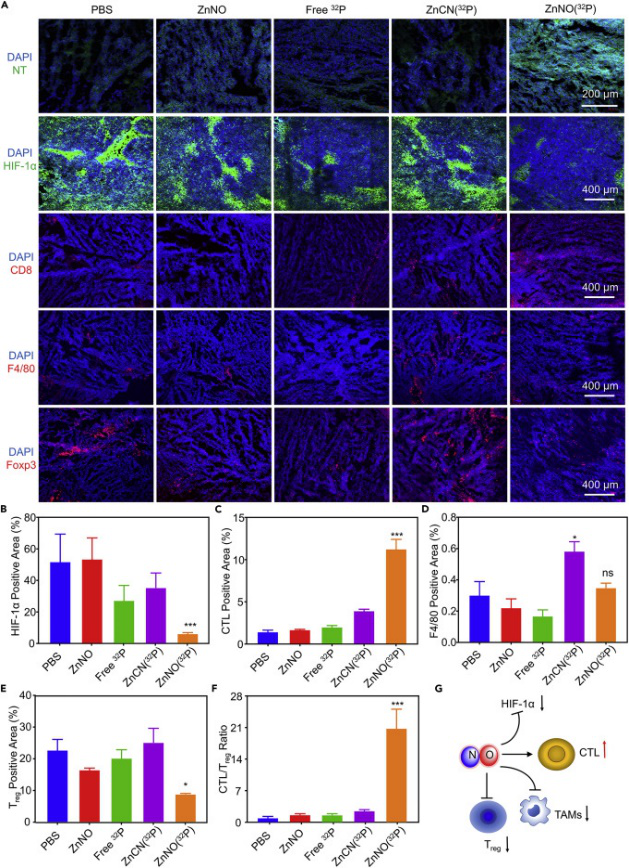
圖5. 體內抗腫瘤作用
要點5:增強RT-ICB治療
考慮到上述發現的ZnNO(32P)在TME調節中的能力,研究人員通過將ZnNO(32P)的局部治療與全身施用的抗PD-1抗體ICB治療相結合來進行RT-ICB治療,以治療局部和遠端腫瘤。結果顯示ZnNO(32P)聯合anti-PD-1組的局部和遠處腫瘤均被完全破壞,并且在70天內未觀察到復發。研究結果表明,將ZnNO(32P)的 RT治療與抗PD-1的ICB治療相結合可激發強效的抗腫瘤免疫反應,以攻擊鄰近的腫瘤,有望抑制轉移。
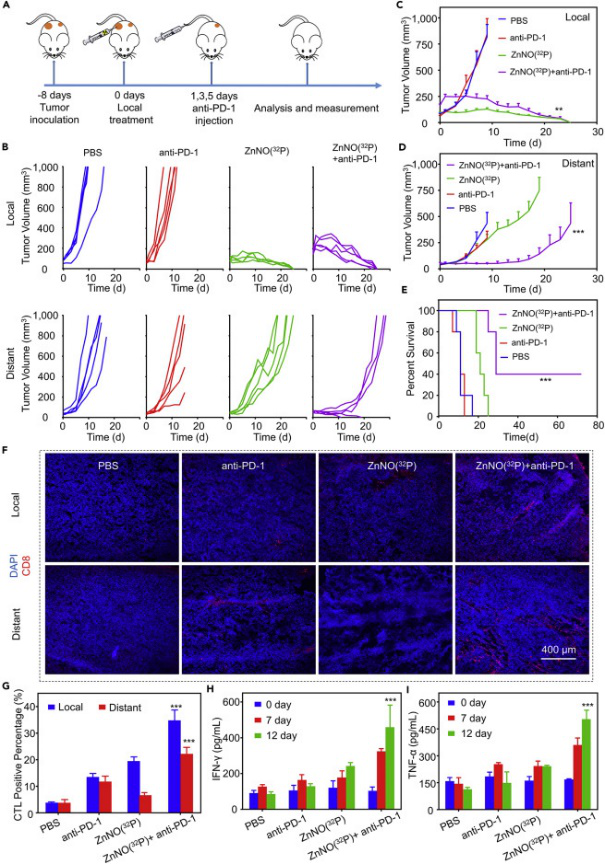
圖6. RT-ICB治療
小結:
綜上所述,本文介紹的僅包含Zn2+與臨床藥物結合的2D納米醫學平臺在增強局部RT和RT聯合免疫療法方面都顯示出巨大的潛力,可轉化為臨床使用。
參考文獻:
Longlong Tian, Yaxing Wang, Lele Sun, Jun Xu, Yu Chao, Kai Yang, Shuao Wang, Zhuang Liu, Cerenkov Luminescence-Induced NO Release from 32P-Labeled ZnFe(CN)5NO Nanosheets to Enhance Radioisotope-Immunotherapy. Matter 2019, 1 (4), 1061 - 1076.
https://doi.org/10.1016/j.matt.2019.07.007











