
第一作者:Lawrence P. Andrews,
通訊作者:Dario A. A. Vignali
通訊單位:匹茲堡大學(xué)醫(yī)學(xué)院
核心內(nèi)容:
1. 總結(jié)了“第二代”靶向抑制受體(LAG-3,TIM-3和TIGIT)和B7家族的配體(B7-H3,B7-H4和B7-H5)在臨床免疫治療中的現(xiàn)狀。
2. 闡述了抑制受體和配體的產(chǎn)生和靶向機(jī)理。
3. 提出目前抑制受體和配體在臨床免疫治療中存在的機(jī)理性問題。
研究背景:
抑制受體(IRs)的上調(diào),如CTLA-4(細(xì)胞毒性T淋巴細(xì)胞相關(guān)蛋白4)和PD-1(程序性細(xì)胞死亡蛋白1),代表著一種重要的細(xì)胞內(nèi)在機(jī)制,該機(jī)制可控制明顯的免疫反應(yīng)以維持免疫穩(wěn)態(tài)并預(yù)防自身免疫。然而,正如2018年獲得諾貝爾醫(yī)學(xué)獎的James Allison和Tasuku Honjo所承認(rèn)的那樣,使用檢查點機(jī)制來逃避抗腫瘤免疫反應(yīng)是癌癥的一個主要標(biāo)志。他們的基礎(chǔ)科學(xué)研究將這些IRs定性為免疫調(diào)節(jié)的主要機(jī)制,也是通過檢查點阻斷來恢復(fù)功能失調(diào)的抗腫瘤免疫的有效靶標(biāo)。
批準(zhǔn)用于臨床的首個突破性檢查點免疫療法是伊匹單抗(針對CTLA-4的單克隆抗體(mAb)),使得轉(zhuǎn)移性黑色素瘤顯著消退且長期存活率達(dá)21%。但是,在伊匹單抗治療的患者中觀察到了由治療誘導(dǎo)產(chǎn)生的免疫相關(guān)性毒副反應(yīng)(irAE)。而用納武單抗或派姆單抗靶向PD-1可以提高客觀應(yīng)答率(ORR),同時具有較低的irAEs。靶向PD-1配體PD-L1的免疫療法已經(jīng)實現(xiàn)了類似的持久臨床反應(yīng),尤其是在以PD-L1表達(dá)作為生物標(biāo)志物的患者中。
免疫療法有一定的作用,但只有一小部分患者(約10%-30%)表現(xiàn)出長期和持久的反應(yīng),而對于許多其他類型的腫瘤,例如胰腺癌,患者對免疫療法完全的耐藥性。一些患者可能對當(dāng)前的免疫治療方案產(chǎn)生適應(yīng)性耐藥,故可能適合一些的新型IRs和配體進(jìn)行進(jìn)一步的組合阻斷。因此,一波新的治療劑正在通過臨床試驗,且I-II早期研究的初步結(jié)果令人振奮。但是,這些新靶標(biāo)的生物學(xué)是復(fù)雜的,其中的機(jī)制尚未得到完全理解。
綜述簡介:
匹茲堡大學(xué)醫(yī)學(xué)院Dario A. A. Vignali主要綜述了在腫瘤浸潤性淋巴細(xì)胞(TILs)上表達(dá)的三種有前景的IRs的生物學(xué)特性:LAG-3(淋巴細(xì)胞激活基因3),TIM-3(T 淋巴細(xì)胞免疫球蛋白黏蛋白3)和TIGIT(T細(xì)胞免疫球蛋白和ITIM結(jié)構(gòu)域蛋白)。此外,也討論了靶向B7家族中檢查點配體的試劑,例如B7-H3,B7-H4和B7-H5(VISTA(T細(xì)胞激活抑制物免疫球蛋白可變區(qū)結(jié)構(gòu)域))。討論它們?nèi)绾巫鳛闈撛诘穆?lián)合治療靶點以克服現(xiàn)有的免疫治療方案中的耐藥性問題。
要點1:LAG-3的研究狀況
在刺激T細(xì)胞后,LAG-3被表達(dá)為防止明顯激活的檢查點。與其他IRs一樣,腫瘤微環(huán)境(TME)內(nèi)持續(xù)的抗原刺激導(dǎo)致LAG-3的持續(xù)表達(dá),并與功能失調(diào)的CD8+ TILs的衰竭程序有關(guān),例如嚴(yán)重減少的細(xì)胞因子產(chǎn)生和降低細(xì)胞溶解活性以及無法增殖。LAG-3在腫瘤內(nèi)T細(xì)胞和源自胸腺的調(diào)節(jié)性T細(xì)胞上都有表達(dá),目前研究在TME中T細(xì)胞上表達(dá)的LAG-3與許多配體相互作用,包括在APCs和腫瘤細(xì)胞上表達(dá)的MHC-II,在腫瘤細(xì)胞上表達(dá)的galectin-3和在腫瘤相關(guān)基質(zhì)細(xì)胞上表達(dá)的LSECtin。LAG-3還與腫瘤分泌的FGL-1相互作用。在臨床試驗中,針對這些LAG-3-配體相互作用的各種mAb和雙特異性抗體正在被研究。
LAG-3是作為癌癥免疫治療靶點進(jìn)行臨床研究的第三個IRs,盡管對LAG-3的拮抗性單克隆抗體在臨床試驗中進(jìn)展迅速,但與LAG-3生物學(xué)相關(guān)的許多重要問題仍未得到解答。如:目前設(shè)計免疫治療劑是否最佳,對不同的腫瘤浸潤亞群的影響,和PD-1協(xié)同作用的機(jī)制和LAG-3下游信號機(jī)制等問題還需要進(jìn)一步研究。
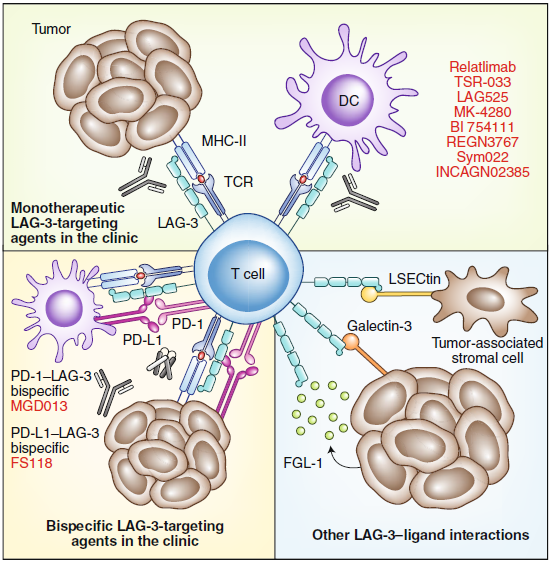
圖1. LAG-3–配體相互作用和當(dāng)前的臨床靶向策略
要點2:TIM-3
TIM-3是一種跨膜蛋白,最初在CD4+ TH1輔助T細(xì)胞和CD8+ Tc1細(xì)胞毒性T細(xì)胞上發(fā)現(xiàn),并在調(diào)節(jié)性T細(xì)胞亞群上組成性表達(dá)。TIM-3也可以由先天免疫細(xì)胞來表達(dá),例如DC,NK細(xì)胞,單核細(xì)胞和巨噬細(xì)胞。像LAG-3一樣,TIM-3已被認(rèn)定為可以同時控制抗病毒免疫力和抗腫瘤免疫力的IRs。它在功能高度失調(diào)的T細(xì)胞上表達(dá),并與多種癌癥的疾病預(yù)后不良相關(guān),包括黑色素瘤和非小細(xì)胞型肺癌。
與TIM-3相互作用的配體,目前研究的有腫瘤分泌的galectin-9和在腫瘤細(xì)胞或T細(xì)胞自身上表達(dá)的CEACAM-1。TIM-3也表達(dá)在腫瘤浸潤性DC細(xì)胞上,并且可以與凋亡細(xì)胞上的PtdSer結(jié)合或TME中釋放的HMGB1結(jié)合。相關(guān)mAb和雙特異性抗體正在進(jìn)行臨床試驗研究。
同樣的,由于TIM-3生物學(xué)的復(fù)雜性,仍然存在一些關(guān)鍵問題。如:TIM-3配體間相對貢獻(xiàn)度和重要性,對其下游信號的影響,以及與阻斷PD-1或CTLA-4相比,irAE更高還是更低等問題亟待解決。
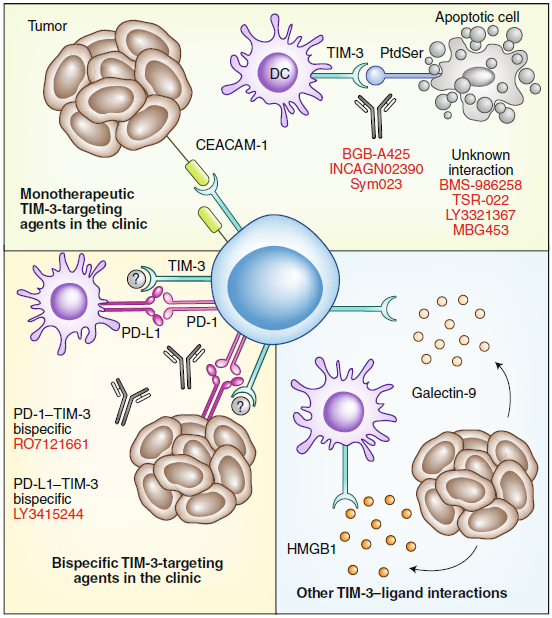
圖2. TIM-3–配體相互作用和當(dāng)前的臨床靶向策略
要點3. TIGIT和脊髓灰質(zhì)病毒受體家族的其他成員
TIGIT是免疫球蛋白超家族的成員,并于2009年首次被鑒定為IRs。TIGIT屬于脊髓灰質(zhì)炎病毒受體(PVRs)的獨特家族,包括PVR(CD155)以及CD96,CD112(PVRL2),CD112R(PVRIG)和CD226(DNAM 1)。盡管TIGIT,CD96,PVRIG和CD226主要在T細(xì)胞和NK細(xì)胞上表達(dá),但在DCs和腫瘤細(xì)胞上卻發(fā)現(xiàn)CD155和CD112,這兩種配體的過表達(dá)與胰腺癌患者的術(shù)后預(yù)后較差有關(guān)。在T細(xì)胞活化后表達(dá)的TIGIT和PVRIG具有以介導(dǎo)細(xì)胞內(nèi)在的抑制作用,而在NK細(xì)胞上表達(dá)的TIGIT則抑制細(xì)胞毒性。另外,TIGIT也在調(diào)節(jié)性T細(xì)胞上表達(dá)。
有趣的是,PVR家族的成員之間具有高度的互動性,并根據(jù)結(jié)合或配對的組合以特定于環(huán)境和細(xì)胞類型的方式發(fā)揮共刺激或共抑制作用。在腫瘤浸潤性T細(xì)胞上表達(dá)的TIGIT與在腫瘤細(xì)胞或APCs上表達(dá)的CD112或CD155相互作用,以引發(fā)共抑制信號。TIGIT還可以與腫瘤浸潤的具梭核桿菌釋放的毒性因子Fap2結(jié)合。CD112還與T細(xì)胞上的PVRIG結(jié)合以介導(dǎo)共抑制信號。相反,在T細(xì)胞上表達(dá)的CD226與CD112或CD155結(jié)合后,從而產(chǎn)生共刺激信號。
盡管在臨床開發(fā)中有幾種靶向TIGIT和PVRIG的藥物,但迄今尚未見有關(guān)療效的初步數(shù)據(jù)。所有臨床試驗均具有PD-1或PD-L1靶向組合臂,這是基于在臨床前小鼠模型中通過阻斷兩種IRs觀察到的協(xié)同作用。鑒于TIGIT和PVRIG的復(fù)雜生物學(xué)特性以及它們在TME中多個細(xì)胞亞群中的廣泛表達(dá),關(guān)鍵問題仍有待解決。如:TIGIT阻斷影響細(xì)胞類型,PVRIG和TIGIT之間協(xié)同作用的機(jī)制,以及是TIGIT還是PVRIG產(chǎn)生irAE的。
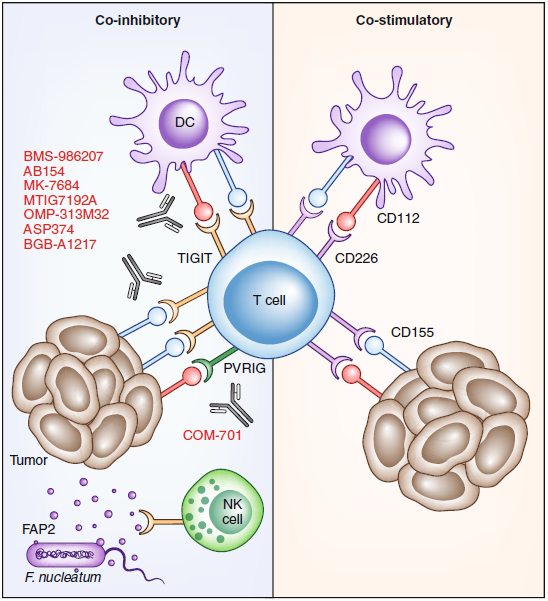
圖3. PVR家庭內(nèi)部復(fù)雜的相互作用和當(dāng)前的臨床靶向策略
要點4:B7家族的成員
目前,B7家族有十個成員:B7-1(CD80),B7-2(CD86),B7-H1(PD-L1),B7-DC(PD-L2),B7-H2,B7-H3,B7-H4,B7-H5(VISTA),B7-H6和B7-H7。雖然PD-L1已成為研究最廣泛的臨床抑制性配體,但研究表明,腫瘤細(xì)胞和抑制性TME也利用其他家族成員來逃避免疫監(jiān)視。而B7家族的三個成員(B7-H3,B7-H4和B7-H5)正通過新型癌癥免疫療法進(jìn)入臨床進(jìn)行靶向治療。
B7-H3,B7-H4和B7-H5的表達(dá)情況差異很大。B7-H3在非造血區(qū)室中的細(xì)胞普遍表達(dá),也在T細(xì)胞和NK細(xì)胞上表達(dá)。B7-H4通過刺激T細(xì)胞,B細(xì)胞,單核細(xì)胞和DC來誘導(dǎo)表達(dá)。B7-H5的表達(dá)主要限于造血區(qū)室,在調(diào)節(jié)性T細(xì)胞和髓樣細(xì)胞上有高的表達(dá)。在TME中,B7-H3和B7-H4在各種癌癥中異位表達(dá),并與疾病預(yù)后較差和生存期較差有關(guān)。盡管尚未確定它們的受體,但在臨床上,mAbs和雙特異性抗體已被用于靶向在腫瘤細(xì)胞上表達(dá)的B7-H3和B7-H4。而B7-H5主要在與腫瘤相關(guān)的巨噬細(xì)胞上進(jìn)行表達(dá),并且與用抗PD-1治療的黑色素瘤患者的獲得性耐藥有關(guān),目前臨床上以小分子抑制劑靶向B7-H5和PD-L1。
盡管針對B7家族成員的臨床前觀察振奮人心,但在理解TME中每個家族成員的作用方面仍有許多空白。如:每個家族成員的受體和信號傳導(dǎo)機(jī)制,何者是最有效和可耐受的成員,以及哪個組合最佳的。
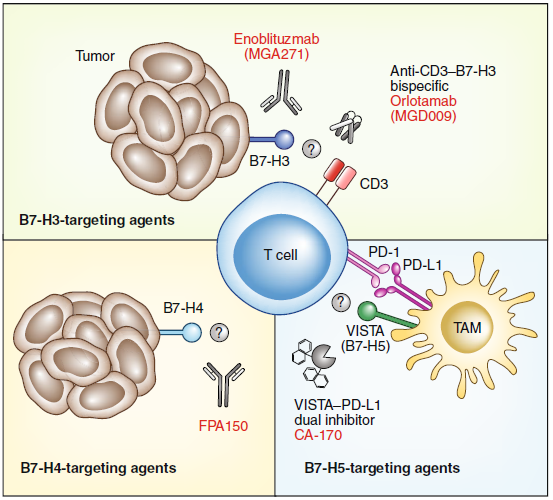
圖4. B7家族的成員和當(dāng)前的臨床靶向策略
小結(jié):
綜上所述,“第二代”靶向IRs(LAG-3,TIM-3和TIGIT)和B7家族的配體(B7-H3,B7-H4和B7-H5)是當(dāng)前免疫治療方法的主要重點,所以對靶向新型IR-配體途徑以改善癌癥患者的臨床療效正受廣泛關(guān)注。然而,更重要的是,科學(xué)家仍需應(yīng)采用更加審慎的循證方法以及可靠的生物標(biāo)志物研究來開發(fā)針對這些途徑和其他新途徑的療法,以確保臨床療效的最大化。
參考文獻(xiàn):
Andrews, L. P.; Yano, H.; Vignali, D. A. A., Inhibitory receptors and ligands beyond PD-1, PD-L1 and CTLA-4: breakthroughs or backups. Nature Immunology 2019, 20 (11), 1425-1434.
https://www.nature.com/articles/s41590-019-0512-0











