
第一作者:徐瑩、韓雪祥
通訊作者:聶廣軍、李一葉、包永平
通訊單位:國家納米中心、東安格利亞大學
研究亮點:
1. 提出利用蘿卜硫素衍生的天然化合物耗竭谷胱甘肽,提高癌細胞化療敏感性
2. 設計優先釋放SFN以先降低谷胱甘肽,減少CDDP泵出,從而顯著增加DNA與Pt結合,并導致DNA損傷和細胞凋亡
3. 闡明了SFN-CDDP-NPs的細胞凋亡機制
研究背景:
乳腺癌是女性最常見的惡性腫瘤之一,也是導致癌癥相關死亡的主要原因。抗癌藥順鉑(CDDP)在臨床上廣泛用于單獨治療或與其他治療方法結合使用對抗乳腺癌和其他人類癌癥。然而,CDDP在全身性給藥后會不加區別地破壞腫瘤細胞和正常細胞,并表現出劑量限制性副作用,例如急性腎毒性和肝毒性,這在很大程度上限制了其臨床用途。
在過去的二十年中,啟用納米顆粒(NPs)的藥物遞送系統大大提高了基于Pt的化學療法。例如長循環脂質體,水溶性聚合物和聚合膠束,NPs已被廣泛用于促進CDDP傳遞至作用部位。迄今為止,聚(l -谷氨酸)是最成功的CDDP載體。特別是,聚乙二醇-聚谷氨酸嵌段共聚物在通過羧基與CDDP配位,可以形成聚合物膠束(由Nanocarriers開發的NC-6004)。已在日本和其他亞洲國家/地區進行了III期臨床試驗。盡管已證明NC-6004和其他納米制劑可顯著降低CDDP的全身毒性,但治療效果并未得到明顯改善。
基于Pt的化學療法的抗腫瘤效果不理想的最重要原因之一是由于含巰基物質的水平升高而導致CDDP的胞質解毒。谷胱甘肽(GSH)可以與Pt結合形成Pt(GS)2共軛物,然后通過ATP依賴的谷胱甘肽S共軛輸出泵(GS-X)從腫瘤細胞迅速泵出。大量研究證明,通過降低GSH的細胞濃度,可以大大恢復癌細胞對CDDP的化學敏感性。蘿卜硫烷(SFN)是西蘭花中一種天然異硫氰酸酯,以其預防癌癥作用而聞名,其機制涉及多種靶向作用。考慮到上述GSH含量與腫瘤化學敏感性之間的負相關關系,可假設通過SFN介導的GSH耗竭可以顯著提高納米級CDDP的治療效果,但迄今為止尚未探索。
成果簡介:
有鑒于此,國家納米中心聶廣軍研究員與李一葉研究員聯合東安格利亞大學包永平教授報道了一種由水溶性聚(γ,l -谷氨酸)-CDDP共軛物(γ-PGA-CDDP)和SFN組成共遞送納米顆粒,用于乳腺癌治療。用兩親性共聚物mPEG-PLGA制備包封兩種藥物的NPs(SFN-CDDP-NP),γ-PGA-CDDP和SFN分別被封裝在親水核和疏水殼中,這可以同時將疏水性和親水性藥物遞送至癌細胞。并對SFN-CDDP-NPs的治療功效進行了系統的研究。
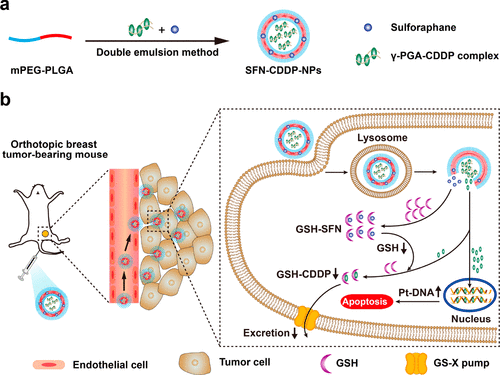
圖1. 用于改善抗腫瘤治療的SFN-CDDP-NP的制備示意圖
要點1:SFN-CDDP-NPs的合成與表征
研究人員采用改良的雙乳化方法制備SFN和γ-PGA-CDDP負載的mPEG-PLGA納米顆粒(SFN-CDDP-NPs)。在優化的SFN-CDDP-NP中,SFN和CDDP的封裝效率分別為58.7±4.5%和92.6±3.6%。SFN-CDDP-NPs的水合直徑約為98.2 nm,ζ電位的-15.4 mV,這有助于長期血液循環和被動靶向腫瘤。此外,SFN-CDDP-NPs在37℃孵育3天后顯示出良好的膠體穩定性并保持了結構完整性。在藥物釋放方面,SFN從SFN-CDDP-NP中釋放的速度比CDDP更快,這有利于降低細胞內GSH并防止CDDP失活。
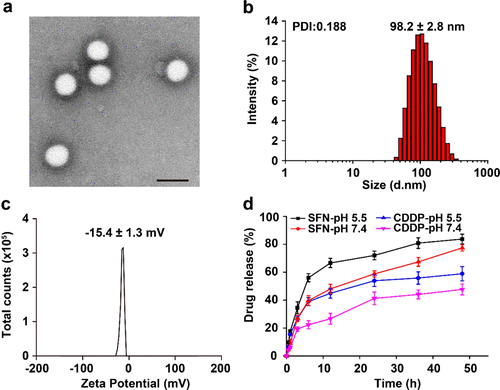
圖2. SFN-CDDP-NPs的合成與表征
要點2:NPs的細胞攝取和細胞內定位
為揭示NPs的細胞攝取行為,研究人員使用若丹明B標記mPEG-PLGA NPs(RhoB-NPs)。通過共聚焦激光掃描顯微鏡觀察。游離的RhoB和RhoB-NP均顯示出時間依賴性的細胞攝取。在處理后1小時,RhoB-NPs主要通過內吞作用被內在化并進入溶酶體。在6小時后,大量的紅色熒光與綠色熒光分開,表明它們從溶酶體轉運到細胞質。通過使用流式細胞儀進行定量分析,進一步證實了NPs增強細胞內在化。
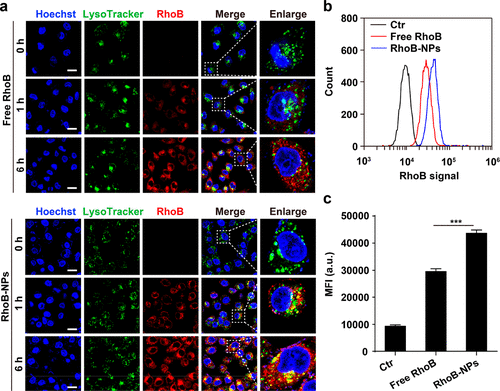
圖3. NPs的細胞攝取和細胞內定位
要點3. 體外細胞毒性
研究人員接著使用CCK-8測定不同制劑的細胞毒性。mPEG-PLGA納米顆粒在高達800 ug/mL濃度都沒有明顯的細胞毒性。在藥物治療結果顯示,SFN-CDDP-NPs具有最顯著的細胞毒性,且促使細胞凋亡達64.6%。
大量研究表明,CDDP介導的DNA損傷可以激活p53并進一步觸發p53介導的細胞凋亡以及PARP裂解介導的細胞分解。因此,研究人員對細胞凋亡機制相關蛋白進行研究,結果顯示SFN-CDDP-NPs導致γ-H2AX,p53和裂解的PARP發生最顯著的上調,且顯著減少Bcl-2表達。這些結果闡明了SFN-CDDP-NPs的細胞凋亡機制。
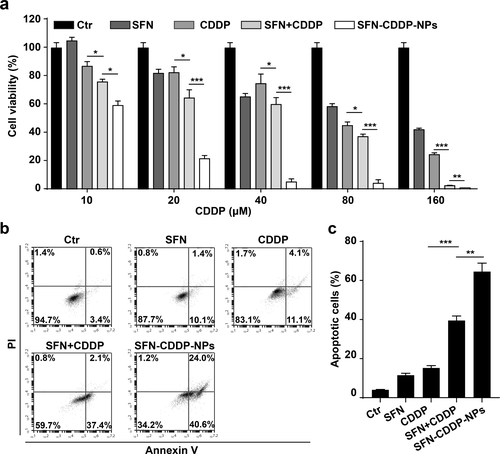
圖4. 體外細胞毒性結果
要點4. GSH的耗竭增加Pt–DNA復合物
GSH在CDDP解毒中起著至關重要的作用,而GSH的耗竭被認為會增加Pt-DNA加合物的形成和化學敏感性。為了研究SFN介導的谷胱甘肽耗竭的功效,研究人員在治療后測量了細胞谷胱甘肽和DNA結合的鉑。結果表明,與游離SFN和SFN + CDDP相比,SFN-CDDP-NPs顯著降低MCF-7細胞中的GSH含量,且與DNA結合Pt的水平最高,從而導致最顯著的細胞細胞毒性。總之,這些結果表明,GSH的強烈耗竭對于Pt-DNA加合物形成的增加是必不可少的,這說明SFN-CDDP-NP在體外具有優越的治療功效。
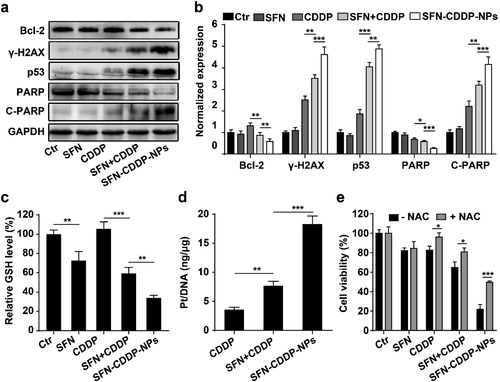
圖5. SFN-CDDP-NPs誘導細胞凋亡的機理分析
要點5. 抗腫瘤效果
為了揭示NP的藥代動力學和生物分布,研究人員制備了吲哚花青綠色標記的mPEG-PLGA NP(ICG-NP),其理化性質與SFN-CDDP-NP相似。結果表明,SFN-CDDP-NP與游離藥物相比,可以維持較高的有效藥物濃度并維持更長的治療時間。
接著,在原位乳腺腫瘤模型中研究了SFN-CDDP-NP的治療效果。與體外結果不同,SFN幾乎沒有增強CDDP的抗腫瘤作用,這很可能是由于小分子的快速消除。相反,SFN-CDDP-NPs組的腫瘤生長受到更明顯的抑制,腫瘤抑制率更高,為74.1%。因此,SFN-CDDP-NPs優異的抗腫瘤作用主要歸因于通過NPs介導被動靶向導致CDDP積累和基于SFN的GSH耗竭導致的DNA-Pt復合物顯著增加。
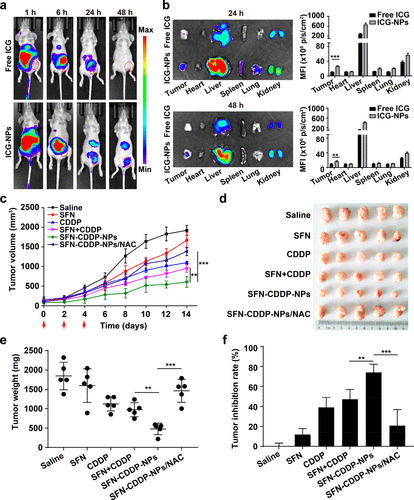
圖6. 抗腫瘤效果
小結:
綜上所述,SFN-CDDP-NPs為提高基于Pt的化療的敏感性和治療效果提供了一種簡單而強大的策略。
參考文獻:
Xu, Y.; Han, X.; Li, Y.; Min, H.; Zhao, X.; Zhang, Y.; Qi, Y.; Shi, J.; Qi, S.; Bao, Y.; Nie, G., Sulforaphane Mediates Glutathione Depletion via Polymeric Nanoparticles to Restore Cisplatin Chemosensitivity. ACS Nano 2019.
https://doi.org/10.1021/acsnano.9b07032











