光動力學療法屬于光醫學范疇。1903年NielsFinsen因發明紫外線輻射治療皮膚結核病而獲得諾貝爾醫學獎。光動力學療法應用于腫瘤治療始于1903年,Jesionek和Tappeiner用伊紅致敏腫瘤,引起腫瘤細胞破壞。1976年Kelly和Snell應用一種血卟啉衍生物(hematoporphyrinderiva-tives,HpD)治療膀胱癌成功,由此開創了光動力學療法。
光動力療法(Photodynamic Therapy,PDT)的過程是:特定波長的激光照射使組織吸收的光敏劑受到激發,而激發態的光敏劑又把能量傳遞給周圍的氧,生成活性很強的單態氧,單態氧和相鄰的生物大分子發生氧化反應,產生細胞毒性作用,進而導致細胞受損乃至死亡。到目前為止已有多個醫院在臨床上采用光動力療法對腫瘤進行診斷和治療,并且科學家也不遺余力地開發新的光敏劑和新穎的治療策略。
以下對近期光動力學療法的研究成果進行歸總,供大家交流學習
傳統光敏劑
AFM:相變納米材料—控制缺氧調節及增強光療
腫瘤缺氧會增強腫瘤對不同療法的抵抗力,尤其是氧氣介入的相關療法,如光動力治療(PDT)。近日,南京工業大學董曉臣研究團隊利用熱響應相變材料(PCM)將超小二氧化錳(sMnO2)和有機光敏劑IR780共包,制備了IR780-sMnO2-PCM納米粒子用于控制腫瘤的缺氧調節及增強光療效果。
熱響應PCM保護層不僅可以防止IR780的光降解,而且可以在激光照射下立即釋放分解內源性H2O2,產生足夠的氧氣用于光動力治療。熒光顯像和光聲顯像均顯示由于在腫瘤靜脈注射過程中有效積聚,從而大大減輕了腫瘤缺氧現象。此外,與IR780-PCM納米粒子相比,在體內聯合光熱療法(PTT)和PDT中抑制腫瘤生長方面表現出更好的性能。IR780- sMnO2-PCM納米粒子在控制腫瘤缺氧調節中具有廣泛的應用前景,可以克服目前腫瘤治療的局限性。
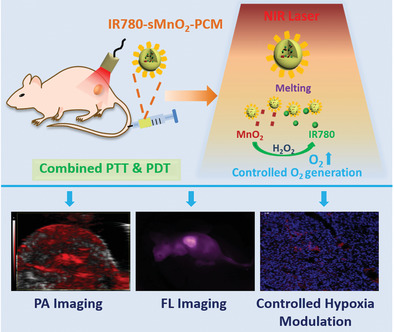
ShichaoZhang, Xuejiao Song Xiaochen Dong, et al. Phase-Change Materials BasedNanoparticles for Controlled Hypoxia Modulation and Enhanced Phototherapy. Adv.Funct. Mater., 2019.
https://doi.org/10.1002/adfm.201906805
ACS Nano:酶驅動的膜靶向嵌合肽用于增強腫瘤光動力-免疫治療
武漢大學張先正教授團隊設計了一種protein farnesyltransferase (PFTase)驅動的質膜(PM)靶向嵌合肽,PpIX-C6-PEG8-KKKKKKSKTKC-oMe(PCPK),并將其用于PM靶向的光動力治療(PM-PDT),它可通過誘導腫瘤細胞發生PM損傷和快速釋放損傷相關分子模式(DAMPs)來增強免疫治療。
研究發現,共軛有光敏劑原卟啉IX (PpIX) 的PCPK可產生活性氧來使膜相關蛋白失活并引發脂質過氧化,在極低的濃度(1μM)和光照條件下就可以破壞PM。而這種PM的特異性損傷也會進一步誘導DAMPs的快速釋放,同時產生強于傳統的胞質PDT的抗腫瘤免疫反應。實驗將這種免疫刺激的PM-PDT策略與程序性細胞死亡受體1阻斷治療相結合,可以對轉移性腫瘤產生顯著的抑制效果。
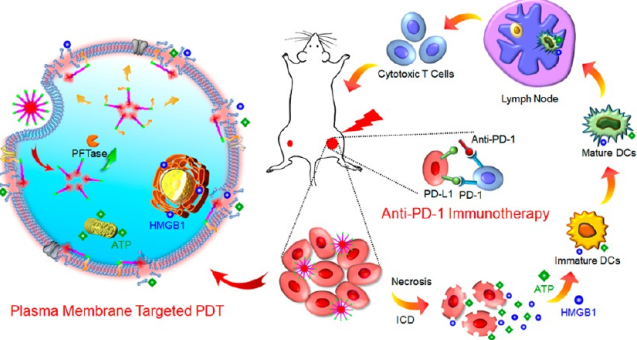
ChiZhang, Fan Gao, Xian-Zheng Zhang. et al. Enzyme-Driven Membrane-TargetedChimeric Peptide for Enhanced Tumor Photodynamic Immunotherapy. ACS Nano. 2019
DOI:10.1021/acsnano.9b04315
https://pubs.acs.org/doi/10.1021/acsnano.9b04315
Nano Lett.:全活性MOF觸發鐵死亡機制助力光動力抗腫瘤治療
納米光動力治療(PDT)是一種很有吸引力的抗腫瘤方式,誘導產生細胞凋亡則是其主要的治療機制。天津大學趙燕軍教授團隊制備了一個含有二硫化物的全活性MOF納米載體,并利用其對光敏劑Ce6進行封裝。無論光照射與否,負載Ce6的納米載體都會在小鼠乳腺癌細胞(4T1)中通過二硫-巰基交換反應去消耗細胞內的谷胱甘肽(GSH)。
而GSH的消耗會導致谷胱甘肽過氧化物酶4 (GPX4)失活,同時增強鐵死亡作用的細胞毒性。實驗在4T1荷瘤小鼠模型中對該納米材料抑制腫瘤生長的體內抗腫瘤效果進行了充分的證實。并且,實驗也證明了在引入鐵螯合物后會使得納米材料的抗腫瘤能力減弱,而這是由于GPX4活性恢復所導致的。
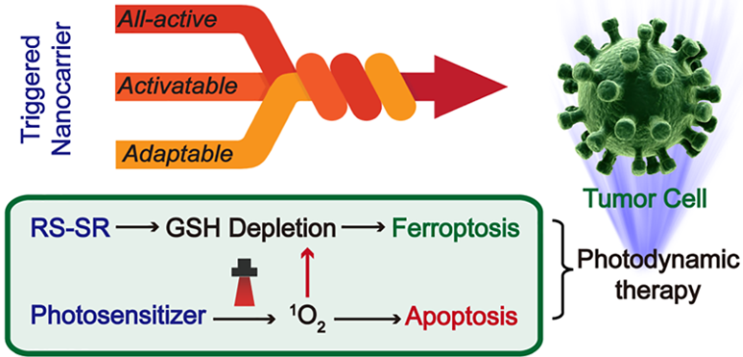
Xuan Meng, Yanjun Zhao. et al. Triggered All-Active Metal Organic Framework: Ferroptosis Machinery Contributes to the Apoptotic Photodynamic Antitumor Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02904
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02904
聚集態發光(AIE)光敏劑
Angew:高效的AIE活性光敏劑用于選擇性清除細菌和腫瘤治療
病原體感染和癌癥是人類所面臨的兩大健康問題。內蒙古大學王建國教授和香港科技大學唐本忠院士合作,通過一步反應制備了一種具有AIE特性的有機光敏劑(PS)4TPA-BQ。由于其具有聚集誘導的活性氧生成效應和足夠小ΔEST ,4TPA-BQ的1O2生成效率高達97.8%。
體內外實驗結果表明,4TPA-BQ可在短時間(15min)內對耐氨芐青霉素大腸桿菌表現出較強的光動力抗菌性能,且具有良好的生物相容性。當共孵育時間達到12小時后,癌細胞也可被有效地殺滅,而正常細胞則基本不受影響。這也首次有研究報道通過單個PS來實現時間依賴的、熒光指導的對多個靶點的光動力治療。
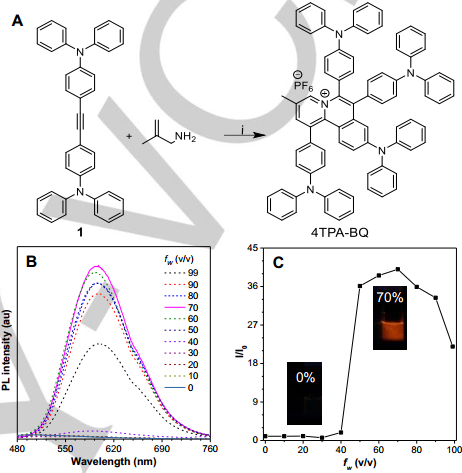
Qiyao Li, Ying Li, Tianliang Min, Jianguo Wang, Ben Zhong Tang. et al. Time-dependent Photodynamic Therapy for Multiple Targets: A Highly Efficient AIE-active Photosensitizer for Selective Bacterial Elimination and Cancer Cell Ablation. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201909706
https://onlinelibrary.wiley.com/doi/10.1002/anie.201909706
AFM:精確分子工程化的AIE光敏劑用于光動力治療
具有聚集誘導發光(AIE)特性的光敏劑(PSs)在聚集態可以高效地生成單態氧(1O2),因此它在光動力治療(PDT)領域引起了人們廣泛的研究興趣。而除了1O2生成效率高以外,其在長波長范圍內的強吸收和近紅外(NIR)發光的特性也是非常重要的,但是這對于AIE PSs來說卻很難實現,這是由于AIE分子的扭曲結構往往會導致其在短波長范圍內進行吸收和發光。
新加坡國立大學劉斌教授團隊通過精確的分子工程設計開發了一種新的AIE PSs,其在810 nm處會產生AIE效應,在300至700 nm范圍內具有很高的摩爾吸光系數,而在白光照射下則具有很好的1O2生成效率。這是由于該分子工程在TBT上引入了兩條柔性支鏈從而得到TBTC8,這就使得TBT在納米粒子(NPs)中不會產生強的分子間相互作用,因此TBTC8 NPs在1O2的生成、吸收和發光方面的性能都會更佳。體內外實驗結果也充分表明TBTC8 NPs具有良好的臨床應用前景。
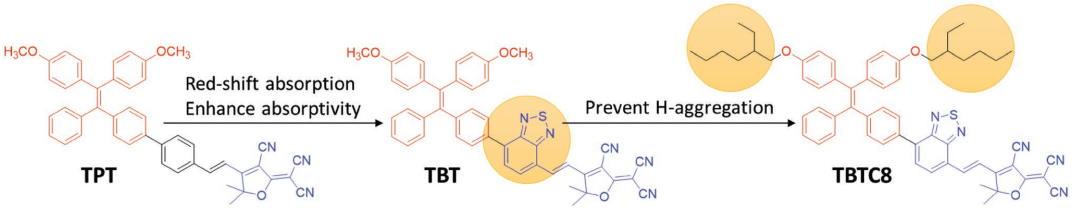
Wenbo Wu, Bin Liu. et al. Precise Molecular Engineering of Photosensitizers with Aggregation-Induced Emission over 800 nm for Photodynamic Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901791
https://onlinelibrary.wiley.com/doi/10.1002/adfm.201901791
ACS Nano:通過分子功能化設計調節細胞器特異性和光動力治療效率
高效有機光敏劑(PSs)因其在光動力治療(PDT)中的應用前景而備受關注,然而,關于其分子設計指南很少被報道。近日,唐本忠院士研究團隊以三苯胺-氮芴酮為核,設計合成了一系列PSs,并系統地研究了它們的結構-性能-應用關系。陽離子化是一種通過靶向線粒體提高PSs 光動力治療效率的有效策略。
由于分子內運動的限制和系統間交叉的增強,具有聚集誘導發光(AIE)的PSs的熒光和活性氧生成效率增加。陽離子化線粒體靶向的PSs顯示出比非電離的靶向脂滴的PSs更高的光動力治療效率。PDT聯合放療可進一步增強AIE PSs殺傷癌細胞的能力。這些結果將激發設計和合成具有更好光動力治療效率和性能的AIE PSs的研究熱情。
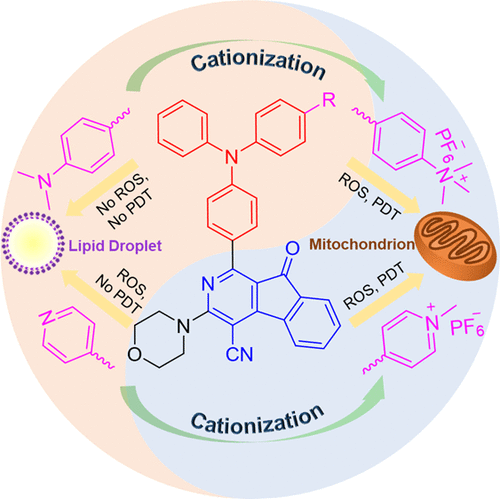
ZhiyangLiu, Hang Zou, Ben Zhong Tang, et al. Tuning Organelle Specificity andPhotodynamic Therapy Efficiency by Molecular Function Design. ACS Nano,2019.
DOI: 10.1021/acsnano.9b04430
https://pubs.acs.org/doi/10.1021/acsnano.9b04430
金屬光敏劑
ACS Nano:近紅外激發正交發射上轉換納米粒子用于成像指導的按需治療
光動力療法(PDT)是一種重要的臨床腫瘤治療策略。但是,如何建立一個智能的診療平臺來對PDT治療過程中活性氧的生成進行時空控制仍然具有很大的挑戰性。上海大學朱曉輝博士、劉金亮博士和張勇教授合作制備一種了可被808和980 nm兩種不同的近紅外光(NIR)激發的,具有正交發射特性的上轉換納米粒子(UCNPs),其在980nm激發下會發射紅色光,在808nm激發下則發射綠色光。
與傳統的UCNPs不同,這一研究制備的具有核殼結構的UCNPs沒有復雜的多層摻雜,它的紅色和綠色上轉換發光都來自于核結構中的Er3+離子。研究也進一步證明這些UCNPs可用于用于成像指導的PDT治療,它發射的紅色光可以用于觸發PDT,而發射的綠色光可用于診斷和監測治療。這一工作表明,具有正交發射性能的UCNPs有望對近紅外光成像指導的治療實現精確時空控制。

Ming Tang, Xiaohui Zhu, Jinliang Liu, Yong Zhang. et al. Near-Infrared Excited Orthogonal Emissive Upconversion Nanoparticles for ImagingGuided On-Demand Therapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b04200
https://pubs.acs.org/doi/10.1021/acsnano.9b04200
ACS Nano:金納米簇作為I型光敏劑用于體內雙光子光動力療法
光動力療法(PDT)是一種臨床認可的微創治療技術,可通過產生過量的細胞毒性活性氧來誘導靶向病變的消退。然而,于可見激發光的穿透深度有限以及實體瘤固有的缺氧微環境,PDT在治療癌癥尤其是深部或大型腫瘤方面的療效并不令人滿意。于此,中科院遺傳發育所降雨強研究員與北京大學沙印林教授合作開發了一種基于納米材料的二氫硫辛酸包裹金納米簇(AuNC @ DHLA)的高效體內PDT系統,該系統結合了組織中穿透深度大,雙光子(TP)吸收截面極高,有效的ROS生成,I型光化學機理和可忽略的體內毒性等優點。使用AuNC@DHLA作為光敏劑,已實現了高效的體內TP-PDT。
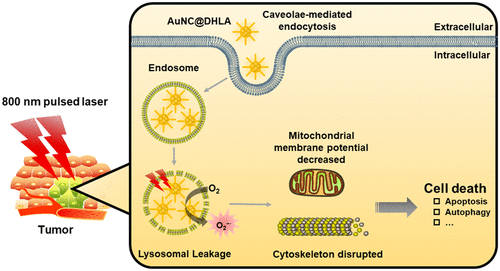
Han, R.; Zhao, M.; Wang, Z.; Liu, H.; Zhu, S.; Huang, L.; Wang, Y.; Wang, L.; Hong, Y.; Sha, Y.; Jiang, Y., Super-efficient in Vivo Two-Photon Photodynamic Therapy with a Gold Nanocluster as a Type I Photosensitizer. ACS Nano 2019.
https://doi.org/10.1021/acsnano.9b05169
Adv. Sci.:Cu2-xS@MnS核殼納米粒子作為對光/雙氧水響應的腫瘤診療平臺
上海交通大學醫學院張志愿教授、孫樹洋教授和東華大學胡俊青教授合作,以Cu2-xS@MnS核殼納米粒子(CSNPs)為基礎,開發了一種新型的腫瘤診療平臺。其中Cu2-xS核可作為光敏劑產生光熱和活性氧(ROS),而MnS殼可用于對H2O2響應并生成O2。
實驗通過調控合成策略,得到了具有最佳光熱效應和增強的光動力(PD)效應的Cu2-xS@MnS CSNPs。體內實驗表明,Cu2-xS@MnS CSNPs可有效治療HeLa細胞來源的異種移植(CDX)和頭頸部鱗癌(HNSCC)患者來源的異種移植(PDX)模型腫瘤,同時也能作為一種T1增強的磁共振(MR)造影劑,是一種具有優異性能的響應雙刺激的診療試劑。
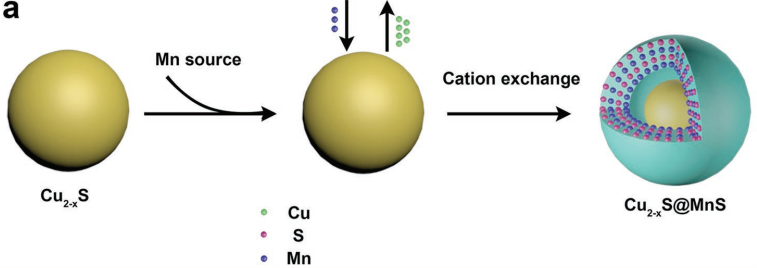
Xiaojuan Huang, Zhiyuan Zhang, Shuyang Sun, Junqing Hu. et al. Right Cu2?xS@MnS Core–Shell Nanoparticles as a Photo/H2O2-Responsive Platform for Effective Cancer Theranostics. Advanced Science. 2019
DOI: 10.1002/advs.201901461
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901461
有機骨架光敏劑
Nano Lett.:納米酶MOF用于級聯催化增強的癌癥協同治療
級聯催化可以顯著提高天然酶的化學反應效率。然而,由于天然酶存在許多固有的缺陷,設計可用于級聯催化反應的雙酶或多酶納米反應器仍然是一個很大的難題。中科院寧波材料技術與工程研究所吳愛國研究員團隊制備了一種由雙納米酶工程化的卟啉MOF材料(PCN),它可以驅動進行原位級聯催化以增強對腫瘤協同治療。
實驗將作為類過氧化氫酶的鉑納米顆粒(Pt NPs) 夾在PCN的中間,然后將作為類葡萄糖氧化酶的超小金納米顆粒(Au NPs)嵌入外殼內,最后與葉酸進行配位得到了P@Pt@P-Au-FA NPs。該材料能通過催化瘤內的過氧化氫分解來有效地緩解腫瘤乏氧,這可增強依賴于O2 的光動力治療的效果,同時也會加速Au NPs對β-D-葡萄糖的消耗并產生過氧化氫作為Pt NPs的底物,實現饑餓-光動力協同治療,從而達到了顯著的抗腫瘤作用,并可預防腫瘤的復發和轉移。
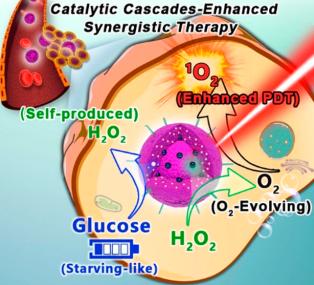
Chuang Liu, Aiguo Wu. et al. Nanozymes-Engineered Metal?Organic Frameworks for Catalytic Cascades-Enhanced Synergistic Cancer Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02253
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02253
Angew:共價有機骨架用于光動力治療
武漢大學鄧鶴翔教授團隊設計合成了一種具有二維(2D)π-共軛的共價有機骨架(COF)并將其作為一種新型光敏劑用于進行高效的光動力治療。實驗將兩種并不能有效生成ROS的分子進行連接后得到兩種COF(COF-808和COF- 909),它們具有非常高效的ROS生成效率。這些COFs具有較高的孔隙率,其表面積分別為2270和2610 m2g-1,這一特點可以使其在細胞內增強氧的擴散和ROS的釋放。
結合其具有的優良的光穩定性和高的生物相容性,它們的PDT性能十分顯著。體外實驗表明,在使用COF-909進行PDT治療后,80%以上的腫瘤細胞被有效殺滅。在體內實驗中,經過10天的COF治療后可以使得腫瘤生長被顯著抑制,體現出優異的活體治療效果。
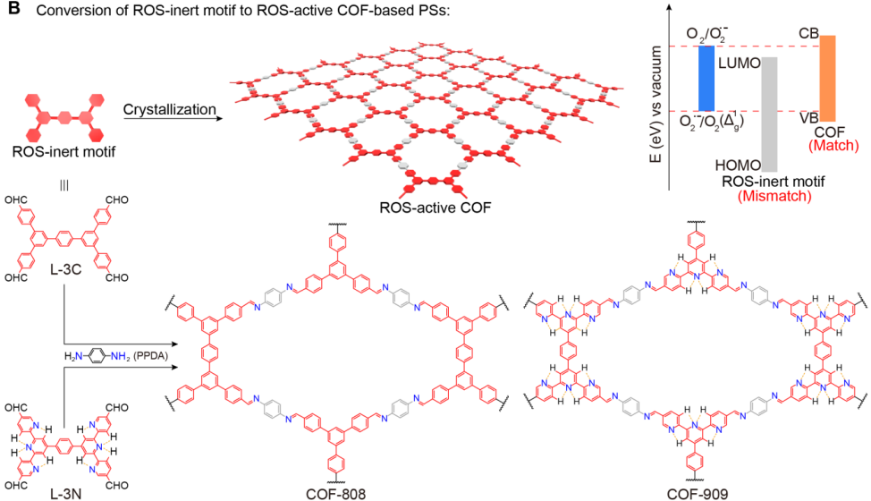
Liang Zhang, Shibo Wang, Hexiang Deng. et al. Covalent Organic Frameworks as Favorable Constructs for Photodynamic Therapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201909020
https://onlinelibrary.wiley.com/doi/10.1002/anie.201909020
半導體聚合物納米材料
AM:近紅外光敏半導體聚合物納米材料用于抑制腫瘤轉移的聯合治療
抑制蛋白質的生物合成是一種新的腫瘤治療方法。然而,目前很少有研究報道可以在生命系統中對這一細胞事件實現無創的精確調控。新加坡南洋理工大學浦侃裔教授團隊開發了一種半導體聚合物納米材料(SPNB),它可以被近紅外(NIR)光激活產生光動力治療(PDT)和抑制細胞內蛋白合成的協同作用,進而可以抑制腫瘤的轉移和腫瘤治療。
SPNB是由一種兩親性半導體聚合物自組裝而成,并利用可被單態氧(1O2)裂解的連接劑將其與蛋白質生物合成的阻斷劑偶聯在一起。實驗結果表明,SPNB不僅能在近紅外光照射下通過PDT產生1O2,還能利用光激活的阻斷劑去終止蛋白的翻譯。因此,SPNB能夠有效的治療腫瘤,并且這種光激活的抑制蛋白合成的策略也能精確地下調腫瘤組織中轉移相關蛋白的表達水平,最終實現對肺轉移的完全抑制。
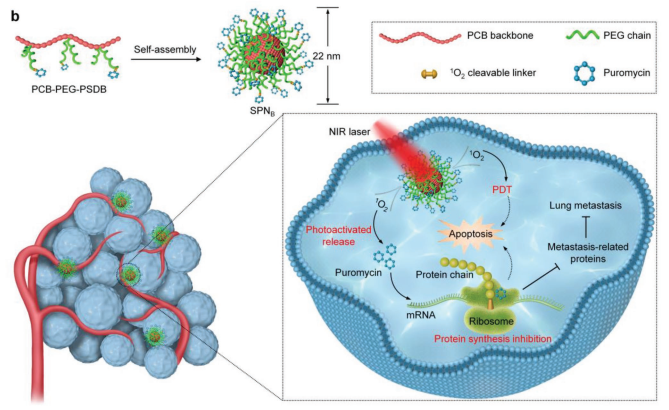
JingchaoLi, Kanyi Pu. et al. Near-Infrared Photoactivatable Semiconducting Polymer Nanoblockaders for Metastasis-Inhibited Combination Cancer Therapy. Advanced Materials. 2019
DOI:10.1002/adma.201905091
https://onlinelibrary.wiley.com/doi/10.1002/adma.201905091











