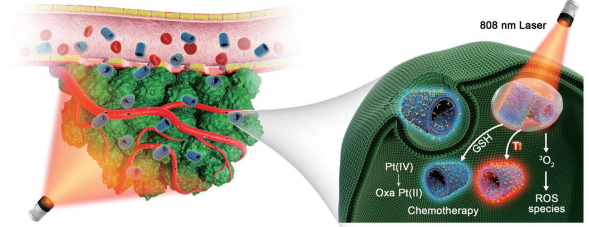
1. Small:以肽納米管為模板對Cu2-xS進行生物礦化用于轉移性腫瘤的聯合治療
一維肽納米結構如肽納米管(PNTs)等具有可調的理化性質和功能。華東師范大學徐志愛教授和張文教授合作報道了一種將PNTs作為對Cu2-xS納米顆粒(Cu2-xS NPs, x=1-2)進行生物礦化的一維模板的策略。由于PNTs表面的咪唑基團與銅離子之間具有特異性的高親和性,因此單分散的Cu2-xS NPs會均勻地包覆在PNTs上。
實驗將Cu2-xS NP包覆的PNTs與奧沙利鉑前體藥物進行共價連接,從而構建了一種多功能的腫瘤聯合治療納米平臺(Pt–CuS–PNTs)。在808nm激光照射下,該納米平臺會產生顯著的光熱效應,并可通過電子轉移和類芬頓反應產生活性氧(ROS)。實驗利用B16-F10黑色素瘤小鼠模型證明了該多功能納米平臺可以通過光-化學聯合治療顯著抑制黑素瘤的腫瘤生長和肺轉移。
Yi Lai, Zhiai Xu, Wen Zhang. et al. Peptide Nanotube-Templated Biomineralization of Cu2?xS Nanoparticles for Combination Treatment
of Metastatic Tumor. Small. 2019
DOI: 10.1002/smll.201904397
https://onlinelibrary.wiley.com/doi/10.1002/smll.201904397
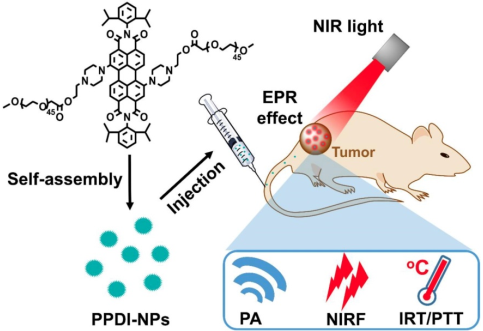
2. Theranostics:對pH響應的苝二酰亞胺納米粒子用于腫瘤的三模態成像和治療
有機發色團因其具有優異的光學性能和可被設計調控的優點,被廣泛用于多模態成像指導的光熱治療中。然而,由于其光穩定性較差且合成過程復雜,目前有機發色團的診療效率尚不能令人滿意。北京化工大學冀辰東博士和尹梅貞教授合作構建了一種具有對pH響應的哌嗪環結構的近紅外(NIR)吸收型苝二酰亞胺。該發色團在與羧基聚乙二醇結合后可以在水溶液中自組裝成納米粒子(NPs)。
實驗也對該NPs的近紅外光學性質和光熱轉換能力進行了研究,并在4T1細胞和小鼠模型上對近紅外光照射下利用PPDI-NPs進行的腫瘤診療效果進行了評價。實驗結果表明,在酸性微環境中,有著良好的光穩定性的PPDI-NPs具有近紅外熒光(NIRF)發射性能和較高的光熱轉換效率,可以通過NIRF、光聲和光熱的三模態成像來對腫瘤進行精確診斷和實現高效的PTT,同時在體內外也保持著較好的生物安全性。
Jianhao Li, Chendong Ji, Meizhen Yin. et al . pH-responsive perylenediimide nanoparticles for cancer trimodality imaging and photothermal therapy. Theranostics. 2019
DOI: 10.7150/thno.36999
http://www.thno.org/v10p0166.htm
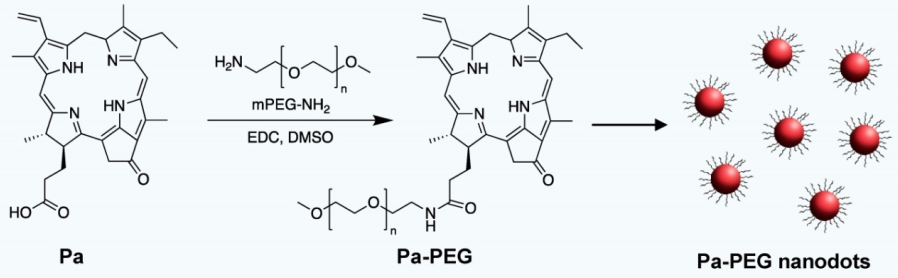
3. Theranostics:超小焦脫鎂葉綠酸-a納米點用于雙模態成像指導的光動力治療
超小的納米粒子(NPs)可迅速地從體內通過腎臟被清除,使其在體內不會產生長期的毒副作用,具有很好的臨床轉化前景。蘇蘭拉里理工大學Anyanee Kamkaew教授和蘇州大學程亮研究員合作制備了一種超小尺寸的NPs并將其用于成像指導的光動力治療(PDT)。實驗利用聚乙二醇(PEG)對深紅色的光敏劑焦脫鎂葉綠酸-a (Pa)進行功能化得到Pa-PEG。Pa-PEG會在水溶液中形成超小的納米點并表現出紅移的吸光性,其在光照下可以有效地生成單線態氧。
體外細胞實驗結果表明,Pa-PEG納米點具有良好的光動力治療(PDT)效果。實驗隨后利用光聲(PA)和熒光(FL)成像技術來對PDT治療的最佳時間進行了評估。雙模態成像結果證明,Pa-PEG納米點可以在腫瘤部位有效聚集,并在被靜脈注射后8小時達到最好的富集效果。而經PDT治療的小鼠腫瘤也被顯著地抑制。同時,該Pa-PEG納米點在腎臟中也具有很高的PA/FL信號,從而表明這些超小的納米點材料可以通過腎臟被高效地清除出體外。
Kittipan Siwawannapong, Anyanee Kamkaew, Liang Cheng. et al. Ultra-small Pyropheophorbide-a Nanodots for Nearinfrared Fluorescence/Photoacoustic Imaging-guided Photodynamic Therapy. Theranostics. 2019
DOI: 10.7150/thno.35735
http://www.thno.org/v10p0062.htm
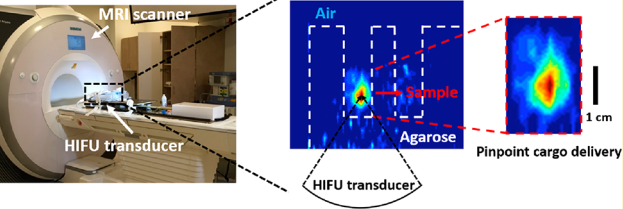
4. JACS:介孔二氧化硅納米顆粒作為響應型磁共振成像平臺
磁共振成像(MRI)是臨床疾病診斷的一種重要手段。同時,MRI指導下的高強度聚焦超聲(MRgHIFU)治療也是一種強有力的靶向治療技術。在臨床應用中,MRgHIFU主要是通過產熱和燒蝕來治療癌組織,因此其在用于藥物遞送時往往會造成不必要的熱損傷。加州大學洛杉磯分校Holden H. Wu教授和Jeffrey I. Zink教授合作制備了一種生物友好的、對MRgHIFU響應的介孔二氧化硅納米顆粒(MSN)平臺,該平臺可以在生理安全的溫度范圍內被刺激,從而降低了對周圍健康組織的造成熱損傷的可能性。
實驗利用聚乙二醇(PEG)對MSN的孔進行封蓋,其在無需大幅升溫(約4°C)的情況下就可以對HIFU做出響應并釋放負載的貨物分子。該研究將FDA批準的MRI造影劑Gd(DTPA)2?作為成像分子負載于MSN上,利用MRgHIFU的三維成像和靶向能力,可以在模擬組織的凝膠體模型中實現由HIFU刺激產生的Gd(DTPA)2?的釋放,而Gd(DTPA)2?的釋放量則受HIFU的刺激次數和功率水平的控制,且與成像的T1值呈正相關。實驗也進一步在體外的動物活體組織樣本中證明了該平臺可以在MRgHIFU的刺激下進行載藥的釋放。
Chi-An Cheng, Wei Chen, Holden H. Wu, Jeffrey I. Zink. et al. A Responsive Mesoporous Silica Nanoparticle Platform for Magnetic Resonance Imaging-Guided High-Intensity Focused Ultrasound-Stimulated Cargo Delivery with Controllable Location, Time, and Dose. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.9b07591
https://pubs.acs.org/doi/10.1021/jacs.9b07591
5. Adv. Sci:利用對氧化還原響應的納米容器去控制兩親性物質的細胞遞送
對兩親性化合物(如被熒光標記的磷脂等)進行特異性轉運是分析這些分子參與的動態細胞過程的重要先決條件。然而,如何在不應該影響細胞膜的生理完整性和形態的前提下對其進行細胞遞送仍然是不小的難題。德國明斯特大學Volker Gerke教授和Bart Jan Ravoo教授合作制備了一種對氧化還原響應的環糊精(CD)聚合物納米容器,并對其向細胞內膜組分遞送熒光標記的磷脂的能力進行了評估。
研究發現,可被還原降解的環糊精兩親物和不同的磷脂所組成的混合物是一種類脂質體的囊泡(CSSLV),而在其表面構建由胱胺交聯組成的聚合物外殼后則可以得到PSSCSSLV。實驗結果表明,PSSCSSLV具有很好的穩定性以及對氧化還原響應從而釋放兩親性貨物的能力。細胞實驗則表明PSSCSSLV可以很容易地被原代人內皮細胞攝取并內化,而細胞內小體的還原微環境則可以觸發兩親性貨物的釋放并進入細胞質基質。綜上所述,這一研究開發的PSSCSSLV是一種可將類脂的兩親性物質運輸到細胞內環境的高效遞送系統。

Wilke C. de Vries, Volker Gerke, Bart Jan Ravoo. et al. Controlled Cellular Delivery of Amphiphilic Cargo by Redox-Responsive Nanocontainers. Advanced Science. 2019
DOI: 10.1002/advs.201901935
https://onlinelibrary.wiley.com/doi/10.1002/advs.201901935
6. Biomaterials綜述:放射性核素標記的納米材料用于多模態成像
核醫學影像已發展成為一種強有力的癌癥診斷方法,它是通過直接或間接地從放射性核素中檢測伽瑪射線,從而構建出具有高靈敏度的、無穿透深度限制的可定量圖像結果。目前的核醫學成像方式主要包括單光子發射計算機斷層成像(SPECT)和正電子發射斷層成像(PET),而這兩種成像方式都需要使用放射性示蹤劑。近年來,已有研究設計了許多種放射性示蹤劑來提高核醫學成像性能,對實現癌癥的早期準確診斷提供了有力的幫助。
新南威爾士大學谷子博士和蘇州大學曾劍峰教授合作綜述了近年來核醫學成像示蹤劑及其在生物醫學成像方面的應用進展;對用于構建示蹤劑的放射性標記的納米材料以及放射性標記方法進行了介紹,對放射性標記的納米材料在基于核醫學影像的多模態成像中的應用做了重點說明,并舉出了一些典型的應用實例;最后對這一領域未來所面臨的主要調整和發展方向進行了詳細的討論。
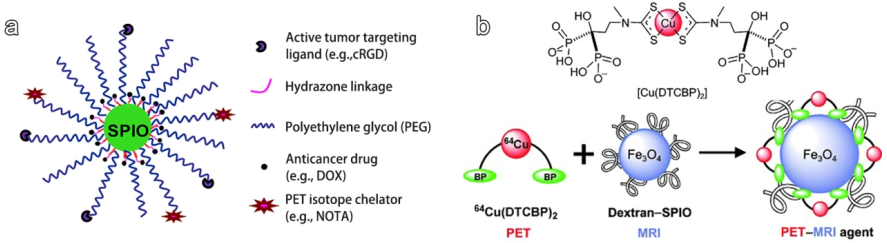
Jianxian Ge, Jianfeng Zeng, Zi Gu. et al. Radiolabeling Nanomaterials for Multimodality Imaging: New Insights into Nuclear Medicine and Cancer Diagnosis. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219306684
7. Biomaterials:鉍/酞菁錳納米復合材料在三模態成像指導的光動力-光熱治療
由于治療模式單一、激發光穿透深度有限和腫瘤微環境(TME)乏氧等原因,目前常用的光學治療試劑的治療效果往往較差。哈爾濱工程大學賀飛博士、蓋世麗博士和楊飄萍教授合作設計并制備了一種具有強近紅外吸收性能的新型酞菁-錳光敏劑,并將其用于對鉍納米材料進行改性從而獲得了一種智能化的多功能Bi/MnPcE4納米復合材料。
Bi/MnPcE4納米復合材料中的Mn2+可以催化H2O2分解以生成O2來克服TME乏氧,進而提高光動力治療(PDT)的療效。并且該納米復合材料也具有優異的T1加權MRI性能。由于該復合物具有Bi金屬內核,因此它也有著更低的毒性,更好的CT成像效果以及在808nm近紅外(NIR)激光下進行光熱治療(PTT)的性能。體內熒光成像結果表明該納米復合材料可以利用EPR在腫瘤部位迅速積累,進而實現三模態成像指導的光動力-光熱治療。
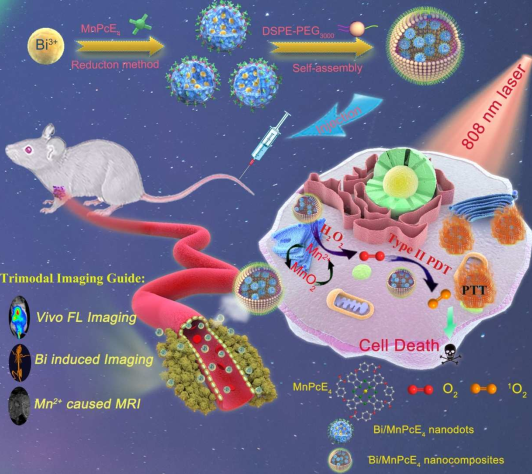
Zhao Wang, Fei He, Shili Gai, Piaoping Yang. et al. Construction of Bi/phthalocyanine manganese nanocomposite for trimodal imaging directed photodynamic and photothermal therapy mediated by 808 nm light. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219306751
8. Biomaterials:GdTPP/ZnTPP卟啉納米材料用于雙模態成像指導的光動力治療
利用多功能納米復合材料進行的雙模態成像指導的光動力治療(PDT)在腫瘤精準診療中具有廣闊的應用前景。然而,不同的功能組分間的非均相界面相容性較差、親水性差以及納米復合材料的制備復雜等問題也是構建納米復合材料所面臨的主要障礙。河南大學白鋒教授等人提出了一種中心金屬衍生的共組裝策略,該策略可以將釓卟啉(GdTPP)造影劑和鋅卟啉(ZnTPP)光敏劑集成為均勻的GdTPP/ZnTPP納米復合材料(GZNs)。
合成的GZNs具有以下優點:(1)可將兩種具有相同基團(苯基)和不同中心金屬原子(Zn和Gd)的金屬卟啉材料相結合,并極大地改善了其界面相容性;(2) GdTPP納米顆粒在與ZnTPP嵌段結合后其交差的分散性被顯著改善;(3) GZNs具有良好的熒光成像、高弛豫率(8.18 mM-1 s-1)的MRI性能和產生單線態氧的能力。實驗進一步利用HeLa細胞膜去包被GZNs (mGZNs)以實現免疫逃逸和腫瘤同源靶向,結果證明mGZNs在體內可以進行MRI/FL成像指導的高效PDT,抗腫瘤效率高達80.6%。
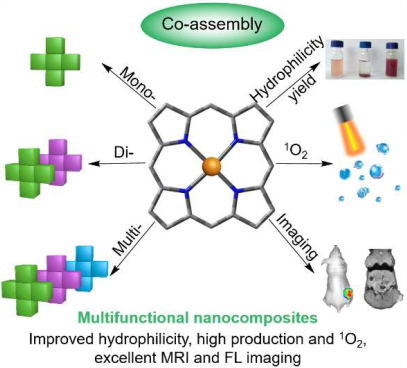
Jiefei Wang et al. Central metal-derived co-assembly of biomimetic GdTPP/ZnTPP porphyrin nanocomposites for enhanced dual-modal imaging-guided photodynamic therapy. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219306520
9. JACS:構象受限的Aza-BODIPY平臺作為刺激響應型光聲探針
光聲(PA)染料可以吸收近紅外(NIR)光并產生超聲波信號,因此可以在厘米級別的組裝深度進行檢測,其分辨率也明顯高于熒光成像。因此,開發PA探針是目前研究的一大熱門領域,而開發可被激活的PA探針則更是一個重大的科研挑戰。
伊利諾伊大學香檳分校Jefferson Chan團隊對Aza-BODIPY染料進行了六種修飾,并對它們的吸光度、熒光和PA性能進行了評估。結果表明,構象受限的Aza-BODIPY (CRaB)可以作為設計刺激響應性PA探針的支架材料。實驗也利用這一支架合成了三種不同的對刺激響應型PA探針。體外實驗結果表明CRaB PA可以在體外有效地改善比率響應(2-8倍)。最后研究通過與已有的用于檢測腫瘤乏氧的乏氧響應探針進行直接比較,證明了CRaB支架材料在體內也具有很好的應用潛力。
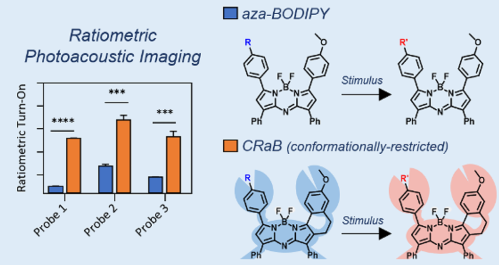
Effie Y. Zhou, Jefferson Chan. et al. A Conformationally Restricted Aza-BODIPY Platform for StimulusResponsive Probes with Enhanced Photoacoustic Properties. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.9b06694
https://pubs.acs.org/doi/10.1021/jacs.9b06694
10. Biomaterials綜述:利用納米材料緩解腫瘤乏氧微環境來增強癌癥治療
乏氧是腫瘤微環境的重要特征之一,它這是由于腫瘤細胞的供氧和耗氧不平衡所引起的,同時它對癌癥的生長和轉移也有著重要的影響,長期以來都被認為是影響癌癥治療的主要障礙之一。并且,目前臨床批準的用于人類的抗癌療法都無法直接解決這一問題,因此需要開發新的策略來克服腫瘤的乏氧障礙。
光州科學技術學院Giyoong Tae團隊綜述了近年來對用于緩解腫瘤乏氧微環境的新型納米材料的研究進展;詳細討論了兩種主要的缺氧增強策略:(1)將O2直接導入腫瘤中、(2)是通過不同的方法如催化內源性過氧化氫(H2O2)的分解和光引發的水裂解來在腫瘤微環境中原位生成O2;最后作者也對這一領域的研究方向和未來的臨床轉化進行了展望。
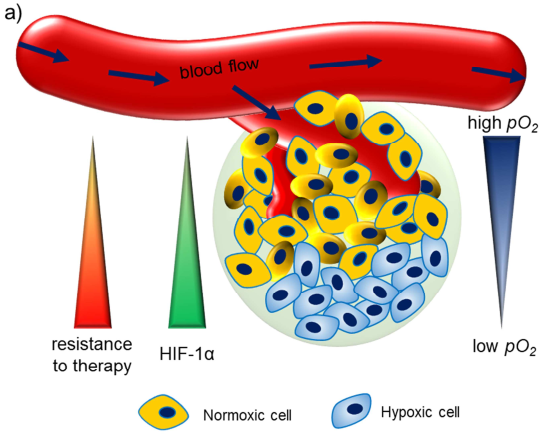
Abhishek Sahu, Giyoong Tae. et al. Improving Cancer Therapy through the Nanomaterials-Assisted Alleviation of Hypoxia. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219306775
11. Acc. Chem. Res.:多肽或DNA修飾的AIE探針的生物傳感應用
熒光探針被廣泛應用于對細胞、組織和動物進行生物成像以及在復雜環境中對多種生物過程進行監測。在近幾十年內,傳統的熒光分子探針雖然取得了許多重要的進展,但在高濃度下它們的發光會被減弱或淬滅(猝滅(ACQ)效應),這也會大大降低了它們的應用效果。而與傳統的熒光分子探針相比,具有聚集誘導發光(AIE效應)的熒光探針(AIEgens)反而在聚集態下會表現出更高的熒光,因此它具有背景低、可跟蹤的時間長以及抗光漂白的能力強等優點,并可以作為一類熒光分子來用于對多種物質進行生物傳感。
由于多肽和DNA具有良好的溶解度、生物相容性和識別性等性能,因此在許多生物傳感應用中都會利用多肽或DNA來對AIEgen進行修飾得到 MPAPs和MDAPs。中國地質大學婁筱叮教授團隊綜述回顧了近10年來MPAPs和MDAPs的相關研究進展,對模塊化設計策略及其在生物傳感領域的應用進行了重點介紹;并在最后對這一領域的不足和未來面臨的挑戰進行了闡述。
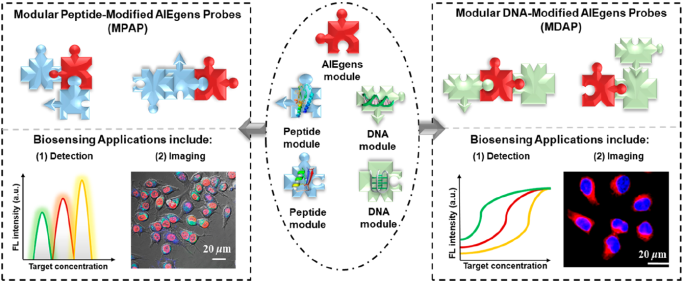
Fan Xia, Xiaoding Lou. et al. Modular Design of Peptide- or DNA-Modified AIEgen Probes for Biosensing Applications. Accounts of Chemical Research. 2019
DOI: 10.1021/acs.accounts.9b00348
https://pubs.acs.org/doi/10.1021/acs.accounts.9b00348
12. Small:加熱與配位效應可增強超分子蛋白納米藥物的光熱抗腫瘤療效
超分子蛋白納米藥物具有很好的抗腫瘤效率和較低的毒性。而關于開發具有穩定結構和增強療效的蛋白質納米藥物的相關研究在目前仍處于起步階段。曲阜師范大學齊偉教授、中科院過程工程研究所鄒千里博士和閆學海研究員合作,通過加熱的超分子化學方法將蛋白質、光敏劑和金屬離子構建成為具有光熱效應的蛋白納米藥物。研究表明,加熱過程和金屬配位效應不僅可以提高納米藥物的結構穩定性,而且還能提高其光熱性能。
因此,該納米藥物具有十分優異的光熱轉換效率,并且可以在腫瘤部位有效富集,進而可通過光熱治療顯著地抑制腫瘤生長。綜上所述,這一研究不僅為制備開發高效的光熱納米藥物提供了一種有效策略,也為實現精準診療提供了新的思路。
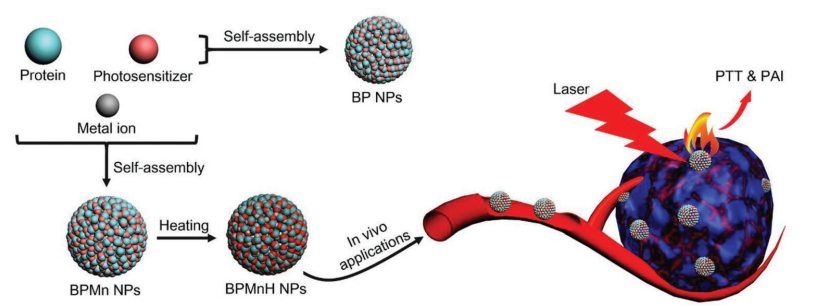
Haifeng Sun, Qianli Zou, Wei Qi, Xuehai Yan. et al. Supramolecular Protein Nanodrugs with Coordinationand Heating-Enhanced Photothermal Effects for Antitumor Therapy. Small. 2019
DOI: 10.1002/smll.201905326
https://onlinelibrary.wiley.com/doi/10.1002/smll.201905326
13. Nano Today綜述:作為抗氧化劑的納米酶材料及其相關治療應用
納米酶是一種具有內在酶活性的納米結構,它有著許多優異的性能如納米級尺寸、不規則的形狀、豐富的表面化學性質和低廉的生產成本等,因此它在納米生物醫學領域的應用也日益廣泛。其中,將具有抗氧化酶性能的納米酶用于治療氧化應激引起的疾病也是目前研究的一大熱門。
氧化應激主要表現為活性氧(ROS)的生成(如羥基和超氧自由基)與抗氧化防御系統水平之間的不平衡,而這種不平衡會導致嚴重的病理狀態發生。伊朗科曼莎大學Hossein Derakhshankhah和Samira Jafari合作對目前常見的納米酶抗氧化劑及其治療應用的相關研究進展進行了綜述,并對這一領域的未來臨床轉化前景進行了展望。
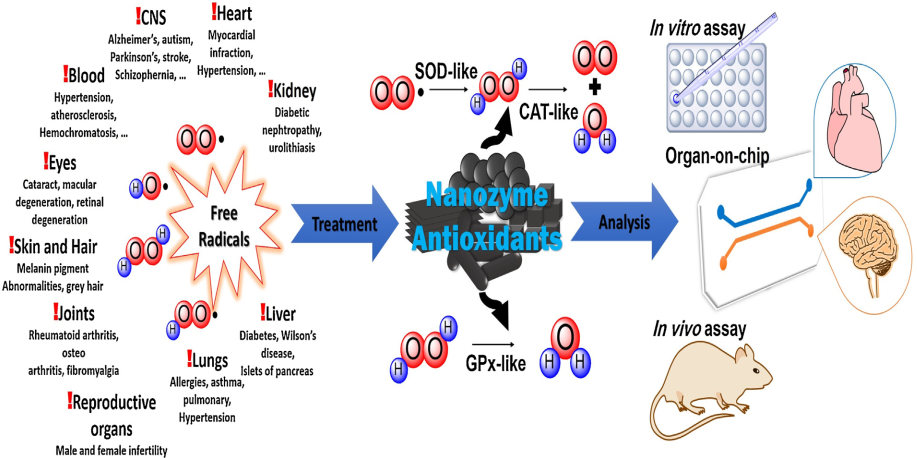
Milad Ghorbani, Hossein Derakhshankhah, Samira Jafari. et al. Nanozyme antioxidants as emerging alternatives for natural antioxidants: Achievements and challenges in perspective. Nano Today. 2019
https://www.sciencedirect.com/science/article/pii/S1748013219303342
14. Biomaterials綜述:用于肌肉組織工程的導電生物材料
肌肉組織是一種對人體來說十分重要的軟組織。肌肉組織發生損傷不僅會給人帶來生理和心理上的痛苦,也會給政府造成沉重的財政負擔,甚至發展成為嚴重的社會問題。目前,對肌肉組織損傷進行治療的方法都有其各自的局限性,而肌肉組織工程則是一種很有前途的治療策略。其中,導電生物材料因其具有良好的導電性和促進肌肉組織形成的性能而成為肌肉組織工程的一種支架材料。
西安交通大學郭保林教授團隊綜述了近年來對用于肌肉再生的導電生物材料的研究進展,對相關的合成和制備方法進行了介紹;系統地討論了這些不同形式(如水凝膠、薄膜、納米纖維和多孔支架)的生物材料對促進不同類型的肌肉組織的形成的作用;探討了導電生物材料對肌肉組織形成的影響機制,并對這一領域今后的發展方向進行了展望。
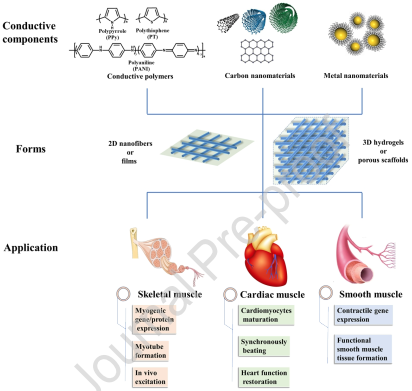
Ruonan Dong, Baolin Guo. et al. Conductive Biomaterials for Muscle Tissue Engineering. Biomaterials. 2019
https://www.sciencedirect.com/science/article/pii/S0142961219306830
15. Adv. Drug. Deliver. Rev.:納米療法用于促進新生兒受傷大腦的神經再生
新生兒腦損傷每年會對成千上萬的嬰兒造成負面影響,并有可能會導致長期甚至永久性的神經以及身體健康問題。目前,低溫治療是臨床治療足月新生兒的中度以及重度腦病的金標準。
然而,它并不具有很好的保護作用,因此仍然需要開發更多可恢復和促進神經再生的策略,例如通過干細胞治療、基因治療和納米技術等來增強內源性的神經再生通路。加州大學舊金山分校Olatz Arteaga Cabeza和Alkisti Mikrogeorgiou合作對用于促進新生兒受傷大腦的神經再生的納米治療策略進行了綜述。
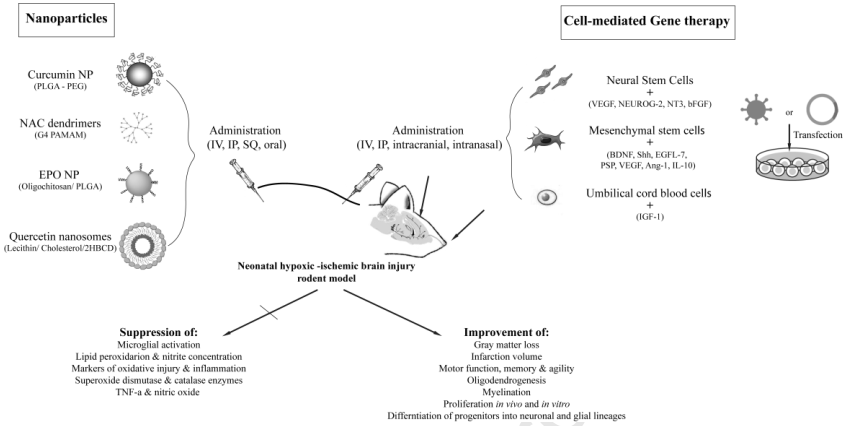
Olatz Arteaga Cabeza, Alkisti Mikrogeorgiou. et al. Advanced nanotherapies to promote neuroregeneration in the injured newborn brain. Advanced Drug Delivery Reviews. 2019
https://www.sciencedirect.com/science/article/pii/S0169409X19301905
16. Nanoscale Horiz.綜述:碳點在生物成像領域的最新研究進展
作為一種熒光納米粒子,碳點不僅具有良好的生物相容性、低的毒性和化學惰性等優異的化學性質,而且具有廣闊的激發光譜、可調的發射光譜和光穩定性等良好的光學性能,因此受到了研究人員的廣泛關注。在過去的十年內,碳點在生物醫學分析、光電子和能源等領域的應用都得到了深入的研究。
華盛頓州立大學林躍河教授、吉林大學閆旭博士和盧革宇教授合作,對碳點在生物成像領域的最新研究進展進行了綜述,主要包括將基于碳點的探針遞送至細胞或細胞器以進行體外成像的一些方法和碳點在不同體內模型中的生物分布以及用于成像指導的藥物遞送和治療的相關策略;并且也對碳點在生物成像領域的應用優勢、所面臨的挑戰和未來的發展方向進行了介紹。
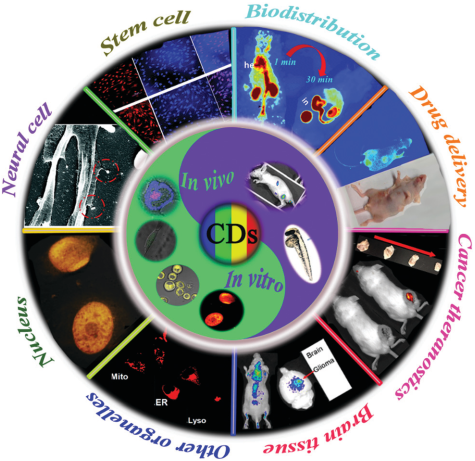
Hongxia Li, Xu Yan, Yuehe Lin, Geyu Lu. et al. Recent advances in carbon dots for bioimaging applications. Nanoscale Horizons. 2019
DOI: 10.1039/c9nh00476a
https://pubs.rsc.org/en/content/articlelanding/2019/nh/c9nh00476a#!divAbstract











