
第一作者:Bo Yu
通訊作者:蔡偉波、何前軍
通訊單位:深圳大學(xué)、美國(guó)威斯康星大學(xué)麥迪遜分校
研究亮點(diǎn):
1. 通過(guò)多模態(tài)成像(包括熒光(FL)、切倫科夫能量轉(zhuǎn)移(CRIT)成像和PET成像)對(duì)治療藥物(光敏劑和腫瘤原位光)的優(yōu)化時(shí)間框架進(jìn)行可視化和量化。
2. 使用“導(dǎo)彈-引爆”方法來(lái)減少不利的目標(biāo)外影響,并在最佳時(shí)空設(shè)置中最大限度地提高暴擊效能。
3. CRIT顯著抑制腫瘤生長(zhǎng)并導(dǎo)致腫瘤血管構(gòu)筑碎片化。
背景介紹:
納米醫(yī)學(xué)是改善癌癥靶向治療的一種有前景的策略,但在臨床上的轉(zhuǎn)化有限。在許多情況下,納米醫(yī)學(xué)應(yīng)用的轉(zhuǎn)化受到納米材料的不良毒性效應(yīng)的阻礙,即網(wǎng)狀內(nèi)皮系統(tǒng)中高積累引起的脫靶毒性,或由有限的治療有效載荷引起的低效。為實(shí)現(xiàn)納米醫(yī)學(xué)的轉(zhuǎn)化,有效抗癌治療所面臨的兩個(gè)主要問(wèn)題是優(yōu)化給藥和可控的細(xì)胞殺滅效果。
光動(dòng)力療法(PDT)是一種臨床認(rèn)可的治療各種實(shí)體腫瘤的方法。PDT引起的腫瘤血管通透性的改變已被證明可以增強(qiáng)治療劑的輸送。然而,PDT治療中需要外部光源來(lái)觸發(fā)活性氧物種(ROS)產(chǎn)生,而光的組織穿透性有限阻礙了其臨床應(yīng)用。
最近,研究發(fā)現(xiàn)切倫科夫輻射(CR)的低強(qiáng)度藍(lán)光是不受深度影響的光源,CR可單獨(dú)應(yīng)用或與光敏劑(例如二氧化鈦(TiO2)、量子點(diǎn)和卟啉)聯(lián)合應(yīng)用。CR被認(rèn)為是正電子發(fā)射斷層掃描(PET)和光學(xué)成像之間的橋梁,在臨床成像應(yīng)用中極具吸引力,利用CR作為光源產(chǎn)生ROS為光動(dòng)力治療(CRIT)開(kāi)辟了一種新的策略。
然而,該方法依然具有局限性:1)給藥的放射性核素具有相對(duì)較短的半衰期,限制了CRIT的治療窗口。通過(guò)靜脈注射的給藥途徑通常需要超過(guò)24小時(shí)才能實(shí)現(xiàn)高腫瘤蓄積,進(jìn)一步限制了使用短壽命放射性核素可能給腫瘤造成的損傷。2)不整合PET和光學(xué)成像會(huì)阻礙對(duì)治療結(jié)果的評(píng)估。3)網(wǎng)狀內(nèi)皮系統(tǒng)對(duì)納米顆粒的非特異性攝取加重了全身毒性并減弱了治療效果。因此,開(kāi)發(fā)一種高效和腫瘤積累同時(shí)盡量減少副作用的CRIT策略具有重要意義,但仍具挑戰(zhàn)性。
成果簡(jiǎn)介:
有鑒于此,美國(guó)威斯康星大學(xué)麥迪遜分校蔡偉波研究團(tuán)隊(duì)聯(lián)合深圳大學(xué)何前軍研究團(tuán)隊(duì)設(shè)計(jì)了一種“導(dǎo)彈-引爆”策略來(lái)提高腫瘤靶向CRIT的療效。該策略包括注射高劑量的卟啉-PEG納米復(fù)合物(PPN)作為CR能量接收器/導(dǎo)彈,然后注射低劑量的89Zr標(biāo)記的PPN(89Zr-Df-PPN)作為CR能量供體/雷管。在最佳時(shí)間點(diǎn),89Zr-Df-PPN雷管將在腫瘤部位點(diǎn)燃PPN導(dǎo)彈,并有效殺死腫瘤細(xì)胞。并通過(guò)切倫科夫能量轉(zhuǎn)移成像,PET成像和熒光成像實(shí)現(xiàn)可視化和量化。基于同源特性,Df-PPN和89Zr-Df-PPN在腫瘤部位的共定位被最大化,并且能夠?qū)崿F(xiàn)有效的CR能量轉(zhuǎn)移,從而在最佳時(shí)空環(huán)境下最大化腫瘤靶向CRIT的療效,同時(shí)還減少了CRIT的不良脫靶效應(yīng)。這種精確有效的CRIT策略可導(dǎo)致顯著的腫瘤血管損傷,抑制腫瘤生長(zhǎng)。
要點(diǎn)1:“導(dǎo)彈-引爆”策略使腫瘤原位光源和治療劑在腫瘤部位積累
在此策略中,首先給予高劑量的Df-PPNs,并通過(guò)增強(qiáng)滲透和滯留效應(yīng)在腫瘤部位積累,然后在第一次注射后的第三天進(jìn)行第二次注射低劑量89Zr標(biāo)記的Df-PPNs(89Zr-Df-PPNs)。基于89Zr-Df-PPNs的同源性質(zhì),89Zr-Df-PPNs在先前注射Df-PPN附近的腫瘤部位積累,使89Zr-Df-PPNs雷管能夠通過(guò)CRIT點(diǎn)火Df-PPNs導(dǎo)彈。實(shí)驗(yàn)結(jié)果表明,體內(nèi)用于跟蹤Df-PPNs的熒光信號(hào)非常強(qiáng),并且可持續(xù)至注射后17天。區(qū)域性定量分析顯示,在靜脈注射后的3天內(nèi),腫瘤對(duì)Df-PPNs的攝取穩(wěn)步增加,這進(jìn)一步證實(shí)了Df-PPNs持續(xù)循環(huán)性能,且光敏劑Df-PPNs保留在腫瘤部位,使得在隨后的注射治療前能夠長(zhǎng)時(shí)間地進(jìn)行治療。共聚焦成像進(jìn)一步顯示89Zr-Df-PPNs和Df-PPNs在腫瘤中共定位于一個(gè)區(qū)域,從而能夠以高效的時(shí)空方式進(jìn)行CRIT。此外,與共同給藥方法相比,這種“導(dǎo)彈-引爆”策略減輕了毒性。因此,“導(dǎo)彈-引爆”策略使光敏劑和CR光源共定位,在體內(nèi)實(shí)現(xiàn)CR誘導(dǎo)的局部光動(dòng)力治療。
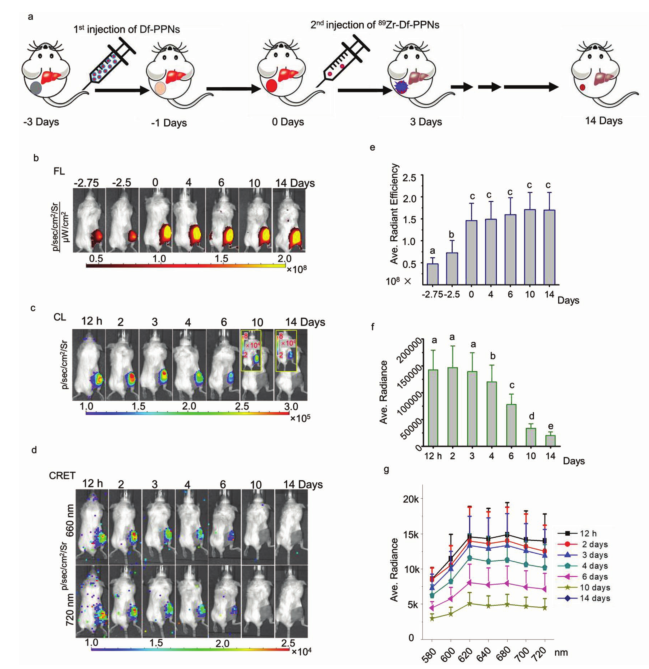
圖1. “導(dǎo)彈-引爆”方式對(duì)腫瘤原位光源和治療試劑的遞送
要點(diǎn)2:CRIT的體內(nèi)分布及抑制腫瘤效果
用較低劑量89Zr(Df-PPNs+89Zr-Df-PPNs 400μCi)處理的CRIT組小鼠也顯示出對(duì)CRIT的有效反應(yīng),平均腫瘤體積比PBS組小約8倍,在Df-PPN+89Zr-Df-PPN 1.1 MCI,Df-PPN+89Zr-DF-PPN 400μCi和89Zr-Df-PPN 1.1 MCI組中89Zr的瘤內(nèi)蓄積相對(duì)較高,PET成像也證實(shí)了腫瘤對(duì)89Zr-DF-PPNs的高攝取,使得CRIT長(zhǎng)保留期得以實(shí)現(xiàn)。這些結(jié)果表明,“導(dǎo)彈-引爆”策略成功地將光敏劑和放射性核素有效地傳遞到腫瘤中,并通過(guò)CRIT抑制腫瘤生長(zhǎng)。
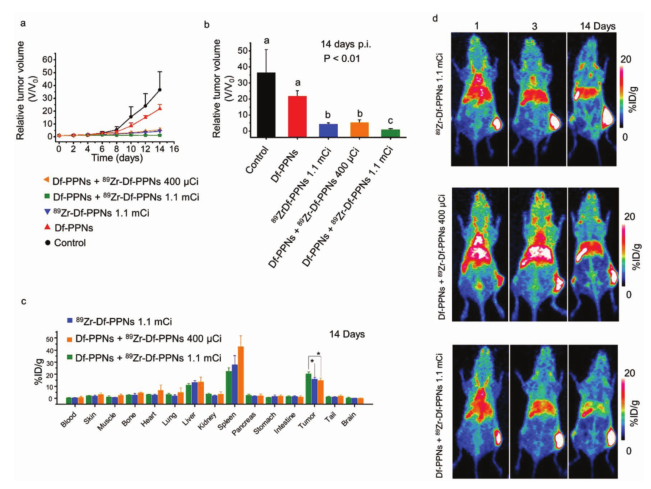
圖2. CRIT的評(píng)價(jià)和體內(nèi)生物分布。
要點(diǎn)3:CRIT聯(lián)合CR誘導(dǎo)PDT
抗血管生成治療被認(rèn)為是治療臨床上常見(jiàn)的幾種實(shí)體腫瘤類(lèi)型的一種有前景的且眾所周知的策略。然而,很多臨床經(jīng)驗(yàn)報(bào)道了與抗血管生成藥物相關(guān)的嚴(yán)重脫靶事件,這些不良事件涉及不同類(lèi)型的癌癥,因此,開(kāi)發(fā)抗血管生成策略來(lái)治療腫瘤是腫瘤學(xué)的關(guān)鍵目標(biāo)。CRIT和CR誘導(dǎo)的PDT聯(lián)合治療會(huì)導(dǎo)致腫瘤組織和腫瘤部位周?chē)?內(nèi)的血管受損,Df-PPNs和89Zr-Df-PPNs共處理組中的大多數(shù)腫瘤組織是壞死的,殘留的腫瘤組織有嚴(yán)重的壞死中心和碎裂結(jié)構(gòu)。在H&E和共聚焦熒光圖像中都發(fā)現(xiàn)了間隙,這種間隙被認(rèn)為是由于血管破裂造成的,并通過(guò)CD31免疫染色證實(shí)。因此,CRIT聯(lián)合CR誘導(dǎo)的PDT能顯著抑制腫瘤生長(zhǎng)并導(dǎo)致腫瘤血管碎裂。
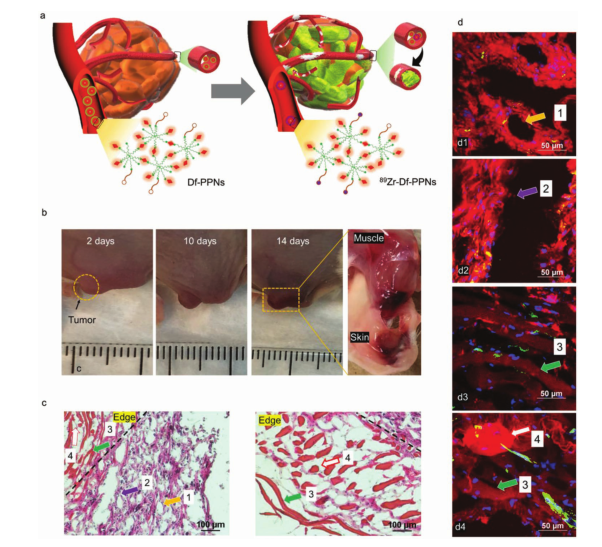
圖3. “導(dǎo)彈-引爆”策略CRIT的治療效果
小結(jié):
本研究提出了一種“導(dǎo)彈-引爆”策略,分別提供納米光敏劑(Df-PPNs)和89Zr-Df-PPNs以限制全身毒性,并在腫瘤部位共定位,在最佳時(shí)空條件下使弱CR對(duì)CRIT的效用最大化。其中,光敏劑(mTCPP)和放射性核素(89Zr)的空間鄰近性賦予了光學(xué)和PET成像極好的整合。將89Zr中的CR轉(zhuǎn)移到Df-PPNs中的mTCPP上,在沒(méi)有外部光源的情況下產(chǎn)生單線態(tài)氧。此外,這種沖擊顯著抑制腫瘤生長(zhǎng),并導(dǎo)致腫瘤中的血管構(gòu)筑碎裂。在CRIT過(guò)程中,Df-PPNs與89Zr-Df-PPNs在腫瘤中的聚集產(chǎn)生ROS,損傷腫瘤部位細(xì)胞。研究表明,通過(guò)將多模態(tài)成像與損傷腫瘤血管結(jié)合起來(lái),可將弱CR作為一種有效的癌癥治療方法。
參考文獻(xiàn):
Bo Yu, Dalong Ni, Zachary T. Rosenkrans, et al. A “Missile‐Detonation” Strategy to Precisely Supply and Efficiently Amplify Cerenkov Radiation Energy for Cancer Theranostics. Adv. Mater., 2019.
https://doi.org/10.1002/adma.201904894











