
第一作者:Xiahui Lin
通訊作者:楊黃浩、宋繼斌
通訊單位:福州大學
研究亮點:
1. 設計了涂有PEG和ROS敏感聚合物的Janus Au-MnO納米顆粒(JNPs)--一種具有超聲(US)和谷胱甘肽(GSH)雙響應囊泡。
2. 在US刺激下,這些囊泡首先分解成小的Janus Au-MnO納米顆粒,然后進一步分解成更小的Au納米顆粒和Mn2+離子,以響應腫瘤區域的高水平GSH,在提高了NP的穿透性的同時增強了ROS的產生,從而提高了SDT效率;
3. 通過雙模態光聲成像和MR成像,協同SDT/CDT抑制原位肝腫瘤生長。
背景介紹:
超聲(US)是一種無創、深穿透的機械波,在生物醫學領域具有廣泛的應用。聲動力療法(SDT)是一種基于US的治療方式,通過活性氧(ROS)的產生和聲敏劑的聲空化作用,在超聲刺激下殺死癌細胞。由于Au NPs的粗糙表面可作為成核位點并降低空化閾值,并克服了常規有機聲敏劑的穩定性低、水溶性差的限制,因此可將其作為聲敏劑。此外,由于增強的熱和機械效應,使用Au NPs作為聲敏劑通過空化產生ROS不僅可以產生單線態氧(1O2),而且可以產生羥基自由基(·OH),使其適用于缺氧腫瘤的治療。然而,目前用于SDT的納米平臺由于其大尺寸而不能充分發揮US的優勢,敏感性低,治療效果有限。此外,腫瘤的異常血管和致密細胞外基質限制了聲敏劑的組織穿透,進一步限制了SDT的療效。氧化錳納米顆粒(MnO NPs)可以分解釋放Mn2+用于響應谷胱甘肽(GSH)的類Fenton反應。已有報道稱US激波的局部湍流可提高Fenton反應的效率。因此,具有雙相核心幾何結構的Janus納米顆粒(JNPs)可提供在一個NP中結合兩種不同功能的能力。此外,JNPs相對較小的尺寸可顯著提高其組織穿透性。
成果簡介:
有鑒于此,福州大學楊黃浩教授和宋繼斌教授研究團隊設計了涂有PEG和ROS敏感聚合物的Janus Au-MnO納米顆粒(JNPs)--一種具有超聲(US)和谷胱甘肽(GSH)雙響應囊泡。在US輻照下,囊泡被分解為具有促進穿透能力的小Janus Au-MnO納米顆粒(NPs)。隨后,GSH觸發MnO降解并同時釋放出較小的Au NPs(作為眾多空穴成核位點)和Mn2+(用于化學動力學治療(CDT)),從而導致大量活性氧(ROS)生成。這種智能納米平臺還可在第二近紅外(NIR)窗口中進行雙模態光聲成像和由于釋放的Mn2+而進行的T1-MR成像,并通過協同SDT/CDT抑制原位肝腫瘤生長。
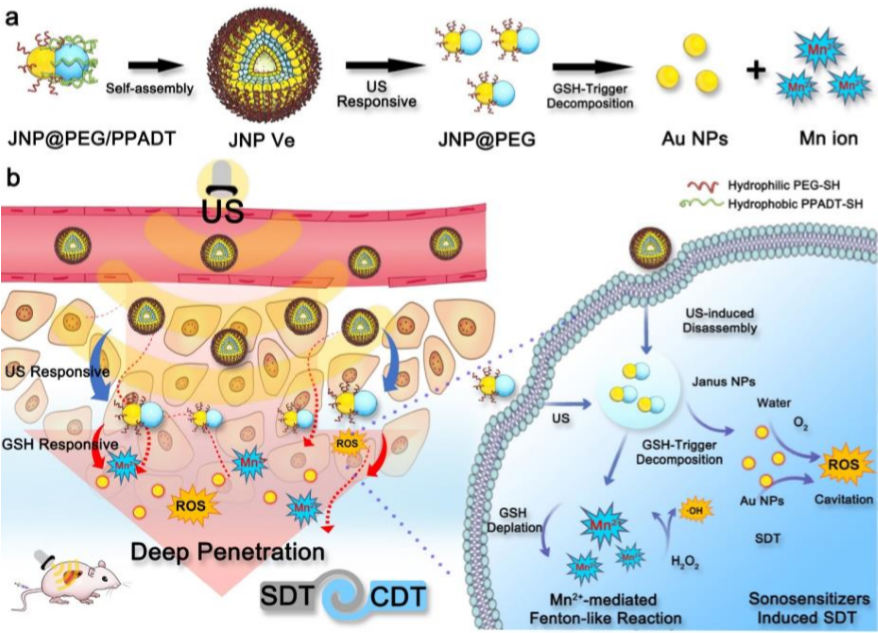
圖1:兩親性Janus-Au-MnO-NPs自組裝成JNP Ves示意圖及US和GSH刺激下SDT/CDT協同治療
要點1:雙響應兩親性JNP Ves的合成
US和GSH雙重響應性JNP囊泡(JNP Ve)作為一種新型聲敏劑是通過接枝親水性硫醇化聚乙二醇(PEG-SH)和疏水性ROS敏感性聚(1,4-苯丙酮二甲基硫縮酮)(PPADT-SH)聚合物的Janus Au-MnO納米粒子自組裝而成。
不對稱Janus Au-MnONPs首先通過MnO在AuNPs的一側異質外延生長而合成,然后通過共價Au-S鍵將疏水性ROS敏感聚合物PPADT-SH和親水性PEG-SH錨定在Au表面上,合成雙響應性兩親性JNP@PEG/PPADT,再使用水包油乳化方法將兩親性JNP@PEG/PPADT進一步自組裝成囊泡(JNP Ve)。PEG改性的Au NPs外表面促進了JNP Ves的循環,并通過封裝保護MnO免受外界環境影響。這種設計保證了JNP Ves的高生物安全性,并擴大了其可能的應用范圍。
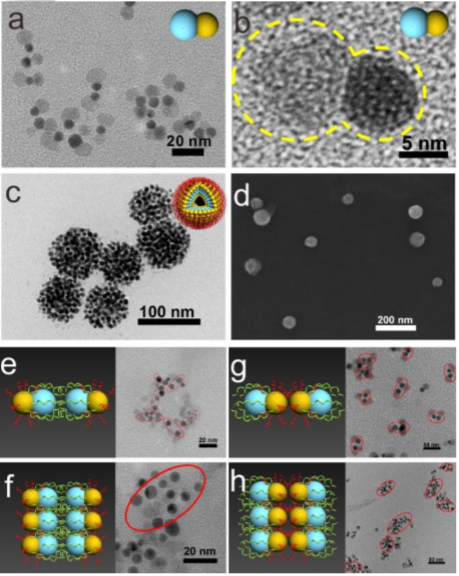
圖2:不同組裝步驟中,納米結構的表征
要點二:JNP Ves作用機理研究
由于大量的成核位點的存在,使得較小的NPs的存在增加了空化的可能性,超聲刺激產生的ROS破壞了PPADT聚合物從而破壞了自組裝的JNP Ves。隨后,拆開的JNP Ves通過空化生成提高了SDT效率,并通過釋放Mn2+來誘導CDT效應。實驗證實,拆開的較小的Au NPs能產生比完整的JNP Ves更多的ROS。其機理為,在US輻照下,空化成核位點數量突然增加,Au NPs通過熱效應和機械效應轉化氧氣和分解周圍的水,生成·OH和1O2。因此,這種新型JNP聲敏劑提供了一種可控的SDT手段,為克服缺氧性腫瘤的限制提供了可能。

圖3:JNP Ves在US刺激下響應性分解與協同SDT和CDT的機制
要點三:通過雙模態PA成像和MR成像,JNP Ves協同SDT/CDT抑制腫瘤生長
腫瘤內較高水平的GSH是提高治療性納米藥物對實體腫瘤準確性、特異性和滲透性的有效刺激,同時對正常組織的損害最小。對于Janus Au-MnO NPs而言,GSH是一種二級刺激物,可逐漸分解MnO并釋放Mn2+和AuNPs。Mn2+具有優異的類Fenton活性,在HCO3-的幫助下可將H2O2轉化為·OH。因此,Mn2+介導的類Fenton反應可以與SDT協同作用以抑制腫瘤細胞的生長。同時,順磁性Mn2+是一種T1-短縮劑,可增強MR對比度,用于深部腫瘤的高分辨率成像。
通過原位模型檢測JNP Ves的抗腫瘤作用,在US和JNP Ves的雙重作用下,小鼠腫瘤僅觀察到輕微的增加。而原位肝腫瘤小鼠模型則證明了JNP Ves的體內治療和成像效果。在1260nm激光照射下,JNP Ves在NIR-Ⅱ窗口以濃度依賴方式表現出增強的光吸收,PA成像證實了JNP Ves的高腫瘤蓄積和穿透能力。體內血液循環結果顯示,隨著時間的推移,血液中JNP Ves的濃度逐漸降低,表明其具有時間依賴性的清除和代謝作用,可以很容易地從體內消除。上述結果表明JNP Ves是一種有前景的雙成像納米平臺,可通過MR和PA信號放大實現精準腫瘤診斷,并協同SDT和CDT抑制腫瘤生長。
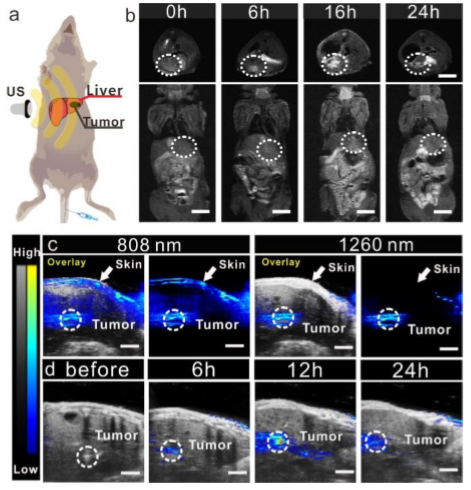
圖4:JNP Ves的PA成像及MR成像治療效果圖
小結:
通過兩親性Janus Au-MnO NPs的自組裝,開發出新型的US和GSH雙響應納米囊泡,可將其作為一種高效的聲敏劑。此囊泡可表現出針對特定腫瘤成像的腫瘤激活的NIT-II PAI和T1-MRI信號。在US和GSH刺激下,囊泡首先分解成小的AuMnO NPs以增強腫瘤的穿透,然后進一步分解成更小的Au NPs和Mn2+,分別用于增強SDT和引發CDT。這種新型聲敏納米囊泡可增加原位肝腫瘤中的納米藥物滲透,并通過增強的T1-MRI和PAI,協同SDT和CDT抑制腫瘤生長。這種JNP Ves有望成為成像引導的深部腫瘤精準治療藥物。
參考文獻:
Xiahui Lin, Shuya Liu, Xuan Zhang, et al. Ultrasound Activated Vesicle of Janus Au‐MnO Nanoparticles for Promoted Tumor Penetration and Sono‐Chemodynamic Therapy of Orthotopic Liver Cancer. Angew. Chem. Int. Edit., 2019.
https://doi.org/10.1002/anie.201912768











