
沒有批判的科研氛圍,就沒有孕育健全學術的土壤,納米人原道專欄的初衷是讓論文回歸科研的本質,帶著論點是否清晰論據是否可靠的有色眼鏡去審閱論文,學習論文。終于,納米人原道專欄又和大家見面了。(原道專欄前八期,請查看文末鏈接)
原道專欄:第九期
解讀丨小納米
校審丨晴天(納米人編輯部)
英雄不問出處,好的研究成果也是一樣。
影響因子,很大程度決定了一份學術期刊的整體水平;而一項研究成果的重要與否,則完全取決于成果本身。在部分人將重要研究成果發表于高影響因子的熱門期刊上的同時,我們必須知道有部分科學家也把一些有意思、重要的成果發表在影響因子相對不那么高,不是那么熱門期刊中。
今天關于光催化的這個文章,就是一個例子。這篇文章通過瞬態吸收光譜來證明Z-scheme中的電荷移動,堪稱是對Z-scheme教科書式的解讀!
從一個有趣的現象,提出一個大膽的假設
WO3是一種可以吸收可見光的氧化物半導體光催化劑,但是由于其過低的CB位置,即使在h+犧牲劑存在的條件下也不能分解水。(最先實現WO3基光催化材料進行全分解水的材料是PbWO4,由于Pb 6p和Pb 6s軌道的引入賦予了其還原H2O的能力。Chemistry letters, 2004, 33(11): 1452-1453.)
最近,日本Yamakata(瞬態吸收光譜的專家)課題組的研究人員發現,在含有CuCl2的甲醇·(犧牲劑)水溶液中對WO3進行UV或者VIS光照,會有氫氣產生。但是,CuCl2換成Cu(NO3)2或者是CuSO4,就得不到高效的產氫活性(Figure 1)。
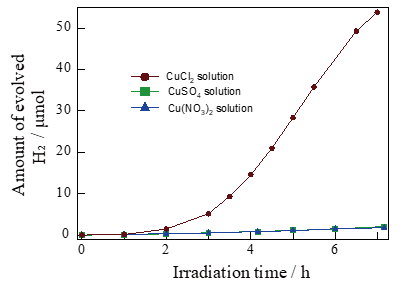
Figure 1. Time course of the H2 evolution from the WO3in 10vol% MeOH aqueous solution with 50 mM CuCl2, CuSO4,and Cu(NO3)2. UV (λ > 300 nm) light from xenon lamp(300 W) were irradiated at 300 K.
他們對反應后的樣品進行了XRD和TEM表征,發現CuCl2是以CuCl形式存在于WO3的表面。由于WO3在band位置的上不具備分解水的能力,而單獨的CuCl不具備高效產氫的能力(下文中會提到)。所以,研究團隊認為在WO3與CuCl之間存在Figure 2所示的Z-scheme的電荷分離模式。
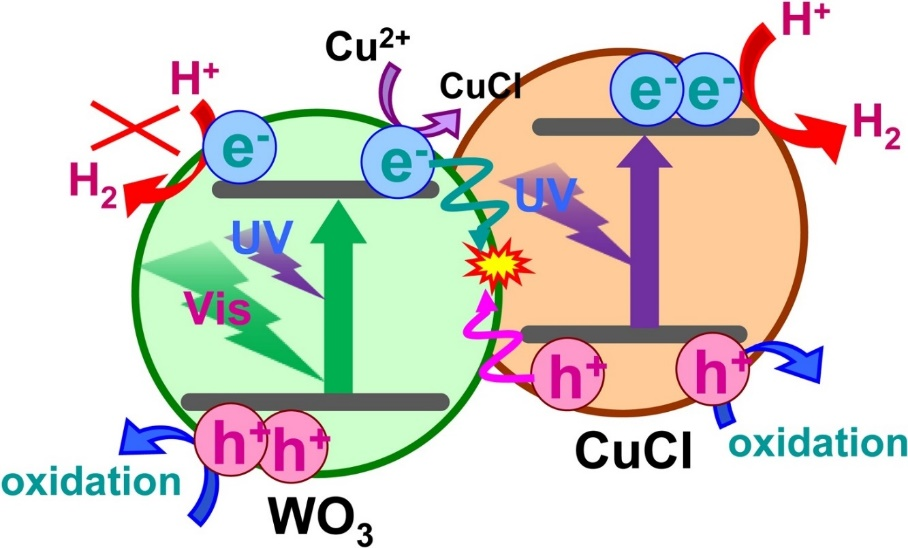
Figure 2. Proposed mechanism for enhancement of H2 evolutionby visible photoexcitation of WO3 on WO3/CuCl conjugatedcatalyst
小心求證
研究人員通過瞬態吸收中歸屬于WO3與CuCl電子與空穴吸收峰的強度以及壽命變化,證明了他們所提出的Z-scheme系的電荷分離現象。(詳細的證明方式會在下文中提出)
甲醇犧牲劑存在條件下的產氫反應
50 mM CuCl2, 10 vol% CH3OH, 500 mg WO3,和純水放入分解水的容器中,通過Ar 鼓氣排出水中的O2。利用300 W Xe燈照射該懸濁液,入射波長為>300nm。產生的氫氣通過TCD-GC進行定量分析。另外,對于以上反應,關于CuCl2的加入量,作者也對0,2,5,10,50,100 mM的CuCl2初始濃度與產氫速度之間進行了比較。
材料表征
2-1利用UV-Vis漫反射測試了樣品的吸光特性(結果略)
2-2 利用XRD對結晶相進行解析
2-3 利用瞬態吸收光譜解析WO3,CuCl,以及WO3/CuCl中的捕獲電子和空穴的舉動。并同時對捕獲電子和空穴的壽命進行了計測。·(詳細的瞬態吸收光譜此處略去,能夠自己組裝一套該設備是很令人羨慕的。)
2-4 利用UV-Vis透過分光光度計對反應前后的Cu2+進行定量。
2-5 利用天平計算光照前后的固體質量變化
結果討論
Figure 3 是50mM CuCl2, 10 vol% CH3OH, 500 mg WO3, 和純水在300 nm以上波長照射下的產氫量隨著Cu2+的濃度變化。在開始的3個小時內,Cu2+的量急劇減少,H2的產生量也很低。在超過光照反應的3h后,Cu2+的濃度大約在10mM左右,于此同時H2開始穩定的生成。7小時的反應結束后,溶液由最初的藍色變成無色。于此同時,WO3的顏色由黃綠色變成了黑灰色(Figure3中的插圖)。

Figure 3. Time courses of photocatalytic H2 evolution from0.05-M CuCl2 aqueous solution with 10% MeOH over WO3powder. The concentration of Cu2+ is also shown. Reactionconditions: catalyst, 200mg; solution, 200mL; light source, xenon lamp (300W, λ>300nm) at 300K.
Figure 4是對于CuCl2初始量與產氫速度的比較。初始濃度在0-50 mM的范圍內,產氫的速度與CuCl2的初始濃度成正比關系。當CuCl2的濃度為100mM時候,產氫的速度降低。
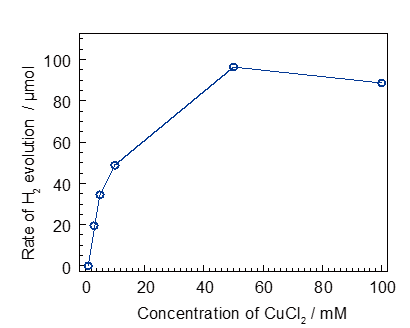
Figure 4. Concentration dependence of CuCl2 in 10 vol% MeOHaqueous solution.
由于WO3的C.B.位置不能滿足還原H+的條件,所以Cu2+被反應后產物很有可能是產氫的材料。所以,作者對反應后的WO3進行了回收,并進行了稱量。發現其重量由500 mg增加到1400 mg。通過透射電鏡的結果(Figure 5b和Figure 5a的比較),可以看出WO3反應后其表面出現很多微小顆粒。

Figure 5. TEM images of WO3 powders before (A) and after (B)the photoirradiation (>300 nm) in 0.05 M CuCl2 aqueous solutionwith 10vol% MeOH.
進一步,通過Figure 6中XRD結晶相的表征,我們可以看到在回收的樣品中出現了CuCl為主的峰,此外還有少量的Cu2O的峰。由于在Figure 1的實驗中,只有CuCl2為Cu2+原料的時候可以高效的產生H2,所以少量的Cu2O應該不是產氫的源頭(?)。因此,作者把產氫的源頭指向了CuCl。
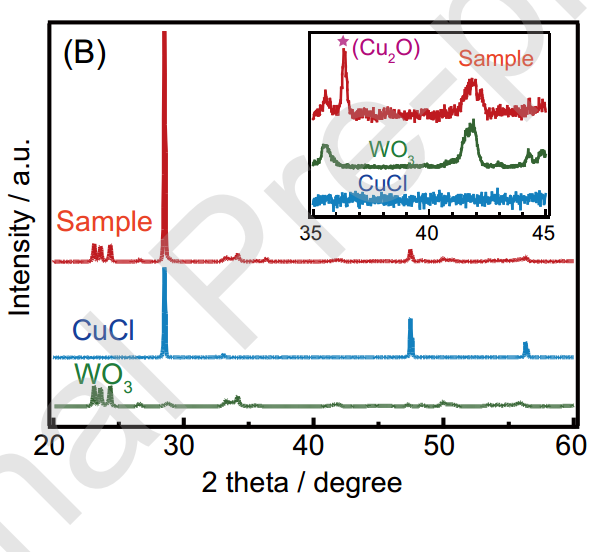
Figure 6. XRD patterns for WO3, CuCl, and the WO3sample after photocatalytic reaction in CuCl2 solution.
于是CuCl單獨的產氫活性被檢測。Figure 7(A)中便是單獨的CuCl在甲醇犧牲劑條件下產氫活性。隨著反應次數的增單獨的CuCl的活性在降低。如果該實驗最終的結論是CuCl能夠產氫那就太無趣了。通過對比WO3/CuCl體系的在同等照射條件下的產氫活性Figure 7(B)發現,其活性不僅較單獨的CuCl高,并且穩定。
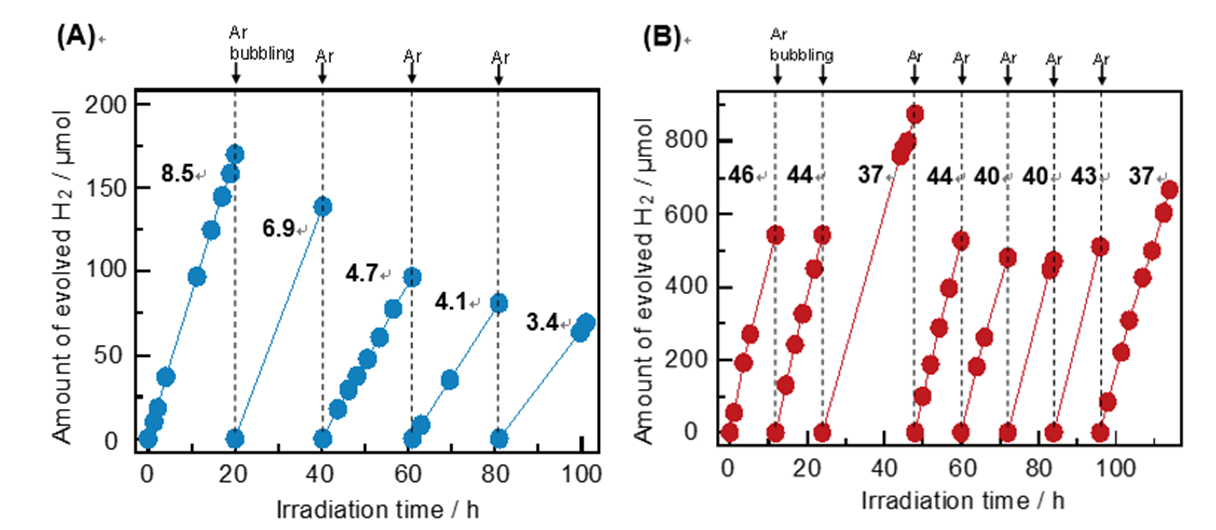
Figure 7. Time course of the H2 evolution from bare CuCl (A)and WO3/CuCl conjugates in 10vol% MeOH aqueous solution at 340 K.Reaction conditions: catalyst, 500 mg; solution, 200 mL; light source, xenonlamp (300 W, λ >300 nm). The numbers shown in the panels representthe rate of H2 evolution (mmol h-1).
進一步假設,進一步求證
那么,是否WO3和CuCl之間存在著某種電荷傳導,來增加CuCl活性與穩定性呢?作者優先考慮到了Z-scheme。如果是像αβ-Ga2O3間的電荷轉移是不會高效的產氫(假設存在αβ-Ga2O3那樣的電荷轉移,那么復合后的活性應該較CuCl產氫活性低)。
為了研究WO3相,CuCl相之間的電荷的被捕獲情況。作者對于WO3,CuCl,以及WO3/CuCl進行了瞬態光譜的研究。Figure 8是三種樣品在紫外到紅外波段的瞬態吸收光譜。
這里是文章的核心部分,請認真觀察WO3和CuCl數據,兩圖的不同之處已經用①②③標記。WO3中①和左邊的峰分別是被捕獲的電子和空穴的吸收峰(至于為什么歸屬于電子或空穴請參考論文中的引用文獻)。另外,對于CuCl而言②③是被捕獲的電子吸收峰,而左邊的峰是被捕獲的空穴的吸收峰(與WO3空穴吸收峰的位置重合)。WO3/CuCl的瞬態吸收如Figure 8C所示。由于WO3和CuCl的空穴在瞬態吸收光譜上沒有表現明顯的不同,所以請對照Figure 8C中的圖著重觀察①②③的變化。WO3的電子捕獲吸收峰已經很弱了,只剩下了CuCl的電子捕獲吸收峰,并且③位置峰的強度(強度與量正相關)有所增加。所以,作者由此判斷了WO3中電子向CuCl中的電子移動。這個已經可以間接說明了Figure 2中的電荷移動的存在(作者用了suggest,而不是demonstrate)。
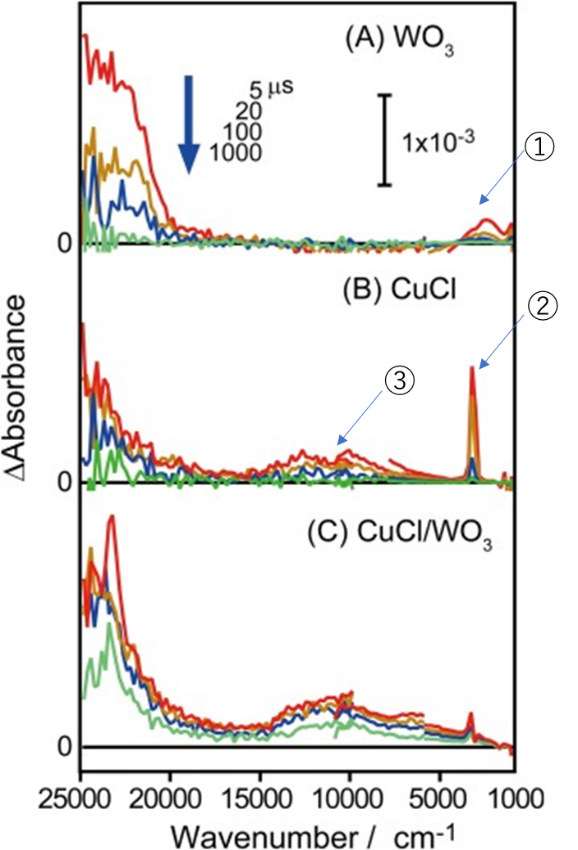
Figure 8. Time-resolved absorption spectra of (A) bare WO3,(B) bare CuCl, and (C) WO3/CuCl conjugated catalysts, measured invacuum after 355-nm UV laser pulse irradiation (0.5mJ pulse-1,6-ns duration, 5Hz).
Figure 9中,展示了歸屬于WO3相中的電子(A),CuCl相中的電子(B),以及CuCl相和WO3相中的空穴(C)的數量(0ms時的強度判斷數量)和壽命(隨著時間的變化表示壽命)。圖B中的混合相中CuCl的電子壽命和電子的數量較單一相中的CuCl明顯增加,說明了WO3相向CuCl相的電荷移動與分離現象的存在,佐證了junction的可能性。
圖A中的混合相中的WO3相的電子捕獲量要小于單一相的WO3的電子捕獲量。另外,圖C中的混合相中的總h+數目要小于WO3相中的空穴數量。這兩個現象都推測為混合相中的WO3的電子和CuCl中空穴的結合。
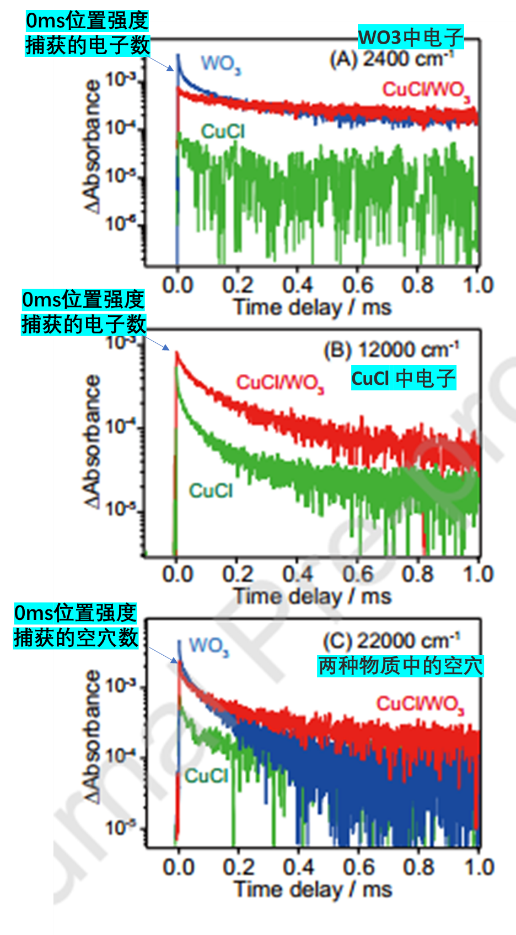
Figure 9. Decay curves for transient absorption by WO3, CuCl,and WO3/CuCl measured in vacuum at 2400cm-1 (A),12000cm-1 (B), and 22000cm-1 (C). The catalysts wereirradiated by 355-nm UV laser pulses (0.5mJ pulse-1, 6-ns duration, 1Hz).
基于以上結果,作者繪制了Figure 2 中的圖。這個實驗雖然不是overall water splitting,但是利用瞬態光譜來解析電荷的移動,筆者還是第一次見到(孤陋寡聞),因此特此做一點解讀,分享給大家。
原道寫到第九期,不知我們是否有能力,有勇氣帶著否定的態度去看論文:該文章在證明Z-scheme中使用的設備以及對結果的討論,確實是教科書般的存在。但是,文章中的不足不知哪位讀者朋友看到了,歡迎留言討論。
好文章,值得分享!
參考文獻:
Takagi, Masaki, Masayuki Kawaguchi, and Akira Yamakata. Enhancement ofUV-responsive photocatalysts aided by visible-light responsive photocatalysts:role of WO3 for H2 evolution on CuCl. Applied Catalysis B: Environmental (2019):118333.
https://www.sciencedirect.com/science/article/pii/S0926337319310793
專欄介紹:原道專欄是在納米人學術委員會鼓勵和支持下開辟的一個特色學術專欄,旨在深入挖掘頂級期刊論文中的良與莠,讓論文回歸科研的本質,引導更加深入的科研。欄目稿件包括但不限于對灌水文章的批評,對優質文章的贊賞,。總之,只要是和科研有關的深度解讀文章,都在我們的接收之列!歡迎投稿。
加入我們!
聯系微信:inano2015
投稿郵箱:inanoer@163.com











