
第一作者:Bing Feng、Zifei Niu、Bo Hou
通訊作者:李亞平、于海軍
通訊單位:中科院上海藥物研究所
研究亮點:
1. 利用吲哚菁綠(ICG)模板自組裝制備二藥合一的納米藥物,且容易擴展到其他小分子藥物,具有普遍性意義
2. 利用無輔料納米藥物實現極高的載藥量
3. 與ICB治療的結合可誘導長期記憶免疫反應,從而防止腫瘤復發
研究背景:
治療三陰性乳腺癌的局限性
三陰性乳腺癌(TNBC)是具有高浸潤性和轉移性的最惡性腫瘤之一。化學療法是臨床治療晚期或轉移性TNBC腫瘤的主要方法。然而,由于固有或獲得的多重耐藥性的發生,化學療法凸顯出了療效低下的局限性。近幾年,免疫療法,尤其是免疫檢查點阻斷(ICB)療法為癌癥療法開辟了新篇章。盡管前景樂觀,但由于TNBC腫瘤的免疫原性低和免疫抑制性腫瘤微環境(ITM),TNBC患者很少受益于當前的ICB治療。
納米藥物用于免疫療法
ICB療法與化學療法、光動力療法(PDT)或放射療法的結合已展現出協同的抗腫瘤作用,以促進腫瘤內細胞毒性T淋巴細胞(CTL)的浸潤并克服了ITM。盡管基于納米顆粒的藥物遞送系統有望實現聯合免疫療法,但目前的納米藥物的制備方案通常過于復雜,無法實現可重復性和質量控制。
無輔料的納米藥物的開發
輔料的使用會導致載藥量低下。近年來,無輔料的納米藥物在高效藥物輸送方面引起了廣泛關注。當前大多數無輔料的納米藥物已被設計為可自行組裝成納米制劑的前藥結構。小分子療法的化學修飾對于開發常規的無輔料納米粒子至關重要,但這可能會削弱抗癌藥的治療性能。
成果簡介:
有鑒于此,中科院上海藥物研究所李亞平研究員和于海軍研究員合作利用吲哚菁綠(ICG)為模板進行自組裝制備二藥合一的納米藥物并用于聯合免疫療法。該策略可不使用任何輔料而實現幾乎100%的各種小分子藥物的負載。為了進行概念驗證,該項工作專注于開發ICG模板的紫杉醇(PTX)納米粒子(ISPN)自組裝用于聯合免疫治療。ISPN與免疫檢查點阻斷劑(即抗PD-L1抗體,αPD-L1)結合使用,在具有TNBC腫瘤免疫能力的小鼠模型中顯示出協同的抗腫瘤性能。
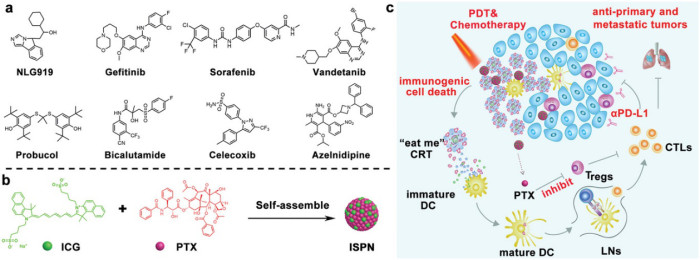
圖1. ICG-PTX自組裝納米粒子用于TNBC腫瘤免疫治療示意圖。
要點1:ICG模板納米藥物的制備和表征
為了證明ICG模板自組裝策略的普遍性,研究人員篩選了一個小分子藥物庫,結果表明所有這些藥物均與ICG形成了穩定的納米顆粒,這表明ICG模板自組裝策略在多種小分子藥物高效封裝方面的巨大潛力。物化表征表明ISPN的膠體穩定性良好且可長期保存,并表明疏水性相互作用可能是PTX的ICG模板自組裝的主導力量。
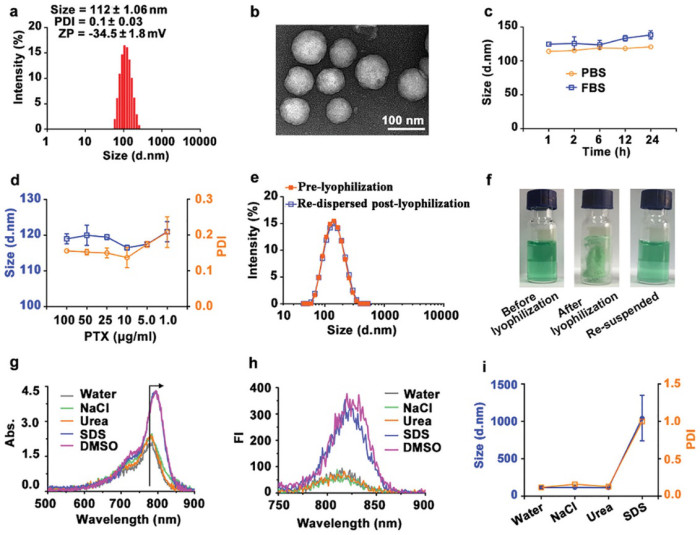
圖2. ICG模板納米藥物的制備和表征
要點2:ISPN的ICD誘導作用
CRT是ICD的主要生物標志物,充當“吃我”信號,以誘導抗原呈遞細胞吞噬垂死的腫瘤細胞。由細胞內ROS產生引起的內質網應激可能觸發CRT表達并將其轉運到腫瘤細胞表面。實驗發現ISPN + L顯著引起CRT表達,這可能歸因于ISPN + L大量產生細胞ROS。
接下來,研究人員通過檢測治療誘導的蛋白HMGB1的轉運和DC的成熟性,表明ISPN能有效地誘導腫瘤細胞的ICD并增強了腫瘤免疫原性以促進DC成熟。而且ISPN介導的化學療法和PDT在體外具有累積的抗腫瘤作用。
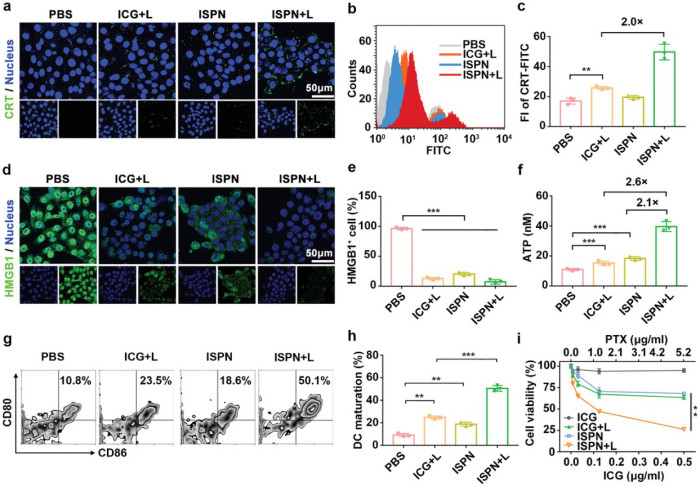
圖3. ISPN的ICD誘導作用
要點3. ISPN聯合ICB治療的抗腫瘤功效
研究人員還進行了一系列動物實驗,實驗表明ISPN具有被動靶向腫瘤和帖內長循環的能力。并探索其免疫療法的潛力,結果表明,αPD-L1與ISPN + L的組合具有良好的生物安全性且能高效抑制4T1腫瘤的生長。而且,在治療后還評估4T1腫瘤細胞的肺轉移。結果表明聯合免疫療法顯著抑制了小鼠遠距離轉移并延長了荷瘤小鼠的生存時間。
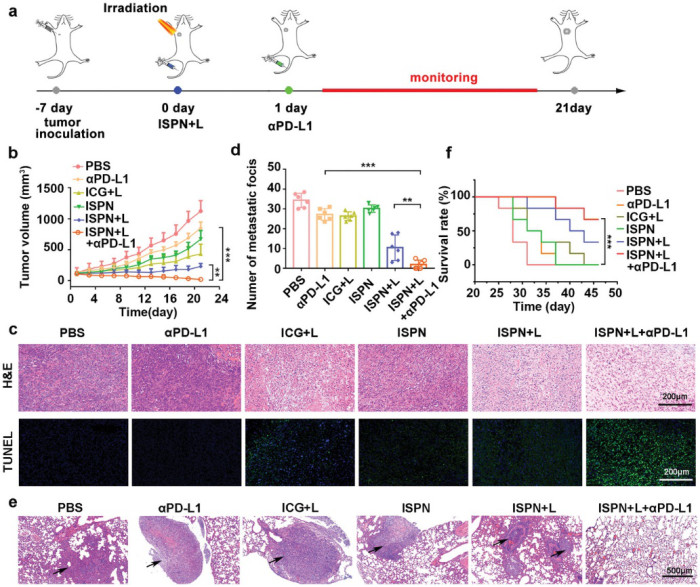
圖4. ISPN聯合ICB治療的抗腫瘤功效
要點4. ISBN與αPD-L1聯合體內誘導的抗腫瘤免疫的機制
為了闡明ISPN和ICB治療的協同抗腫瘤功效的潛在機制。免疫組織化學分析顯示,經過ISPN + L處理后,腫瘤細胞表面CRT表達顯著,表明基于ISPN的化學療法和PDT有效誘導了體內腫瘤細胞的ICD。
另外,ICB和ISPN + L的聯合治療可顯著增強腫瘤免疫原性和淋巴結(LNs)的DC成熟,以及能有效地促進IFN-γ+ CTL的腫瘤內浸潤,并通過分泌大量的IFN-γ,TNF-α和IL-6在內的炎性細胞因子引起PD-L1表達,其中可能的機理是IFN-γ觸發的細胞周期蛋白依賴性激酶5(CDK5)激活而引起的亦或是IFN-γ通過JAK-STAT途徑引起PD-L1表達。
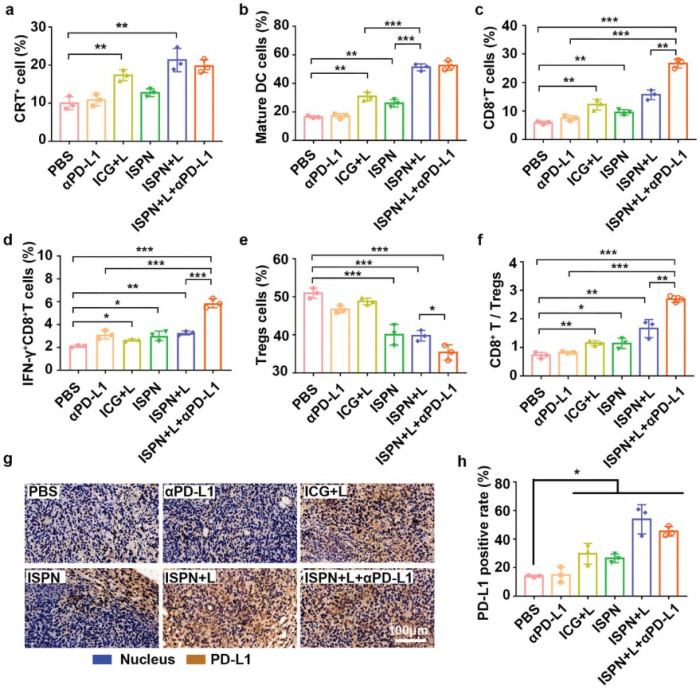
圖5. 聯合免疫療法的抗腫瘤免疫反應
小結:
綜上所述,通過制備ICG模板的小分子藥物自組裝納米顆粒,結合ICB治療顯示出累積的抗腫瘤性能,可抑制腫瘤生長并抑制肺轉移,同時能防止腫瘤復發。這項研究展示了ICG模板自組裝策略在開發無輔料納米藥物和聯合免疫療法方面的潛力。
參考文獻:
Feng, B., Niu, Z., Hou, B., Zhou, L., Li, Y., Yu, H., Enhancing Triple Negative Breast Cancer Immunotherapy by ICG‐Templated Self‐Assembly of Paclitaxel Nanoparticles. Adv. Funct. Mater. 2019, 1906605.
https://doi.org/10.1002/adfm.201906605











