第一作者:Di Wen
通訊作者:顧臻
通訊單位:加州大學洛杉磯分校
研究亮點:
1. 使用工程化的脂肪細胞作為特洛伊木馬戰(zhàn)術用于抗癌藥物的遞送。
2. 利用腫瘤脂質代謝途徑實現(xiàn)藥物發(fā)現(xiàn)和藥物遞送。
3. 基于該細胞庫可以進行腫瘤內或手術后化學治療和免疫治療,防止腫瘤復發(fā)。
研究背景:
癌細胞經常被非惡性細胞包圍,并促進腫瘤的生長。腫瘤相關的脂肪細胞(TAAs)存在于腫瘤微環(huán)境(TME)中,并被認為其能通過分泌激素、生長因子和細胞因子等脂肪因子來促進血管生成。脂肪因子有助于募集免疫細胞,這些免疫細胞有助于TME和腫瘤細胞中產生的低度慢性炎癥以及豐富的活性氧(ROS)。包括血管內皮生長因子(VEGF)在內的生長因子也可促進血管生成和腫瘤生長。
在TME中,來自脂肪細胞的脂滴中的脂肪酸還可以通過脂肪酸結合蛋白4(FABP4)和腫瘤細胞誘導的脂解作用為癌細胞提供能量。此外,最近的研究表明,脂肪細胞分泌的白介素6(IL-6)和瘦素通過激活JAK / Stat3途徑在癌細胞中誘導PD-L1表達。腫瘤細胞引起的從白色脂肪到棕色脂肪的轉變也可以促進脂肪細胞中PD-L1的直接表達。因此,靶向TAAs可用于中斷和消除腫瘤細胞的重要的營養(yǎng)來源以及免疫保護。
成果簡介:
有鑒于此,美國加州大學洛杉磯分校顧臻團隊利用脂肪細胞作為藥物遞送系統(tǒng),將ROS響應性阿霉素前藥(pDox)與一種抗癌脂肪酸(RA)一起封裝到脂肪細胞中,來實現(xiàn)腫瘤微環(huán)境內局部和持續(xù)釋放化療藥物。這種類似特洛伊木馬戰(zhàn)術的脂肪細胞介導的藥物遞送策略擴大了細胞治療的范圍,并且可以擴展用于治療與脂質代謝途徑相關的其他疾病。
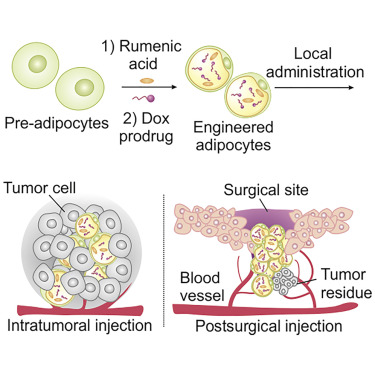
圖1. 脂肪細胞作為藥物遞送系統(tǒng)示意圖
要點1:RA重塑脂肪細胞的促癌功能
正常的腫瘤相關脂肪細胞會促進腫瘤細胞的生長,為了逆轉這一致瘤作用,研究人員將抗癌RA封裝到脂肪細胞中,體外細胞實驗發(fā)現(xiàn)裝載RA脂肪細胞明顯抑制了腫瘤的生長并下調PD-L1的表達。
在進一步評估RA @脂肪細胞的抗腫瘤作用實驗中發(fā)現(xiàn),瘤內注射RA @脂肪細胞可顯著延遲腫瘤生長,而無明顯毒性。并且在后期觀察到腫瘤細胞中PD-L1的表達降低,腫瘤浸潤的CD4+和CD8+ T細胞增加,而調節(jié)性T細胞(Tregs)相對減少,這表明RA重塑了脂肪細胞的促癌功能而變成具有抗癌功能。
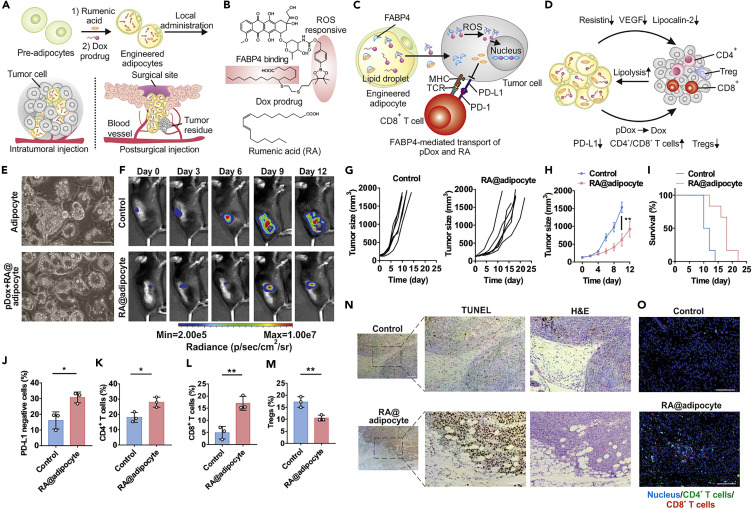
圖2.RA重塑脂肪細胞的促癌功能
要點2:癌細胞通過脂質代謝途徑攝取pDox
為了進一步提高RA @脂肪細胞的治療效果,研究人員通過將Dox通過苯硼酸與油酸連接形成具有ROS響應Dox前藥。實驗假設pDox與脂質結合會增強癌細胞通過脂質代謝途徑攝取Dox。通過計算機模擬和實驗發(fā)現(xiàn)pDox對FABP4確實具有很高的結合親和力。在細胞共培養(yǎng)實驗中,pDox @脂肪細胞顯示出增強的細胞毒性,而通過抑制FABP4(iFABP4)通道則大大降低了這種作用。這表明,癌細胞通過脂質代謝途徑攝取pDox。同樣的,兩種藥物聯(lián)合的pDox+RA@脂肪細胞對癌細胞表現(xiàn)出增強的細胞毒性。總的來說,數(shù)據(jù)表明pDox可以有效地負載到脂肪細胞中,并且pDox可以通過脂質轉運和脂解激活而轉移到腫瘤細胞中。
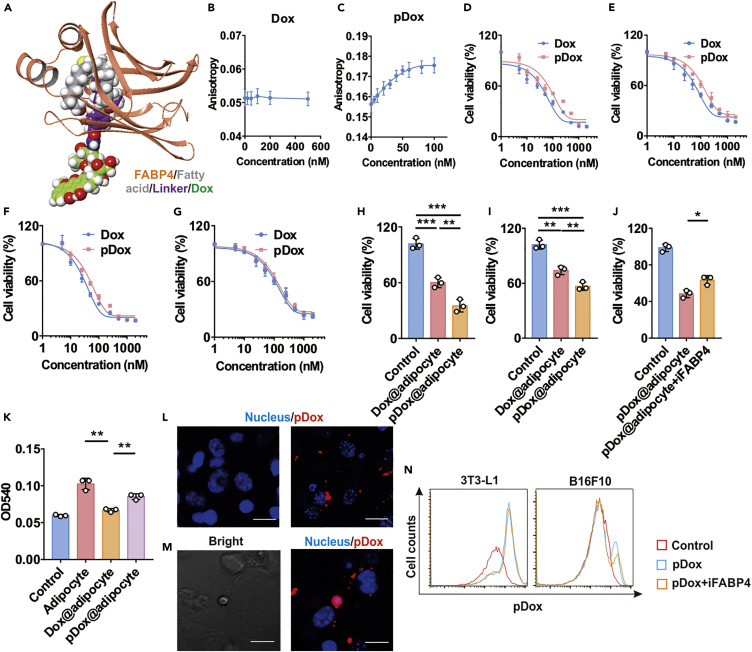
圖3. DPIP抗癌細胞效果
要點3. pDox+RA@脂肪細胞促進化學療法和免疫療法
為了驗證pDox + RA @脂肪細胞在體內的治療效果,研究人員利用了B16F10小鼠黑色素瘤模型進行實驗。與負載在纖維蛋白凝膠中的游離pDox相比,pDox通過脂肪細胞傳遞時具有增強的抗腫瘤功效。接受pDox+RA@脂肪細胞的小鼠的存活率顯著提高,而沒有明顯的毒性。在后期還觀察到在pDox + RA @脂肪細胞處理后,腫瘤細胞中PD-L1的表達降低,腫瘤浸潤的CD4+和CD8+ T細胞增加,而調節(jié)性T細胞(Tregs)相對減少,這與體外試驗結果一致。此外,在腫瘤切除模型中,pDox + RA @脂肪細胞還可以保護小鼠免于腫瘤復發(fā)。

圖4. 載藥脂肪細胞抑制腫瘤生長
小結:
綜上所述,通過整合抗癌脂質分子的“脂質載體工程”來恢復脂肪細胞的致瘤作用。由TAAs介導的抗腫瘤作用可通過利用FABP4介導的脂質轉運將藥物局部遞送至腫瘤細胞來實現(xiàn)。此外,RA脂肪細胞通過下調PD-L1表達來誘導免疫原性腫瘤表型,從而使效應T細胞浸潤。這種脂肪細胞介導的藥物遞送策略可以為治療涉及脂質代謝的多種疾病提供新思路。
參考文獻:
Wen, D.; Wang, J.; Van Den Driessche, G.; Chen, Q.; Zhang, Y.; Chen, G.; Li, H.; Soto, J.; Liu, M.; Ohashi, M.; Wang, Z.; Abdou, P.; Hu, Q.; Dotti, G.; Li, S.; Fourches, D.; Gu, Z., Adipocytes as Anticancer Drug Delivery Depot. Matter.
https://doi.org/10.1016/j.matt.2019.08.007
課題組介紹

顧臻,博士,美國加州大學洛杉磯分校(UCLA)生物工程系教授、NIH生物技術/生物醫(yī)學與工程培訓項目主任。本科、碩士畢業(yè)于南京大學化學系及高分子科學與工程系;2010年于UCLA獲得工學博士學位;同年博士后受聘于麻省理工學院化工系/Koch癌癥綜合研究院、哈佛大學醫(yī)學院,師從Robert Langer教授。2018年前,任教于北卡羅萊納大學教堂山分校/北卡州立大學聯(lián)合生物醫(yī)學工程系,獲評Jackson Family杰出講席教授(Distinguished Professor)。其指導的“iMedication-智能醫(yī)藥實驗室”研究方向包括蛋白質遞藥系統(tǒng)、生理響應材料、免疫治療制劑、細胞治療策略等。目前已發(fā)表學術論文160余篇,申請專利50余項(授權公司30余項)。
顧臻教授曾獲“斯隆研究獎”、國際藥物控釋學會(CRS)“青年學者獎”、美國糖尿病學會(ADA)“青年教授獎”及“Pathway”研究獎、美國生物醫(yī)學工程學會(BMES)“細胞/分子生物工程創(chuàng)新者獎”等。2017年獲美國國務院頒發(fā)的亞太經合組織(APEC)創(chuàng)新、研究與教育科學獎(ASPIRE)評選美國區(qū)亞軍。《麻省理工科技評論》曾將其評為“TR35全球杰出創(chuàng)新者”。2019年當選美國醫(yī)學與生物工程院(AIMBE)Fellow。其團隊首次報道了“智能胰島素貼片”(Smart Insulin Patch)的原型并推動其臨床轉化,相關研究圖片曾入選《科學》雜志年度十大科技圖片。目前擔任《Nano Research》副主編及《Advanced Biosystems》、《Advanced Therapeutics》、《化學進展》、《Medicinein Drug Discovery》等雜志的編委,并任CRS仿生遞藥專委會主任。











