美國科學家詹姆斯·艾利森(James P. Allison)和日本科學家本庶佑(Tasuku Honjo)獲得2018年諾貝爾生理學或醫學獎。

獲獎理由:
發現負性免疫調節治療癌癥的療法
"for their discovery of cancer therapy by inhibition of negative immune regulation."
免疫療法的效果已在臨床得到了充分的驗證,為了得到更好的治療效果,科學家利用納米技術繼續拓展免疫治療。以下是近期納米技術在免疫治療方面的部分研究進展,供大家交流學習。
綜述
Nat. Rev. Cancer:利用納米技術改善癌癥免疫治療
利用患者的免疫系統來對抗腫瘤的癌癥免疫治療在2018年獲得了諾貝爾生理學或醫學獎,其效用也已在臨床得到了充分的驗證。但是,目前對免疫治療有著良好響應的患者比例卻仍然很低(約為15%)。這是因為腫瘤有著多種的免疫逃避的機制。而通過對免疫系統進行時空調控則有望實現最佳的治療效果。
納米顆粒和其他一些生物材料可以對免疫調節試劑的靶向位置、藥代動力學和協同遞送進行調整,因此將癌癥免疫治療和納米生物工程等技術進行融合是一種非常好的策略。丹娜-法伯癌癥研究所Michael S. Goldberg教授對用于改善癌癥免疫治療的相關納米技術研究進行了綜述,并對這一領域的發展方向做了詳細介紹。
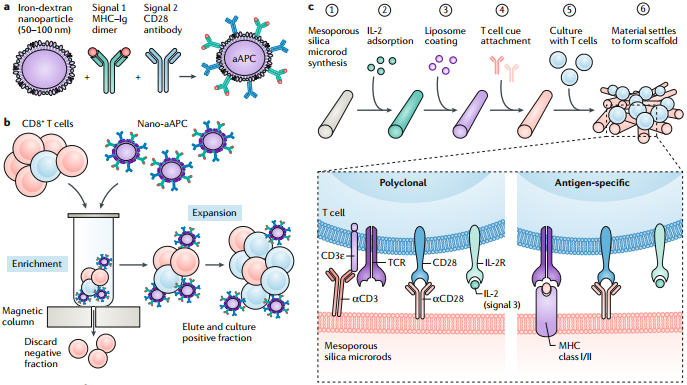
MichaelS. Goldberg. Improving cancer immunotherapy through nanotechnology. Nature Reviews Cancer. 2019
https://www.nature.com/articles/s41568-019-0186-9
Chem. Soc. Rev.:局部生物材料可輔助癌癥免疫治療并引發全身抗腫瘤響應
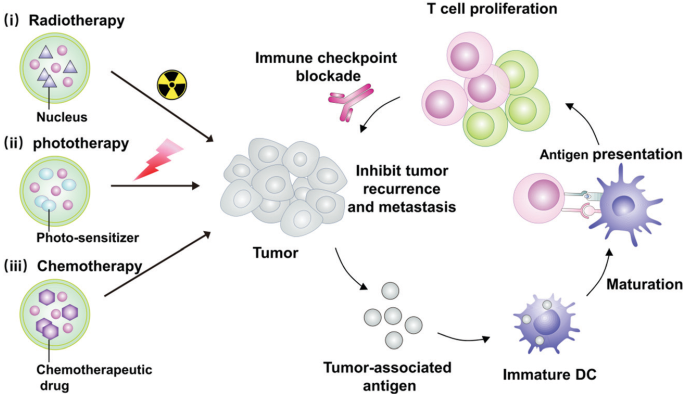
通過刺激患者自身的免疫系統來攻擊癌細胞的癌癥免疫治療在臨床實驗中具有良好的治療效果,但是諸如有限的臨床響應率和自體免疫相關的不良反應等關鍵問題仍有待解決。近年來,人們發現利用生物材料進行輔助的局部治療方法,包括局部放療、化療或光療等都可以通過誘導免疫原性細胞死亡(ICD)來刺激免疫系統。而將局部治療后所引發的腫瘤特異性免疫反應和免疫檢查點阻斷(ICB)治療相結合,可以攻擊全身擴散的轉移性癌細胞,進而產生免疫記憶以抑制腫瘤復發。
因此,利用生物材料進行局部的免疫調節治療也被證明是改善治療響應和減少癌癥免疫治療副作用的一種有效策略。蘇州大學陳倩教授和劉莊教授合作,對利用生物材料進行輔助局部治療并增強抗癌免疫的最新進展、面臨的挑戰和未來機遇進行了綜述總結;并討論了這一領域發展前景以及臨床轉化的可能性。
QianChen, Zhuang Liu. et al. Local biomaterials-assisted cancer immunotherapy totrigger systemic antitumor responses. Chemical Society Reviews. 2019
https://pubs.rsc.org/en/content/articlelanding/2019/cs/c9cs00271e#!divAbstract
納米材料結合免疫阻斷劑或相關抗原
Nano Lett.:合成的高密度脂蛋白用于抑制肝癌生長并增強PD-1阻斷治療
不能進行手術治療的肝細胞癌(HCC)患者的長時間無進展生存期(PFS)是一個尚未解決的臨床難題。中科院上海藥物研究所李亞平研究員、張鵬程博士和吉林大學滕樂生教授合作制備了一種仿生納米平臺,即合成的高密度脂蛋白(sHDL),它可以將光熱劑DiR等藥物優先轉運到HCC細胞的胞漿中,從而在體內對HCC進行成像指導的聯合治療。
實驗通過單次注射證明了sHDLs可以緩解腫瘤生長并觸發免疫原細胞死亡(ICD),促進樹突狀細胞(DC)成熟,進而誘導CD8+ T細胞響應使得腫瘤對PD-1阻斷更加敏感。并且通過將DiR和干擾素基因激動劑vadimezan的刺激劑負載到sHDL上并結合PD-1阻斷試劑治療可以抑制腫瘤并實現免疫保護。而若用化療藥物mertansin替代vadimezan則可增強HCC細胞的ICD,但該藥物也會干擾DC的成熟和隨后的CD8+ T細胞啟動,導致疾病的控制效果不夠理想。
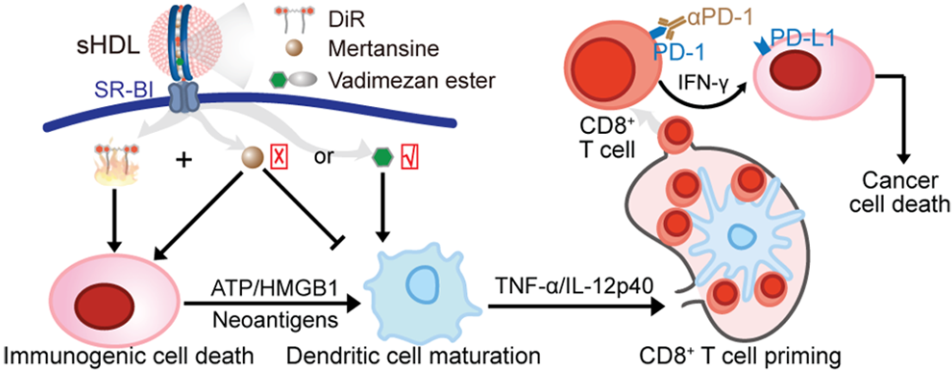
Junyang Wang, Lesheng Teng, Pengcheng Zhang, Yaping Li. et al. Hepatocellular Carcinoma Growth Retardation and PD1 Blockade Therapy Potentiation with Synthetic High-density Lipoprotein. Nano Letters. 2019
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01717
ACS Nano: 鐵磁渦旋納米環介導的微磁熱療對抗腫瘤轉移
癌癥轉移是導致其治療失敗的一個主要原因。中科院自動化研究所杜洋博士、田捷研究員、西北大學樊海明教授和國家納米科學中心梁興杰研究員合作報告了一種有效安全的納米治療策略,可以根除原發性腫瘤,并抑制其肺部轉移,進而控制遠處腫瘤的轉移和生長。
該鐵磁渦旋氧化鐵納米環(FVIO)介導的輕度磁熱療會導致4T1乳腺癌細胞鈣網蛋白(CRT)的表達。而CRT的表達會傳遞“吃我”的信號,進而促進免疫系統對癌細胞的吞噬吸收,誘導有效的免疫原性細胞死亡,并進一步導致巨噬細胞極化。這種溫和的熱療法可以有效增強遠處腫瘤的CD8+細胞毒性T淋巴細胞的浸潤,并有效地使腫瘤對PD-L1檢查點阻斷治療敏感而觸發免疫治療。而在與PD-L1阻斷治療進行結合后,CD8+細胞毒性T淋巴細胞的比例可進一步從55.4%提高到64.5%。此外,該聯合治療也可抑制腫瘤的免疫抑制反應,使得骨髓源性抑制細胞(MDSCs)顯著下調。這一研究結果表明,FVIO介導的溫和磁熱療法可以激活宿主免疫系統,并可通過與PD-L1阻斷試劑的有效合作以抑制遠處腫瘤的轉移擴散和生長。
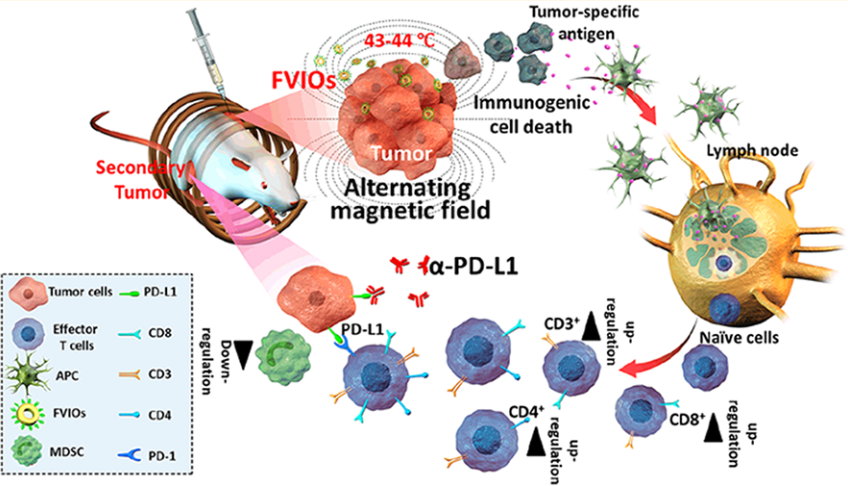
Xiaoli Liu, Yang Du, Haiming Fan, Jie Tian, Xing-Jie Liang. et al. Ferrimagnetic Vortex Nanoring-Mediated Mild magnetic Hyperthermia Imparts Potent Immunological Effect for Treating Cancer Metastasis. ACS Nano. 2019
https://pubs.acs.org/doi/10.1021/acsnano.9b01979
Nature Commun.:可穿過血腦屏障的納米材料用于誘導免疫反應治療膠質瘤
利用細胞毒性T淋巴細胞相關抗原4 (a-CTLA-4)和程序性細胞死亡-1 (a-PD-1)等檢查點抑制劑抗體去治療腦膠質瘤往往療效往往很差,這主要是由于它們不能跨越血腦屏障(BBB)。西達斯-西奈醫學中心Julia Y. Ljubimova團隊制備了一種在聚(β-L-蘋果酸) 支架上的納米免疫偶聯物材料(NICs),同時共價連接了a-CTLA-4和a-PD-1用于穿過BBB進行遞送并激活大腦局部的抗腫瘤免疫反應。
實驗發現,利用NICs治療小鼠GL261膠質母細胞瘤(GBM)后會導致腦腫瘤區CD8+ T細胞、NK細胞和巨噬細胞增多,而調節性T細胞(Tregs)則會減少。結果表明,利用NICs對GBM荷瘤小鼠進行聯合治療后,其效果也會明顯優于單一的檢查點抑制劑治療或游離的a-CTLA-4和a-PD-1治療。
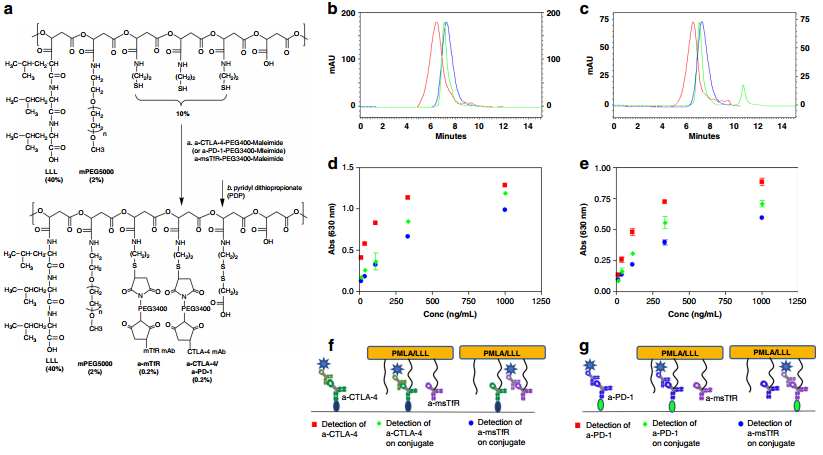
Anna Galstyan, Julia Y. Ljubimova. et al. Blood–brain barrier permeable nano immunoconjugates induce local immune responses for glioma therapy. Nature Communications. 2019
https://www.nature.com/articles/s41467-019-11719-3
Nat. Biotech.:NIR IIb區稀土納米顆粒用于體內分子成像和免疫治療
NIRIIb區 (NIR-IIb) (1500-1700 nm)激光對于實現哺乳動物的深組織光學成像來說是理想的選擇,但目前還缺乏高效和生物相容性較好的探針。斯坦福大學戴宏杰教授團隊開發了一種具有良好生物相容性的立方相(α-phase) 鉺基稀土納米顆粒(ErNPs),它具有高效的下轉換發光性能,可用于對癌癥免疫治療的小鼠進行動態成像。
實驗使用連有抗PD-L1抗體交聯親水聚合物層功能化的ErNPs對結腸癌小鼠的PD-L1進行分子成像,發現腫瘤與正常組織的信號比約為40。對PD-L1和CD8的體內NIR-IIb分子成像實驗表明,經免疫治療后的腫瘤微環境會存在細胞毒性T淋巴細胞,并且免疫激活后的腫瘤和脾臟中的CD8信號也會發生改變。
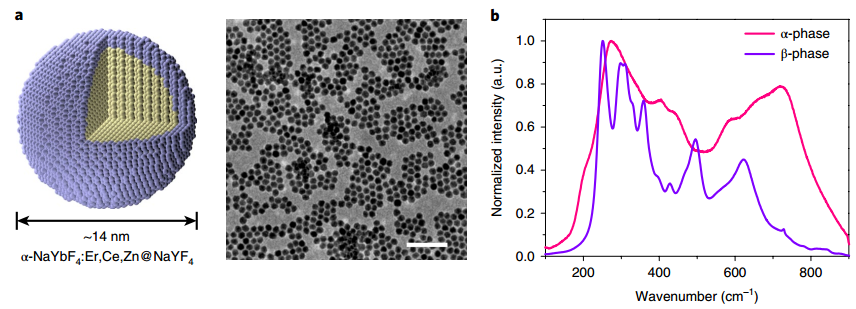
YetengZhong, Hongjie Dai. et al. In vivo molecular imaging for immunotherapy usingultra-bright near-infrared-IIb rare-earth nanoparticles. Nature Biotechnology. 2019
https://www.nature.com/articles/s41587-019-0262-4
Nano Lett.:康普瑞汀A4納米粒子聯合乏氧敏感的咪喹莫特應用癌癥治療
血管阻斷劑(VDAs)在癌癥治療中具有巨大的應用潛力。然而,VDAs除了具有使腫瘤血管塌陷的作用外還會激活宿主的免疫反應,從而顯著削弱其抗癌作用。吉林大學第一醫院陳京濤教授、中科院長春應化所湯朝暉研究員和陳學思研究員合作開發了一種VDA納米藥物CA4-NPs,它可誘導未成熟的漿細胞樣樹突狀細胞(pDCs)在瘤內的浸潤,從而抑制抗癌免疫。
為了解決這一問題,實驗將CA4-NPs與乏氧敏感的咪喹莫特(hs-IMQ)相聯合,它可在CA4-NPs誘導的硝基還原酶(NTR)的催化作用下被選擇性地激活為咪喹莫特(IMQ)。結果表明,hs-IMQ和CA4-NPs聯合后可使腫瘤中的活性IMQ濃度提高6.3倍,并改變腫瘤微環境使其從免疫抑制狀態變為免疫激活狀態。通過CA4-NPs和hs-IMQ聯合治療可協同抑制4T1荷瘤小鼠的腫瘤生長和轉移。這一工作也為利用瘤內pDCs來逆轉VDA治療引起的免疫抑制提供了新的方法,并為將VDAs與TLR激動劑聯合使用以觸發原位的免疫激活和增強抗癌效果提供了機制基礎。
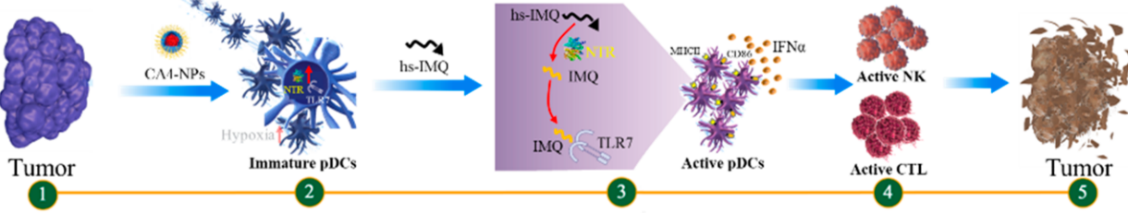
NaShen, Jingtao Chen, Zhaohui Tang, Xuesi Chen. et al. Combretastatin A4Nanoparticles Combined with Hypoxia-Sensitive Imiquimod: A New Paradigm for theModulation of Host Immunological Responses during Cancer Treatment. Nano Letters. 2019
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03214
光與免疫治療
近紅外I區光
Nano Lett.:在細胞內產生的金納米粒子用于光熱治療和腫瘤免疫治療
目前,金納米粒子(AuNP) 被廣泛應用于腫瘤的光熱治療(PTT),但其效果還不足以抑制腫瘤的轉移和復發。華中科技大學張志平教授團隊開發了一種在細胞內生成的AuNP并通過胞吐作用以實現PTT-免疫治療。
實驗首先利用黑色素瘤B16F10細胞去產生AuNPs,然后將捕獲有帶著腫瘤抗原的納米顆粒的囊泡脫落到細胞外環境中。實驗隨后將該納米顆粒引入樹突狀細胞(DCs)中以產生AuNP@DCB16F10,它具有更高的生物安全性,可以誘導進行熱療和引發抗腫瘤的免疫反應。研究結果表明。該免疫納米平臺能夠有效抑制甚至根除原發腫瘤、并防止腫瘤的轉移和復發,進而顯著提高荷瘤小鼠的整體存活率。
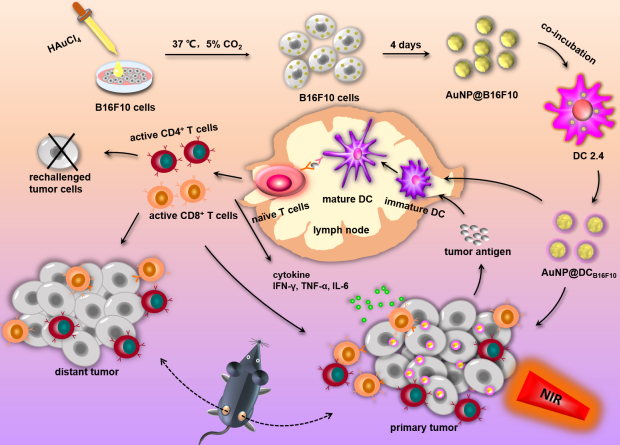
Dan Zhang, Zhiping Zhang. et al. Intracellularly Generated Immunological Gold Nanoparticles for Combinatorial Photothermal Therapy and Immunotherapy against Tumor. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b02903
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02903
AM:光誘發的納米藥物用于提高遞送效果和增強癌癥免疫治療
通過全身給藥的方式進行的化學-免疫治療往往存在著腫瘤特異性低、副作用嚴重等諸多問題。盡管目前利用納米顆粒進行協同遞送的策略可以對其進行改善,但實體腫瘤的病理生理屏障還是會影響載藥納米顆粒的積累和滲透腫瘤的效果。中科院上海藥物研究所于海軍研究員和李亞平研究員合作報道了一種光誘發的免疫治療納米藥物(LINC)。LINC由光敏劑脫鎂葉綠酸 a (PPa)和吲哚胺2,3-雙加氧酶1 (IDO-1)抑制劑NLG919構建的異二聚體以及光激活前藥奧沙利鉑(OXA)所組成。
在被靜脈注射后,LINC會在腫瘤部位積累并產生近紅外(NIR)熒光信號。而在熒光成像的指導下,利用第一次近紅外激光照射會誘導生成活性氧(ROS)并使得聚乙二醇(PEG)冠層發生裂解,從而提高LINC在腫瘤的保留和穿透的效果。而在第二次近紅外激光的照射下,LINC可以有效地激發免疫反應,促進細胞毒性T淋巴細胞(CTL)在腫瘤內的浸潤。此外,LINC還可以由NLG919去抑制IDO-1的活性進而逆轉免疫抑制的腫瘤微環境,因此LINC可以通過化學-免疫聯合治療抑制腫瘤的生長、肺轉移和復發。
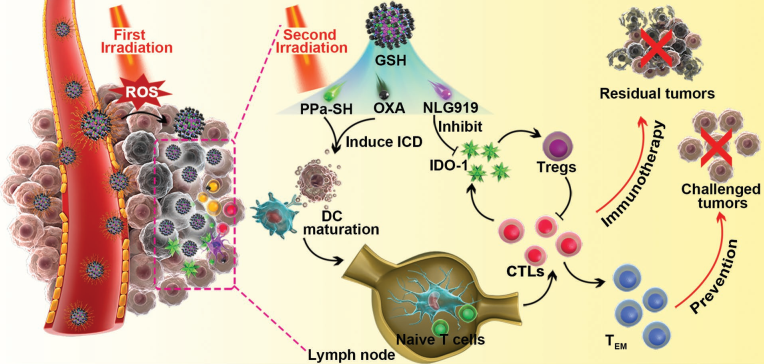
Bing Feng, Haijun Yu, Yaping Li. et al. Self-Amplified Drug Delivery with Light-Inducible Nanocargoes to Enhance Cancer Immunotherapy. Advanced Materials. 2019
DOI: 10.1002/adma.201902960
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902960
AM:利用聚多巴胺包封的核殼上轉換納米顆粒激活抗腫瘤免疫和抗腫瘤轉移
協同性光學治療可以有效克服腫瘤的異質性和復雜性,因此它比單模態的光動力治療(PDT)或光熱治療(PTT)有著更好的癌癥治療效果。然而,以往將PDT和PTT相結合的方法都主要致力于治療原發腫瘤而忽略了腫瘤轉移這一過程。華中科技大學劉筆鋒教授、深圳大學王瑀博士和劉小剛教授合作制備了一種上轉換-聚合物混合型納米顆粒,并在其表面負載光敏劑Ce6用于實現PDT和PTT聯合治療,該策略不僅可以治療原發腫瘤,也能通過激活抗腫瘤免疫響應來對抗腫瘤的轉移。
研究表明,在聚合物內核上的上轉換材料可以確保在單次近紅外光照射下進行充分的光吸收以產生活性氧,并且這種協同性光學治療還能夠誘導產生全身抗腫瘤免疫反應,將其與免疫檢查點阻斷治療相聯合后可有效抑制兩種腫瘤轉移模型荷瘤小鼠的腫瘤復發和轉移,并延長荷瘤小鼠的生存期。
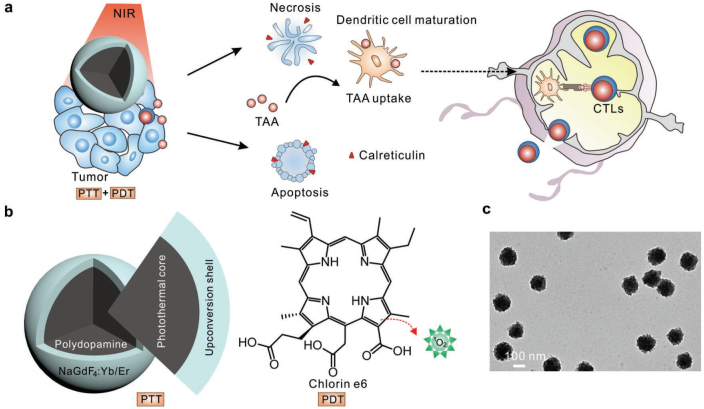
ShuangqianYan, Bi-Feng Liu, Yu Wang, Xiaogang Liu. et al. Activating Antitumor Immunityand Antimetastatic Effect Through Polydopamine-Encapsulated Core–Shell UpconversionNanoparticles. Advanced Materials. 2019
https://onlinelibrary.wiley.com/doi/10.1002/adma.201905825
近紅外II區光
Angew:人工酶催化級聯反應用于NIR II光增強的抗腫瘤免疫治療
腫瘤的轉移和復發是當前腫瘤治療所面臨的一個嚴峻挑戰。而有望解決這一問題的重要策略就是實現抗腫瘤免疫。但是腫瘤的免疫抑制狀態也嚴重影響了免疫治療的效果。中南大學陳萬松博士和劉又年教授合作提出了一種將基于人工酶的催化級聯反應用于免疫治療的新策略。
Cu2-xTe納米粒子在近紅外(NIR II)光下具有可調的模擬酶活性(谷胱甘肽氧化酶和過氧化物酶),它所催化的級聯反應會逐漸升高腫瘤內的氧化應激,從而誘導免疫原性細胞死亡。同時,Cu2-xTe人工酶還可以通過持續產生氧化應激來逆轉免疫抑制的腫瘤微環境,增強抗腫瘤免疫反應,進而根除原發和遠處轉移的腫瘤。實驗結果表明,經Cu2-xTe人工酶治療的小鼠可以成功獲得抑制腫瘤復發的免疫記憶效應。
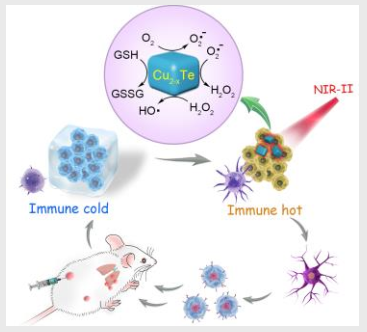
Mei Wen, Wansong Chen, You-Nian Liu. et al. Artificial Enzyme-Catalyzed Cascade Reactions for Antitumor Immunotherapy Reinforced by NIR-II Light. Angewandte Chemie International Edition. 2019
https://onlinelibrary.wiley.com/doi/10.1002/anie.201909729
ACS Nano:近紅外II光學治療可誘導免疫原性細胞死亡以增強腫瘤免疫治療
實體瘤的深層和內層缺乏淋巴細胞浸潤,受多種免疫逃逸機制的影響。逆轉腫瘤內部的免疫抑制在臨床癌癥治療中至關重要,但仍是一個巨大的挑戰。合肥工業大學王峰教授和中科大王育才教授合作利用近紅外(NIR) II光熱治療來觸發實體腫瘤中更均勻和更深層次的免疫原性癌細胞死亡,從而引發產生先天和適應性免疫反應來控制腫瘤和預防轉移。實驗通過控制金納米顆粒在流態脂質體上的自組裝過程,構建了具有相似組分、結構和光熱轉換效率,但在紅光、NIR I和NIR II區吸收能力不同的光熱轉化材料。
體外實驗表明,光熱治療可以誘導免疫原性細胞死亡(ICD),同時釋放損傷相關分子模式(DAMPs)。而在體內,NIR II光可使腫瘤深部的DAMPs釋放和分布地更加均勻。隨著ICD的產生,NIR II光熱療法可同時觸發先天和適應性免疫反應,使大部分小鼠在癌癥疫苗接種實驗中保持無腫瘤生長。并且,將NIR II光熱治療和檢查點阻斷治療相聯合也可對原發性和遠端腫瘤產生長期的腫瘤控制作用。實驗進一步利用二維聚吡咯納米片作為NIR II光熱轉換材料,證明了它可以通過光熱-免疫協同治療來有效對抗全身的腫瘤轉移。
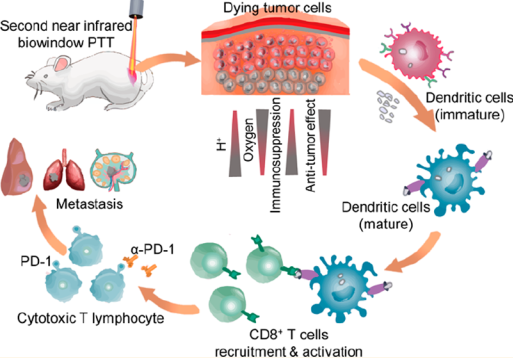
Yinchu Ma, Feng Wang, Yucai Wang. et al. Near-Infrared II Phototherapy Induces Deep Tissue Immunogenic Cell Death and Potentiates Cancer Immunotherapy. ACS Nano. 2019
https://pubs.acs.org/doi/10.1021/acsnano.9b06040
放射療法聯合免疫療法
AM:將輻射和細菌膜包覆的納米顆粒相結合用于開發原位癌癥疫苗
通過隨機突變和特異性誘導所產生的新抗原是一種可被T細胞識別的腫瘤抗原。而在免疫冷性腫瘤中,腫瘤新抗原的識別能力有限,這也使得無法產生有效的抗腫瘤免疫反應。而且這些冷性腫瘤對包括免疫檢查點抑制劑(ICIs)在內的大多數免疫治療都響應不佳。放射治療(RT)可以增強對冷腫瘤的免疫識別,從而產生更加多樣化的抗腫瘤T細胞反應,但單獨依靠RT還無法誘導產生全身的抗腫瘤免疫反應。
威斯康星大學宮紹琴教授和Zachary S. Morris博士合作制備了一種由免疫激活的PC7A/CpG內核和包裹的細菌膜以及亞胺基團組成的多功能納米顆粒(BNP)。這種BNP可在放療后捕獲腫瘤新抗原,增強其在樹突狀細胞(DC)中的攝取,從而刺激抗腫瘤T細胞反應的發生。實驗在患有同基因黑色素瘤和神經母細胞瘤的小鼠模型上證明,BNP+RT聯合治療可通過激活樹突狀細胞和效應T細胞顯著地抑制腫瘤生長,并產生腫瘤特異性的抗腫瘤免疫記憶。
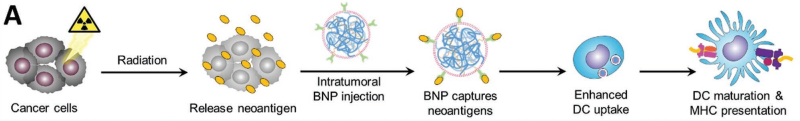
Ravi B. Patel, Shaoqin Gong, Zachary S. Morris. et al. Development of an In Situ Cancer Vaccine via Combinational Radiation and Bacterial-Membrane-Coated Nanoparticles. Advanced Materials. 2019
DOI: 10.1002/adma.201902626
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902626
Matter:超薄金屬有機層介導的放射動力療法增強免疫治療
近日,林文斌課題組首次報道了基于直線型卟啉基橋連配體與重金屬鉿-氧團簇作為金屬節點的nMOL用于增強放射-放射動力治療并證明了nMOL增強的局部治療可通過高效地引發免疫原性細胞死亡,提高腫瘤炎性,激活系統免疫,進而協同增強系統性免疫檢查點阻斷治療。在具有肺轉移能力的三陰性乳腺癌模型上,研究人員觀察到聯合療法有效緩解脾臟腫大,進而發現聯合治療組可有效降低脾臟,骨髓與肺內的粒細胞型髓源抑制細胞(granulocytic myeloid-derived suppressor cells, gMDSCs),阻遏遠端的間質-上皮轉化過程(MET)從而抑制遠端轉移灶的形成。
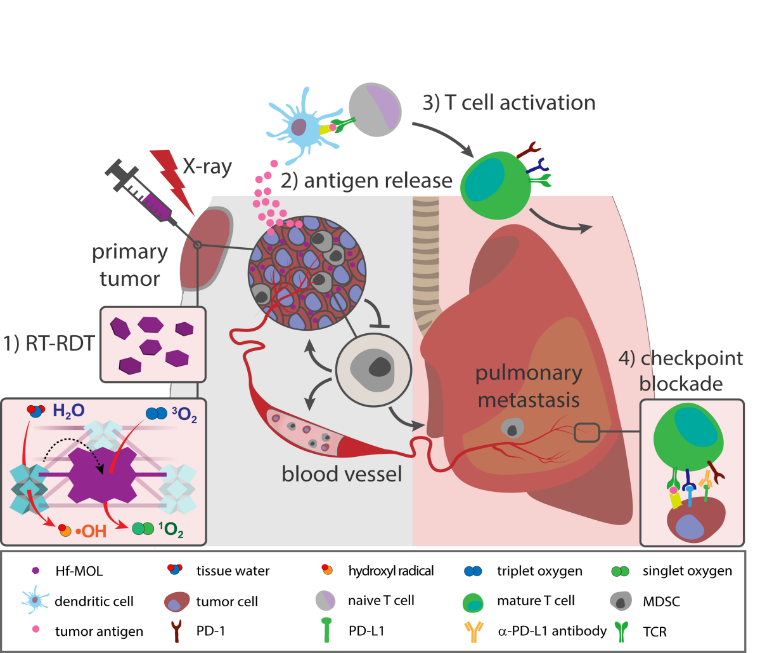
Kaiyuan Ni, Guangxu Lan, Christina Chan, Xiaopin Duan,Nining Guo, Samuel S. Veroneau, Ralph R. Weichselbaum, Wenbin Lin. Ultrathin metal-organic layer-mediated radiotherapy-radiodynamic therapy enhances immunotherapy of metastatic cancers, Matter.2019.
https://www.sciencedirect.com/science/article/pii/S2590238519300591
Matter:Cerenkov發光釋放NO以增強放射性同位素-免疫治療
蘇州大學劉莊課題組將抗高血壓藥物硝普鈉(Na2Fe(CN)5NO)作為NO供體與Zn2+混合,通過微乳化方法構建了厚度小于1nm的二維納米片(ZnNO納米片)。然后,通過與32PO43-陰離子簡單混合,得到ZnNO(32P)納米片。具有β射線發射的32P有效地活化了水以生成強烈的切倫科夫發光(CL),隨后刺激納米片釋放持久性NO。NO的釋放不僅通過抑制HIF-1-α表達并緩解腫瘤缺氧來增強放射性同位素治療的療效,而且還調節免疫抑制TME以利于抗腫瘤免疫。因此,該研究開發了一種獨特類型的生物相容性2D納米片,可通過調節不利的TME進行增強的RT-ICB聯合治療。
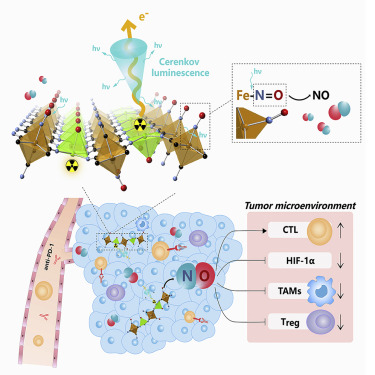
Longlong Tian, Yaxing Wang, Lele Sun, Jun Xu, Yu Chao, Kai Yang, Shuao Wang, Zhuang Liu, Cerenkov Luminescence-Induced NO Release from 32P-Labeled ZnFe(CN)5NO Nanosheets to Enhance Radioisotope-Immunotherapy. Matter 2019, 1 (4), 1061 - 1076.
https://doi.org/10.1016/j.matt.2019.07.007
納米材料自身誘導免疫反應
AM :NaCl納米粒子也可用于癌癥治療!
在現今的科研領域,已制備合成了許多無機納米粒子,并對其在生物系統中的行為進行了研究。然而,像NaCl這樣的普通電解質卻被排除在這一領域之外。常規的猜想是電解質納米粒子與其組成鹽具有類似的行為,能迅速溶解于水中。在此,美國佐治亞大學Jin Xie研究團隊打破了這種先入為主的觀念。證實NaCl納米粒子(SCNPs)(非鹽)對癌細胞具有高度毒性。這是因為SCNPs通過內吞作用進入細胞,繞過了細胞對離子轉運的調節,當SCNPs在癌細胞內溶解時,會引起滲透壓的激增和細胞的快速溶解。
有趣的是,由于正常細胞的鈉含量相對較低,它們對這種治療更有抵抗力。與傳統化療不同,與傳統的化學療法不同,SCNPs是導致免疫原性細胞死亡或ICD。體內研究表明,SCNPs不僅能殺死癌細胞,還能增強抗癌免疫。這一發現為納米粒子用于治療開辟了一個全新的視角。
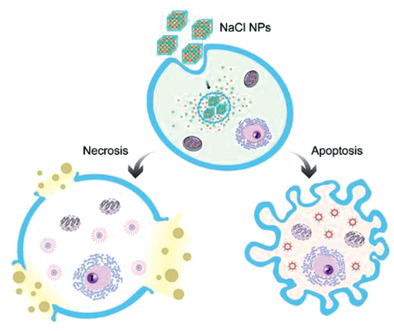
Wen Jiang, Xiaozhong Yu, Jin xie, et al. NaCl nanoparticles as a cancer therapeutic. Adv. Mater., 2019.
https://doi.org/10.1002/adma.201904058
Science Advances:納米紅細胞增強癌癥免疫療法
蘇州大學汪超教授、劉莊教授、加州大學洛杉磯分校顧臻教授等人報道了一種基于紅細胞膜和aPDL1阻斷劑的組合癌癥疫苗,利用受損的RBC將腫瘤相關抗原(TAAs)輸送至關鍵的次級淋巴器官的APCs,可有效增強癌癥免疫療法。
研究人員通過將腫瘤細胞膜相關抗原與納米紅細胞融合在一起,將腫瘤抗原加載到納米紅細胞上。這種載有腫瘤抗原的納米紅細胞體(nano-Ag@erythrosome)在體內引起抗原反應,并與抗程序性死亡配體1(PD-L1)阻斷相結合,抑制了B16F10和4T1腫瘤模型中的腫瘤生長。在生成的一個腫瘤模型中顯示通過融合紅細胞和手術切除的腫瘤可以實現“個性化nano-Ag@erythrosome”,從而有效地減少了手術后的腫瘤復發和轉移。
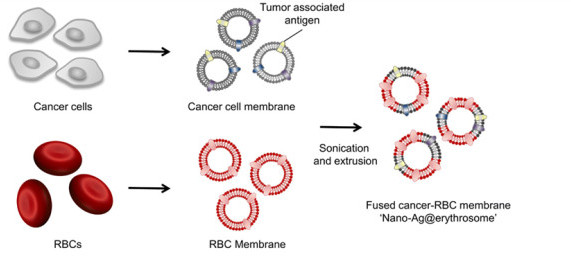
Han, X.; Shen, S.; Fan, Q.; Chen, G.; Archibong, E.; Dotti, G.; Liu, Z.; Gu, Z.; Wang, C., Red blood cell–derived nanoerythrosome for antigen delivery with enhanced cancer immunotherapy. Science Advances2019, 5 (10), eaaw6870.
https://advances.sciencemag.org/content/5/10/eaaw6870
Nature Biotech.:雜環脂質mRNA疫苗激活免疫細胞提高抗腫瘤功效
麻省理工大學Robert Langer教授和Daniel G. Anderson教授團隊對可同時介導mRNA傳遞并通過STING途徑提供靶向佐劑刺激的脂質進行系統研究。研究團隊通過使用一步法三組分反應(3-CR)開發合成多樣性的脂質結構,并發現具有環狀氨基頭部基團的脂質可激活STING途徑。另外,將可激活STING的環狀脂質與mRNA結合以配制脂質納米顆粒(LNP),來改善細胞內在化,從而進一步改善STING途徑的細胞內激活。
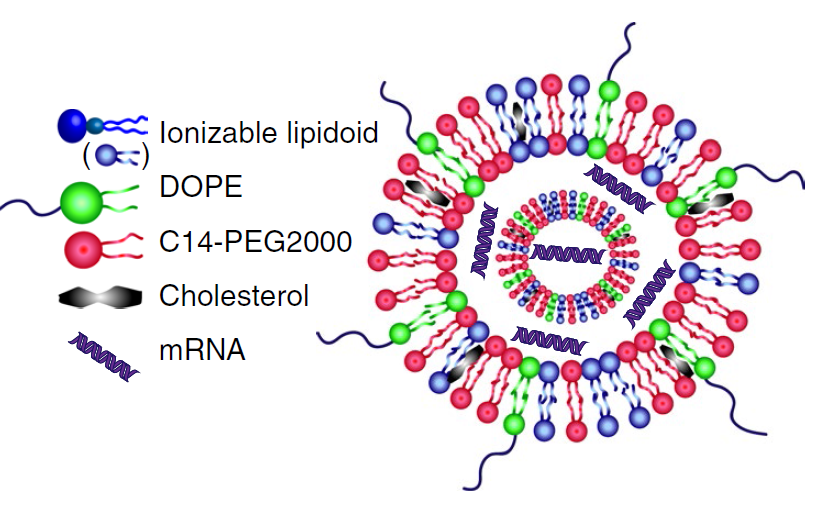
Miao, L.; Li, L.; Huang, Y.; Delcassian, D.; Chahal, J.; Han, J.; Shi, Y.; Sadtler, K.; Gao, W.; Lin, J.; Doloff, J. C.; Langer, R.; Anderson, D. G., Delivery of mRNA vaccines with heterocyclic lipids increases anti-tumor efficacy by STING-mediated immune cell activation. Nature Biotechnology 2019, 37 (10), 1174-1185.
https://doi.org/10.1038/s41587-019-0247-3
其他
AM:人造的自然殺傷細胞用于特異性腫瘤抑制和巨噬細胞再教育
自然殺傷(NK)細胞不僅能識別和消除異常細胞,還能對免疫細胞進行募集和再教育以保護宿主。然而,NK細胞的功能在免疫抑制的腫瘤微環境(TME)中往往會受到限制。武漢大學張先正教授團隊設計了一種人造的NK細胞(aNK),TME對aNK的限制作用很低,且它可以對巨噬細胞進行再教育以抑制腫瘤。
實驗利用血紅細胞膜(RBCM)去包裹全氟正己烷(PFC)和葡萄糖氧化酶(GOX)構建了aNK。Ank可通過消耗葡萄糖和生成過氧化氫(H2O2)來直接殺死腫瘤細胞。并且生成的H2O2也可作為細胞因子和趨化因子來募集免疫細胞,并對存活的巨噬細胞進行再教育,使其攻擊腫瘤細胞。此外,載氧的PFC可以增強GOX的催化反應,改善乏氧的TME。體內外實驗結果表明,aNK具有很好的腫瘤抑制和免疫激活作用。
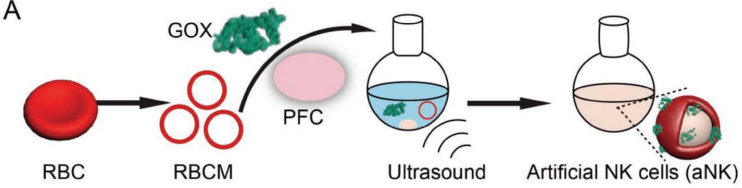
Mei-ZhenZou, Xian-Zheng Zhang. et al. Artifcial Natural Killer Cells for Specific TumorInhibition and Renegade Macrophage Re-Education. AdvancedMaterials. 2019
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904495
AM:胞內/胞外乳酸耗竭協同代謝治療與腫瘤免疫治療
調節腫瘤微環境(TME)已成為提高抗腫瘤治療水平的一種新型策略。在此,武漢大學張先正研究團隊構建了一個嵌入乳酸氧化酶(LOX)和糖酵解抑制劑(PMLR)的紅細胞膜(mRBC) 偽裝的中空MnO2(HMnO2)催化納米系統,用于細胞內/細胞外乳酸耗竭以及協同代謝治療和腫瘤免疫治療。受益于mRBC的長循環特性,此納米系統可以通過增強的通透性和滯留(EPR)效應在腫瘤部位逐漸積累。胞外納米系統通過LOX催化氧化反應,消耗TME中的乳酸。同時,胞內納米系統釋放糖酵解抑制劑,切斷乳酸來源,并通過阻斷三磷酸腺苷(ATP)的供應實現抗腫瘤代謝治療。在PMLR納米系統催化內源性H2O2分解過程中產生的O2對胞內胞外過程都有敏化作用。研究表明,PMLR納米系統能夠不斷去除乳酸,從而產生具有免疫活性的TME。此外,這種TME調節策略可有效提高抗PD-L1治療的抗腫瘤效果,而無需使用任何免疫激動劑來避免自身免疫。
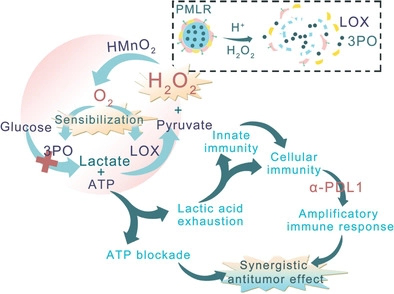
Fan Gao, Ying Tang, Wen-Long Liu, et al. Intra/Extracellular Lactic Acid Exhaustion for Synergistic Metabolic Therapy and Immunotherapy of Tumors. Adv. Mater., 2019.
https://doi.org/10.1002/adma.201904639
Nature Commun.:負載mRNA的納米載體對巨噬細胞進行基因編程對抗腫瘤
腫瘤相關巨噬細胞(TAMs)通常表現為M2表型,這使得它們會產生免疫抑制并促進腫瘤生長。而若將這些TAMs重編程為M1表型則可以阻止它們的促癌活性并實現抗腫瘤免疫,但要實現這一目標往往也會引發是非特異性的系統性炎癥。美國弗雷德?哈欽森癌癥研究中心M.T. Stephan團隊制備了一種納米載體,它可以在不引起全身毒性的情況下,通過靶向遞送體外轉錄的mRNA來對TAMs進行重編程。
實驗在卵巢癌、黑色素瘤和膠質母細胞瘤模型上證明了通過注射負載干擾素調節因子5的mRNA的納米粒子可以活化激酶IKKβ來逆轉TAMs的免疫抑制和促腫瘤功能,并可對TAMs進行重編程使其具有抗腫瘤免疫的活性。研究進一步表明,這種納米試劑可以被安全地重復給藥,因此它有望在臨床應用中實現不破壞免疫穩態的全身治療。
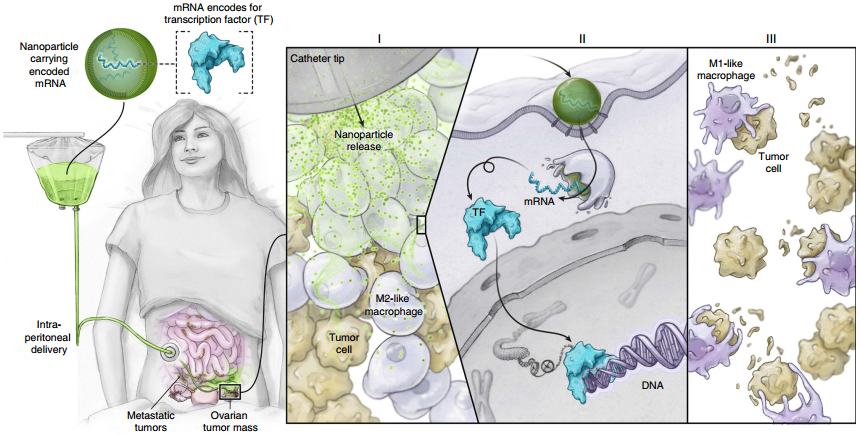
F.Zhang, M.T. Stephan. et al. Genetic programming of macrophages to performanti-tumor functions using targeted mRNA nanocarriers. NatureCommunications. 2019
https://www.nature.com/articles/s41467-019-11911-5











