
第一作者:Chang liu、Bei Liu、Jian Zhao
通訊作者:趙宇亮、李樂樂
通訊單位:國家納米科學中心
研究亮點:
1. 設計了一種可用于近紅外光觸發、線粒體靶向PDT的Nd3+敏化上轉換MOFs(UCMTs)。
2. 使用808 nm光可以有效地避免激光輻照引起的熱效應。
3. 近紅外光觸發線粒體中ROS的原位產生,可引起線粒體膜去極化和促凋亡蛋白的胞漿釋放,從而達到放大療效的目的。
背景簡介:
由金屬離子和有機連接物的配位驅動組裝而成的金屬-有機框架(MOFs)在納米醫學領域表現出巨大的潛力。卟啉納米MOFs(nMOFs) 作為一種相當有應用前景的光動力療法(PDT)納米光敏劑(nPSs),近年來被廣泛研究。然而,基于nMOF的PDT系統的體內應用受到激發卟啉所需的紫外線(UV)/可見光的淺組織穿透的限制。此外,這些系統缺乏對光動力效應的空間控制,因此治療效率有限。為了解決這些問題,將近紅外(NIR)光激活nMOFs技術與精確的空間控制技術相結合,是下一代PDT系統的發展方向。
線粒體作為細胞的動力源和自殺武器儲藏庫,調節著從生物合成、信號傳導到凋亡等多種生物學過程。越來越多的證據表明線粒體穩態在癌癥生物學中起著關鍵作用,如癌癥的發生、生長和轉移。近年來,線粒體正逐漸成為癌癥的潛在治療靶點,尤其是調節線粒體中ROS水平可以激活細胞死亡機制,,然而,如何有效地調控線粒體ROS的動態平衡目前仍是一個挑戰。
成果介紹:
作為光學納米轉換器,摻雜鑭系元素的上轉換納米顆粒(UCNPs)可以在低能量近紅外光(通常約980 nm)的激發下發射高能紫外光或可見光,這對近紅外介導的光調節應用顯示出日益增長的前景,包括操縱生物傳感、神經活性和生物醫學。
受此啟發,國家納米中心趙宇亮、李樂樂等人設計了一種可用于近紅外光觸發、線粒體靶向PDT的Nd3+敏化上轉換MOFs(UCMTs)。UCMTs具有由Nd3+敏化的UCNPs和卟啉nMOsF組成的Janus納米結構,并進一步用三苯基膦(TPP,一種線粒體靶向配體)進行表面功能化。UCMTs通過從Nd3+敏化的UCNP到MOF結構域的有效共振能量轉移,實現了808近紅外光激活ROS的產生。值得注意的是,使用808 nm光可有效地避免激光輻照引起的熱效應,因為生物組織在此近紅外波長的吸收最小。此外,近紅外光觸發線粒體中ROS的原位產生,可引起線粒體膜去極化和促凋亡蛋白的胞漿釋放,從而實現療效放大。
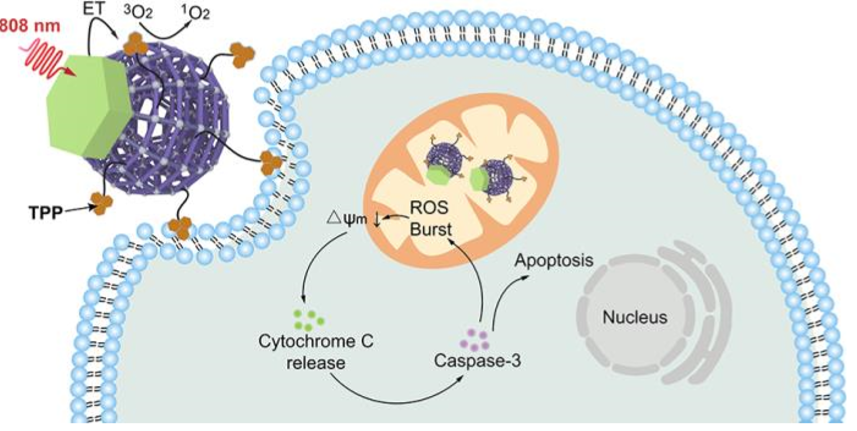
圖1. UCMTs作用機理
要點1:UCMTs的制備
通過三步法制備UCMTs:合成雙殼UCNPs,卟啉nMOFs在其表面的各向異性生長,以及TPP的進一步表面修飾。采用改進的熱分解方法首先制備了平均直徑約20 nm的NaGdF4:Yb,Er核,通過外延生長法在其表面生長Nd3+/Yb3+結合殼層(NaGdF4:Nd,Yb)。然后,將純NaGdF4殼層涂覆在NPs上,通過防止表面相關的猝滅效應來提高上轉換發光(UCL)效率,由此得到的核-殼-殼UCNPs的平均直徑約為32 nm。接下來,用聚乙烯吡咯烷酮(PVP)對UCNPs進行修飾,以在其表面選擇性生長Zr基MOFs(以制備UCMs)。最后,通過TPP的羧基與MOF結構域表面Zr6簇中的不飽和金屬位點的配位相互作用,將TPP分子修飾到Janus UCMs的表面上。
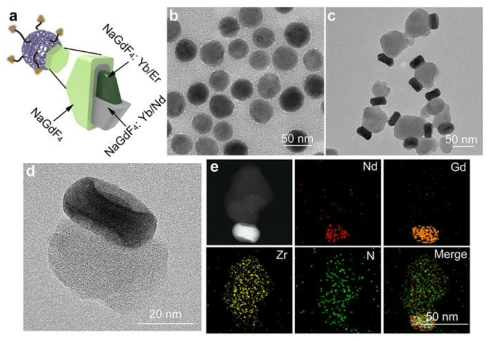
圖2. UCMT Janus納米結構
要點2:證明UCMTs在808 nm近紅外光照下激活產生ROS
Nd3+/Yb3+/Er3+級聯敏化的核-殼-殼UCNPs在808 nm激發下用作PDT的能量供體。Nd3+的初級敏化劑在808 nm處吸收光子,而Yb3+作為從Nd3+到Er3+發射器的能量傳遞的橋離子。Janus-UCMTs的光譜重疊和兩個結構域之間的近距離可以促進UCNP側到MOFs結構域的發光共振能量轉移(LRET)。在UCNPs上生長MOF后,UCL的發射強度和壽命都顯著降低,表明Janus納米結構中存在有效的LRET。為了評價光動力性能,使用了1O2指示劑(SOSG)。在808 nm激光照射下,觀察到UCMTs在528 nm處SOSG的熒光顯著增加。與此相反,未經近紅外輻射的UCMTs沒有顯示出明顯的熒光變化。作為對照,MOF NPs和UCNPs的混合溶液在808 nm近紅外輻射下不能產生1O2,證實了Janus結構對于近紅外光觸發1O2產生的重要性。此外,在近紅外輻射下的UCMTs的電子自旋共振(ESR)譜中觀察到特征的1O2誘導信號。這些數據表明,UCMTs內部的有效能量轉移使得MOF能夠在808 nm近紅外光照射下激活產生ROS。
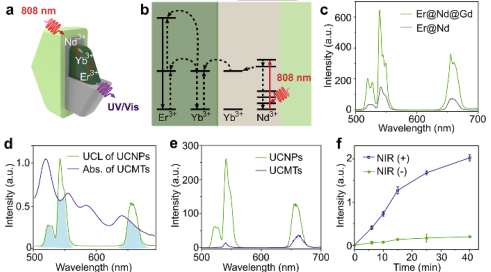
圖3. Er@Nd@Gd的結構和能量傳遞機制
要點3:驗證UCMTs的線粒體靶向以及激活ROS能力
為了驗證UCMTs的線粒體靶向能力,以UCMs為對照,在4T1細胞中進行了共定位實驗。實驗結果表明TPP配體可以有效推動UCMTs向線粒體的積累。此外,與對照UCMTs和UCMs+NIR組相比,UCMTs+NIR處理的細胞中線粒體介導的凋亡基因(BAD,BAX,BAK和NOXA)的表達上調,證實了線粒體介導的凋亡機制。總之,UCMTs實現了808近紅外光觸發1O2釋放到線粒體中,并導致MMP的去極化,使線粒體凋亡因子釋放到細胞質中,激活caspase-3,最終放大細胞凋亡。
目前基于UCNP的PDT系統通常使用980 nm近紅外光作為激發源,但由于其加熱效應,組織損傷的風險很高。為了研究近紅外對組織的加熱效應,用不同功率的980 nm和808 nm激光照射小鼠皮膚,實時測量皮膚溫度。用808 nm激光照射10min后,照射區域的溫度沒有明顯變化,而在980 nm激光照射下,溫度從25.0℃上升到31.8℃,這些結果表明,808 nm激光具有比980 nm激光低得多的過熱效應,可以更好地應用于PDT。
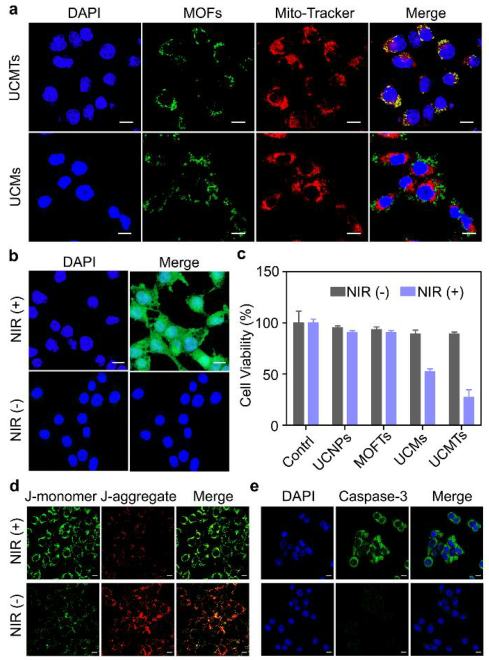
圖4. 細胞實驗結果
要點4:體內評估UCMTs用于808 nm光觸發放大癌癥治療效果
分別用UCMs、UCMTs或生理鹽水對4T1荷瘤小鼠進行治療,注射后2h給予近紅外激光照射。治療后14天,所有組均未顯示出明顯的體重減輕。在沒有近紅外輻射的情況下,UCMs或UCMTs處理的小鼠的腫瘤生長速度與生理鹽水處理組相似,表明這兩種NPs都沒有治療作用。在近紅外照射下,UCMs處理的小鼠腫瘤生長延遲;與此相反,UCMTs+NIR處理組在14天的觀察期內對腫瘤生長表現出更強的抑制作用,表明線粒體靶向能力的引入增強了PDT的療效。H&E染色顯示,UCMTs處理組的細胞壞死和凋亡比UCMs處理的近紅外輻射小鼠更明顯。TUNEL分析還顯示,UCMTs+NIR處理組比其他組誘導更多的凋亡細胞。

圖5. 體內評估UCMTs腫瘤治療效果
小結:
綜上所述,趙宇亮和李樂樂研究團隊設計并合成了一種基于卟啉MOFs和UCNPs結合線粒體靶向策略的近紅外光激活PDT納米平臺。在Janus UCMTs中,由于Nd3+敏化的上轉換過程和從UCNP到MOF結構域的有效能量轉移,納米平臺實現了用808nm的激光產生1O2,以最小化激光輻照引起的過熱效應。更重要的是,線粒體靶向的PDT誘導了內源性凋亡途徑的啟動,從而導致了比非靶向治療更好的治療效果。這項工作通過引入Nd3+致敏的上轉換技術和線粒體靶向工具展示了基于MOF的PDT的有效策略。
參考文獻:
Chang Liu, Bei Liu, Jian Zhao, et al. Nd3+‐Sensitized Upconversion Metal‐Organic Frameworks for Mitochondria‐Targeted Amplified Photodynamic Therapy. Angew. Chem. Int. Ed., 2019.
https://doi.org/10.1002/anie.201911508











