本文聯合發表于NanoLabs微信公眾號
NanoLabs(ID:NanoLabs)
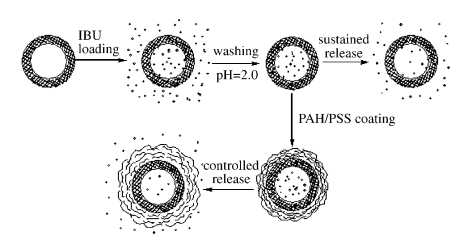
施劍林,1989年畢業于中國科學院上海硅酸鹽研究所,現任上海硅酸鹽研究所研究員,博士生導師,國家杰出青年基金獲得者,教育部“長江學者”特聘教授,曾擔任國家973項目首席科學家,2019年當選中國科學院院士。施劍林研究員長期從事介孔和其他無機納米結構與材料的設計、可控合成及其在能源/環境催化和生物醫學領域應用的基礎研究。課題組目前主要研究方向包括:1)介孔與其他無機納米材料的設計、可控合成及物化性能 現對施劍林院士課題組歷年來最高被引的部分文章進行介紹,供大家學習交流。(本文數據以Web of Science為參考,如有疏漏或錯誤,歡迎指正)1. Angew:中空介孔SiO2球/多層聚電解質核-殼結構對藥物的刺激響應控制釋放丨被引820次保持藥物的可控性:水熱穩定的中空介孔二氧化硅球具有很高的藥物儲存能力,包裹在硅球上的多層聚電解質可作為藥物釋放的開關,而藥物的釋放受pH或離子強度控制。下圖展示了在有或沒有聚苯乙烯磺酸鈉(PSS)和聚烯丙胺鹽酸鹽(PAH)包裹下,布洛芬(IBU)在硅球中的釋放行為。
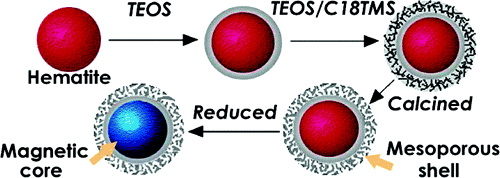
Zhu, Y., Shi, J., Shen, W., Dong, X., Feng, J., Ruan, M. and Li, Y. (2005), Stimuli‐Responsive Controlled Drug Release from a Hollow Mesoporous Silica Sphere/Polyelectrolyte Multilayer Core–Shell Structure. Angewandte Chemie International Edition, 44: 5083-5087.https://doi.org/10.1002/anie.2005015002. JACS: 磁芯/介孔二氧化硅殼結構均相磁性納米復合球的制備丨被引637次合成了一種新型的磁芯/介孔二氧化硅殼納米球,其平均粒徑約為270 nm。內部磁芯賦予整個納米顆粒以磁性,而外部中孔二氧化硅殼具有足夠大的比表面積和孔容。該材料有望用于靶向給藥和多相分離,并以布洛芬在介孔二氧化硅殼的孔道中的儲存和釋放為例進行了說明。
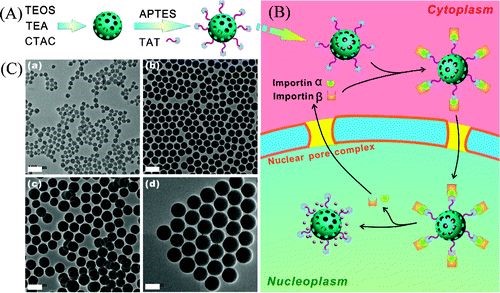
Zhao W, Gu J, Zhang L, Chen H, Shi J. Fabrication of Uniform Magnetic Nanocomposite Spheres with a Magnetic Core/Mesoporous Silica Shell Structure. Journal of the American Chemical Society. 2005;127(25):8916-7.https://doi.org/10.1021/ja051113r3. JACS:TAT肽結合單分散介孔二氧化硅納米粒用于核靶向給藥丨被引561次目前開發的大多數納米藥物遞送系統均靶向癌細胞,但很少靶向細胞核。然而,以核為靶標的藥物輸送有望更直接,更有效地殺死癌細胞。在這項工作中,施劍林研究員團隊首次將TAT肽與高載藥量的介孔二氧化硅納米粒子(MSNs-TAT)結合,用于核靶向藥物的遞送。研究人員合成了各種粒徑的單分散MSNs-TAT,以研究粒徑和TAT共軛對MSNs核膜穿透性的影響。直徑為50 nm或更小的MSNs-TAT可以有效地靶向細胞核,并將活性抗癌藥阿霉素(DOX)遞送到靶向細胞核中,從而以更高的效率殺死這些癌細胞。這項研究可為設計和開發細胞核靶向藥物輸送提供有效的策略。
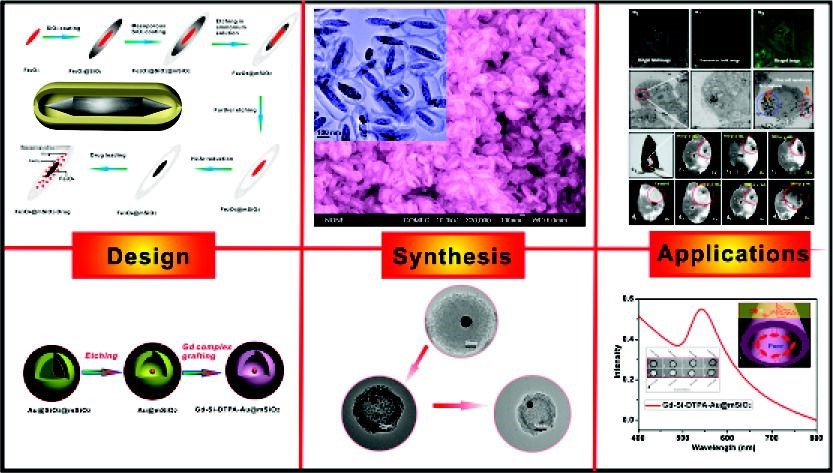
Pan L, He Q, Liu J, Chen Y, Ma M, Zhang L, et al. Nuclear-Targeted Drug Delivery of TAT Peptide-Conjugated Monodisperse Mesoporous Silica Nanoparticles. Journal of the American Chemical Society. 2012;134(13):5722-5.https://doi.org/10.1021/ja211035w4. ACS Nano:核/殼結構空心中孔納米膠囊用于細胞成像和抗癌藥物傳遞丨被引496次以功能性無機(Fe3O4、Au等)納米晶為核、薄型介孔二氧化硅殼和介孔間巨大空腔組成的均勻空心無機核/殼結構的多功能介孔納米膠囊,為同時進行抗癌藥物釋放和MRI細胞成像提供了一個潛在的平臺。在功能核和介孔二氧化硅殼之間形成巨大空腔的合成策略是利用基于結構差異的選擇性蝕刻方法,通過該方法,可以選擇性地刻蝕Fe2O3@SiO2@mSiO2(或Au@SiO2@mSiO2)復合納米結構的固體二氧化硅中間層,同時保持介孔二氧化硅殼的相對完整性。所獲得的多功能納米膠囊(Fe3O4@mSiO2)具有優異的生物相容性,其對各種細胞系的細胞毒性非常低,對人血紅細胞的溶血性較低,并且對血漿沒有明顯的凝血作用。采用激光共聚焦掃描顯微鏡和生物透射電鏡觀察納米膠囊對癌細胞的攝取和細胞內定位。重要的是,制備的多功能無機介孔納米膠囊由于空腔的形成、比表面積/孔體積的增大以及DOX分子與介孔二氧化硅表面的靜電相互作用,對阿霉素同時具有較高的載藥量(20%)和載藥率(100%)。此外,在體內和體外都證明了Fe3O4@mSiO2納米膠囊作為MRI造影劑的能力,表明了復合納米膠囊的同時成像和治療多功能性。此外,將多功能無機納米膠囊的概念擴展到設計和制備用于納米醫學應用的Gd-Si-DTPA接枝Au@mSiO2納米膠囊,進一步證明了該策略在制備各種多功能介孔納米膠囊方面的通用性。Chen Y, Chen HR, Zeng DP, Tian YB, Chen F, Feng JW, et al. Core/Shell Structured Hollow Mesoporous Nanocapsules: A Potential Platform for Simultaneous Cell Imaging and Anticancer Drug Delivery. Acs Nano. 2010;4(10):6001-13.https://doi.org/10.1021/nn1015117