
第一作者:Xie Xiaodong
通訊作者:賈力
通訊單位:福州大學
研究亮點:
1. 提出新概念,使用適配體修飾介孔硅納米粒子作為拖拉機特異性拖運致癌性外泌體至小腸進行排泄;
2. 納米粒子-外泌體作為單一體通過穿胞作用穿越肝膽細胞;
3. 通過清除致癌性外泌體,實現體內控制肺轉移。

研究背景:
血液物質通常通過兩種途徑從全身循環中排出:(1)腎臟濾過,排泄到尿液中;(2)肝膽清除,通過Oddi括約肌進入小腸。小于6?nm的物質通常通過腎小球濾過而被清除。不能被Kuffer細胞立即捕獲的較大物質通常通過肝膽清除進入小腸而被清除。
外泌體是由所有細胞產生和釋放的細胞外囊泡。納米大小的細胞外囊泡(40–150 nm)自然存在于血液中,并參與細胞間的通訊。大小和膜脂質雙層有助于它們有效進入其他細胞。致癌外泌體在特定器官部位定居,并通過其整合素介導的與器官特異性常駐細胞的融合,啟動轉移前生態位的形成。外泌體的表面富含各種表面生物標志物,包括來自原始細胞的四跨膜蛋白(CD9,CD63,CD81和CD82)和表皮生長因子受體(EGFR;或ErbB-1;HER1)。EGFR是一種重要的跨膜蛋白,可通過其胞外域與其特異性配體結合而激活。
人工智能納米材料可以在體內識別其靶標(酶,受體,細胞等)并選擇性地結合它們。研究人員證明了,偶聯在一起的雙抗體或雙適體可以在體內以高特異性捕獲稀有循環腫瘤細胞(CTC),這是因為它們能夠識別CTC上的兩個生物標記并用雙手抓住它們。
成果簡介:
有鑒于此,福州大學賈力教授團隊利用中空介孔二氧化硅納米粒子(MSNs)作為拖拉機,將結合的外泌體從循環系統中拖入胃腸道。即:用EGFR靶向適配體功能化的帶正電的介孔二氧化硅納米粒子(MSN-AP)特異性識別并結合血源性帶負電荷的致癌性外泌體(A-Exo),并將A-Exo穿過肝膽層和Oddi括約肌拖入小腸。該創新概念和生物技術方法為將有害的循環生物危害傾倒入小腸開辟了一條途徑。
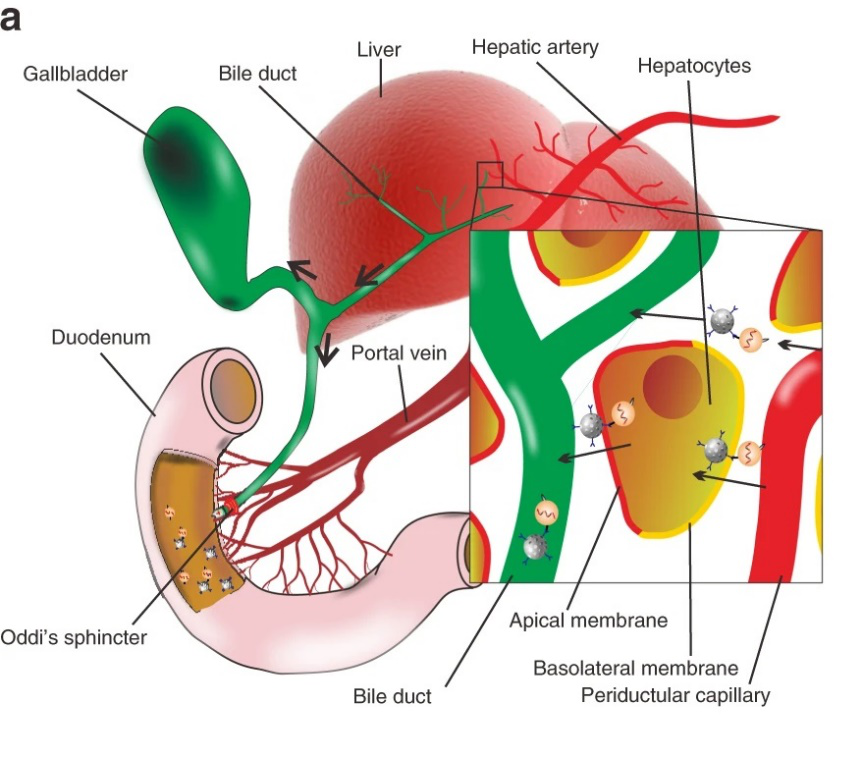
圖1. 示意圖
要點1:材料制備
通過超速離心從A549細胞培養上清液中分離出A-Exo和從人胚肺成纖維細胞培養基中分離出H-Exo作為對照。并分析其相關生化特性,發現只有A-Exo表達EGFR。
同時,研究人員制備了正負兩種電荷的納米介孔硅材料,并利用抗EGFR DNA適配體功能化。
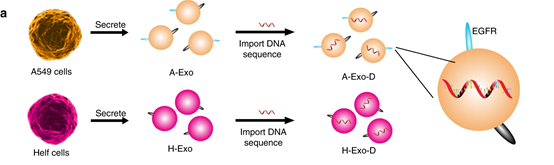
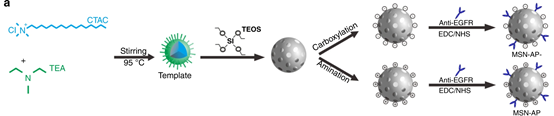
圖2. 外泌體和介孔硅納米顆粒的制備示意圖
要點2:MSN-AP與A-Exo體外特異性結合
然后,研究人員探究了MSN是否可以特異性識別并結合外泌體。通過共聚焦顯微鏡和流式細胞術分析,MSN-AP和MSN-AP-都與A-Exo特異性結合,與EGFR表達低的H-Exo幾乎沒有結合。結果還表明帶正電的MSN-AP比帶負電的MSN-AP更能吸引和結合A-Exo。
分析了MSN-AP和A-Exo之間的分子間識別和結合力。使用最胡克定律來評估分子間力,并利用AFM測定。力分布反映了當分子間距離達到最大值(直到鍵突然斷裂)時施加到MSN-Exo鍵上的力。結果顯示平均分子間力為200 nN,最大距離為?70 nm,這代表了MSN-Exo鍵的識別力和電荷力。該結果表明靜電力是形成MSN-Exo的主要力。
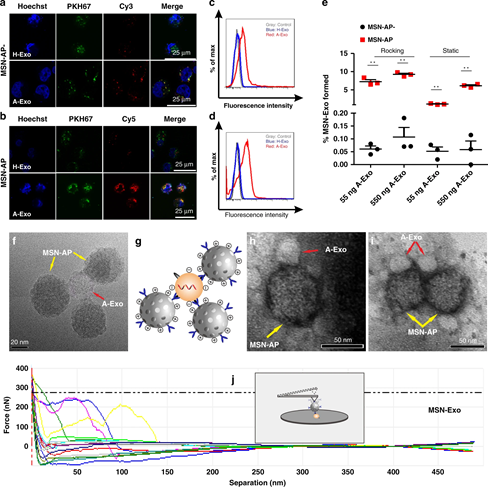
圖3. 結合能力檢驗
要點3. MSN攜手Exo一起穿過肝細胞
為了研究共軛MSN-Exo是否可以穿越一系列肝細胞,研究人員使用延時圖像序列和transwell等實驗,表明MSN-Exo,MSN-AP和A-Exo容易滲透膽管細胞,內皮細胞和LO2細胞,但卻容易被Kuffer細胞吞噬,然而研究人員表示這不能代表MSN-Exo在體內的狀態。
另外,通過細胞通路抑制試驗表明,MSN-Exo可以通過穿胞作用穿過LO2細胞,內吞作用和胞吐作用是MSN-Exo跨LO2單層運輸的主要渠道。
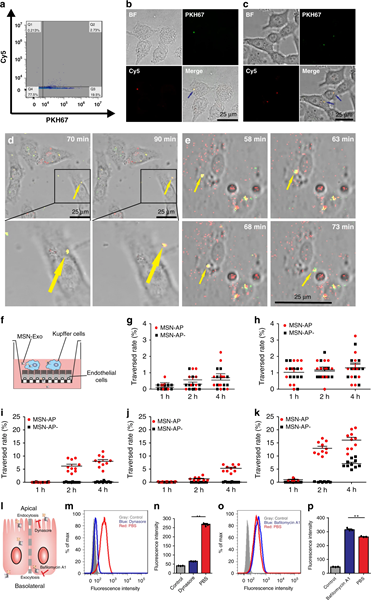
圖4.MSN-Exo穿過肝細胞
要點4. Exo在體內分布、排泄及控制肺轉移
通過尾靜脈注射,進行一系列實驗發現,血液中的MSN-AP有助于A-Exo而不是H-Exo分布到肝臟,然后重新分布到小腸進行排泄,這與特異性識別有關。
然后,研究人員又檢查了血液中A-Exo的減少是否可以減弱A-Exo誘導的肺癌轉移。結果顯示了致癌性外泌體能誘導的A549 CTC向小鼠肺的器官性轉移,同時能被MSN-AP治療抑制。
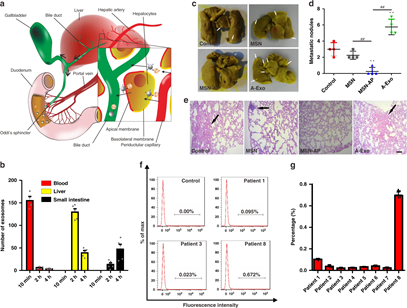
圖5. Exo體內作用機制和控制肺轉移
小結:
總體而言,智能設計的安全生物材料可以準確地識別,結合并從血液中拖曳目標性生物危害物進入膽管以消除。這項研究開辟了視野,只要能夠確定生物危害的分子結構和理化特性,就可以通過Oddi括約肌將血液中引起疾病的生物危害轉入小腸。
參考文獻:
Xie, X., Nie, H., Zhou, Y. et al. Eliminating blood oncogenic exosomes into the small intestine with aptamer-functionalized nanoparticles. Nat Commun 10, 5476 (2019)
doi:10.1038/s41467-019-13316-w
https://doi.org/10.1038/s41467-019-13316-w
課題組介紹

賈力,福州大學博導。福州大學腫瘤轉移的預警和預防研究所所長。福州大學能源與環境光催化國家重點實驗室生物醫藥光催化課題組長。在美國紐約州立大學,師從諾貝爾獎獲得者、著名藥理學教授Robert Furchgott博士獲得藥理學博士學位。到2011年底,賈力博士在福州大學創立了全球獨具特色的“腫瘤轉移的預警和預防中心(http://cmapc.fzu.edu.cn)”。
賈力博士在Nature、Science、 PNAS、 Blood、 Nano Today、 Drug Discovery Today、Trends Pharm. Sci., Trends Biotech.等國際核心期刊發表過>130余篇具有重要創見的論文。他的研究領域涵蓋抗腫瘤藥、抗結核/AIDS藥、心血管藥、一氧化氮(NO)生物學、藥物的藥理藥代(ADME)和毒理、藥物蛋白組學(pharmacoproteomics)、中草藥、藥化特性、藥物分析、納米藥物、以及新藥申報政策等。











