
第一作者:Zhigang Ren
通訊作者:闞全程、余祖江、毛崢偉
通訊單位:鄭州大學第一附屬醫院、浙江大學
研究亮點:
1. 利用金屬-多酚配位作用制備了EGCG與Pt-OH相結合的有機納米治療藥物,具有載藥量高、生物相容性好、穩定性強、血液循環時間長的優點。
2. PTCG NPs細胞內化后,釋放抗癌藥物,并通過級聯反應產生活性氧,實現化療/化學動力協同治療。
3. 通過在PTCG NPs中摻雜Gd,成功引入了成像功能來監測納米藥物的傳遞和釋放行為,賦予了納米藥物診斷能力。
背景介紹:
化療在臨床上被廣泛用于治療多種癌癥。鉑(II)基藥物,包括順鉑、奧沙利鉑和卡鉑,是目前使用較為廣泛的一線癌癥治療藥物。許多以鉑(II)配合物為基礎的納米藥物已被開發出來,旨在通過充分利用主動靶向以及EPR效應,實現腫瘤特異性遞送。然而,這些納米藥物的治療效果并不理想,還需在納米制劑中加入更多的治療方式,以提高其抗癌效果。
作為一種新型殺死癌細胞策略,基于芬頓反應的化學動力學療法(CDT)成為癌癥治療的新方法。芬頓反應利用金屬催化細胞內過氧化氫(H2O2)向活性氧物種(如超氧自由基O2·?和羥基自由基·OH)轉化,因此,體內療效高度依賴于內源性H2O2的量。順鉑可以在癌細胞中特異性激活NADPH氧化酶(NOX),O2接受NADPH氧化為NaDP+所給予的電子,形成O2·?,再被超氧化物歧化酶進一步歧化生成H2O2。因此,以順鉑為主的化療通過自給H2O2進行Fenton反應,是CDT的理想方案。
納米氧化鐵已被用作CDT的藥物載體和鐵源,但其相對較低的載藥量和較慢的鐵釋放可能會削弱其抗腫瘤作用。與無機治療藥物不同,由有機基元構建的納米藥物具有無可比擬的優勢,包括生物相容性、生物降解性、高載藥量和刺激響應性,在臨床轉化方面具有巨大的潛力。
成果簡介:
有鑒于此,鄭州大學第一附屬醫院闞全程和余祖江研究團隊聯合浙江大學毛崢偉研究團隊基于鐵離子(Fe3+)與多酚的配位作用,將表沒食子兒茶素沒食子酸酯(EGCG)與5-羥基多巴胺修飾的鉑(IV)前藥(Pt-OH)復合,制備了有機納米治療藥物(PTCG NPs)。設計了一種含有多酚鏈段的嵌段共聚物(PEG-b-PPOH)來對納米粒子(NPs)進行PEG化,從而延長了納米粒子的循環時間,抑制蛋白質吸收,并增強了所獲得的納米藥物的腫瘤蓄積。由于Fe3+和多酚基團之間的強配位作用,PTCG NPs中負載的Pt-OH和EGCG的比例可以精準調整到治療水平,從而實現協同效應。納米顆粒可以摻入釓離子(Gd3+),用于磁共振成像(MRI),以追蹤PTCG NPs的體內釋放。在低pH環境下,由于亞胺連接體的裂解和Pt-OH活化為順鉑,活性藥物被HepG2細胞內化后有效地從納米粒中釋放出來。產生的順鉑通過級聯反應提高了細胞內H2O2水平,在Fe3+的催化下產生有毒的ROS,從而可通過CDT來提高療效。
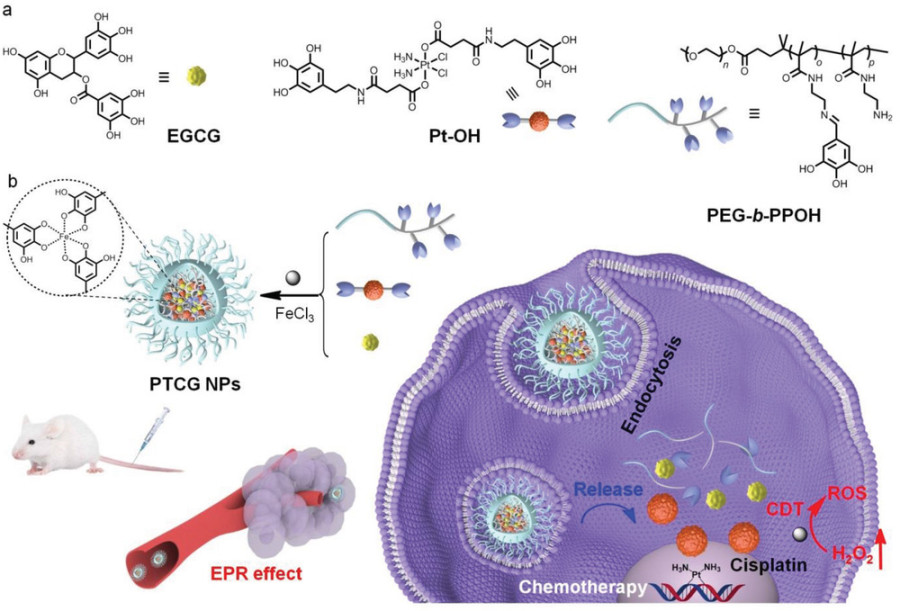
圖1. PTCG NPs作用機理圖
要點1. PTCG NPs的制備
通過三步反應合成了嵌段共聚物PEG-b-PPOH,EGCG和Pt-OH被PEG-b-PPOH高度包裹,負載量高于30%,由于金屬-多酚之間強大的配位作用,兩種治療劑可有效地共包裹到納米顆粒中,在最佳比例下,負載率高達90%。值得注意的是,通過在制備過程中改變EGCG和Pt-OH的百分比看調整組件的流體動力學直徑,實驗驗證,EGCG和Pt-OH最佳配比為1:4。

圖2. PTCG NPs的表征
要點2. PTCG NPs的體外釋放和細胞攝取
在此納米藥物中,低pH值和谷胱甘肽(GSH)能裂解共聚物和Pt-OH上的多酚,促進細胞內化后藥物釋放和活化。血液中GSH濃度低,pH值較高,保證了PTCG NPs在循環過程中的穩定。而腫瘤細胞中較高濃度的GSH和較低的pH能有效地將活性順鉑和EGCG釋放到細胞內。
PTCG NPs主要通過網織蛋白介導的內吞作用內化,輔以小凹和大胞吞噬途徑。通過激光共聚焦掃描顯微鏡(CLSM)可觀察到PTCG NPs被細胞有效攝取。
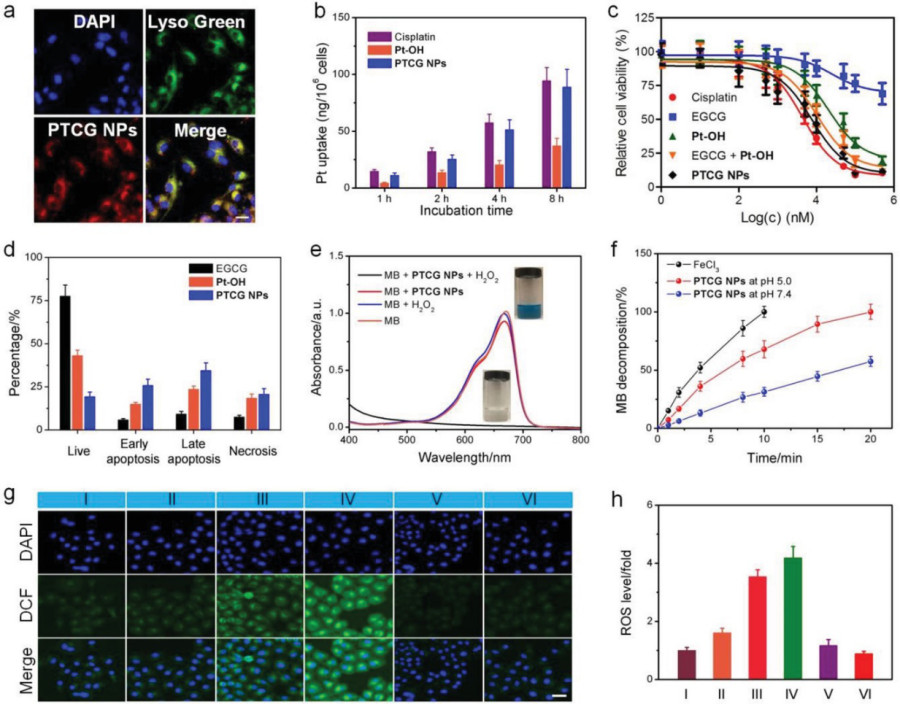
圖3. 細胞實驗結果
要點3. PTCG NPs的體外抗腫瘤效果
以順鉑為對照,采用MTT實驗評價PTCG NPs的抗腫瘤效果。與EGCG、Pt-OH或EGCG與Pt-OH混合物孵育的HepG2細胞相比,PTCG NPs處理的HepG2細胞的凋亡率和壞死率明顯增高,證實了PTCG NPs的協同抗腫瘤作用。
有趣的是,釋放的順鉑能夠通過級聯反應介導NOX的活化,將O2觸發為O2·?及其下游的H2O2。通過負載的Fe3+催化Fenton反應,將H2O2催化成劇毒的·OH,從而放大細胞內的氧化應激,實現額外的CDT。用2,7-二氯二醋酸熒光素作為熒光探針證明了HepG2細胞內ROS的產生。并通過實驗驗證了鐵和順鉑聯合作用對ROS生成的放大作用。
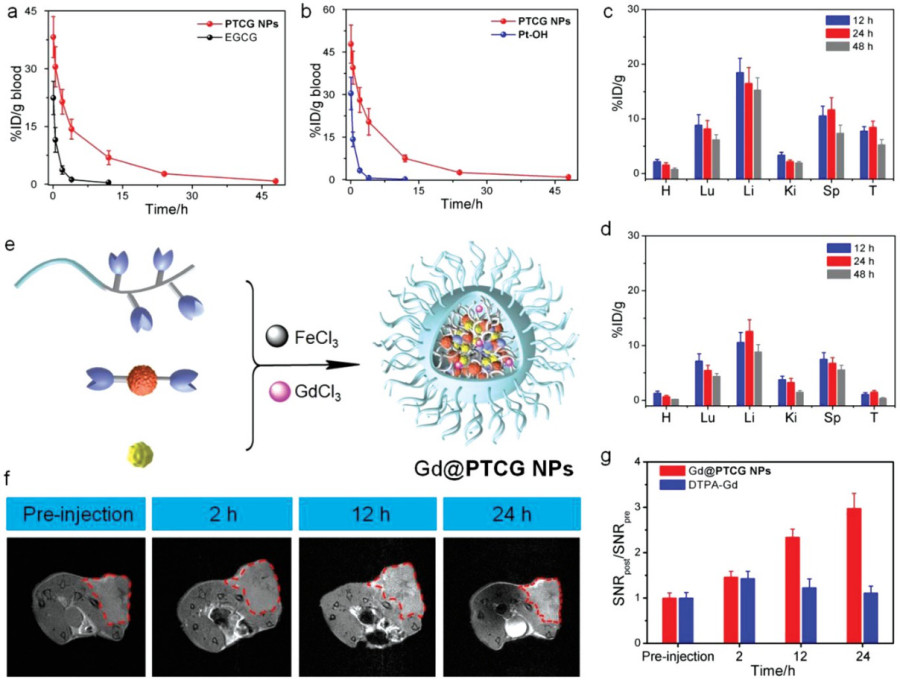
圖4. 血液循環、組織分布、MRI成像結果
要點4. PTCG NPs的藥代動力學行為和生物分布
對PTCG NPs的藥代動力學行為和生物分布進行評估。采用電感耦合等離子體質譜法和高效液相色譜分別測定血液中隨時間變化的鉑和EGCG含量,計算PTCG NPs的循環時間。EGCG或Pt-OH迅速從血液中清除,其循環半衰期分別為0.44±0.06h和0.39±0.05h。與此形成鮮明對比的是,PTCG NPs中兩者的循環半衰期分別為2.92±0.22h和3.27±0.38h,表明PTCG NPs的循環時間明顯延長。
要點5. PTCG NPs摻雜釓離子(Gd3+)實現MRI成像
將成像/診斷功能結合到納米系統中對癌癥進行早期診斷,更好地了解和優化藥物輸送,監測治療效果和治療后的反應是非常重要的。MRI是臨床診斷和臨床前研究中廣泛使用的最重要的成像手段之一,具有無創檢測,無輻射副作用,以及高空間分辨率的優勢。在制備納米藥物的過程中,引入Gd3+摻雜PTCG NPs而不改變其尺寸,可達到MRI成像目的。
要點6. PTCG NPs的體內抗腫瘤效果和全身毒性
利用HepG2荷瘤裸鼠對PTCG NPs的體內抗腫瘤作用進行研究。與PBS對照組相比,EGCG NPs組小鼠的治療效果有限,EGCG+Pt-OH抗腫瘤效果也較差,而PTCG NPs對小鼠的腫瘤生長有明顯抑制作用,這主要歸因于EPR效應、刺激反應性藥物釋放、ROS升高、及化療/化學動力學治療協同抗癌作用。
且PTCG NPs組小鼠存活時間更長,與健康小鼠相比,PTCG NPs未見明顯的組織損傷或炎性病變,也未檢測到明顯的炎性免疫細胞聚集,說明PTCG NPs在體內應用是安全的。為進一步評價PTCG NPs在體內的長期潛在毒性,采集小鼠血液進行血液生化檢測,健康小鼠和PTCG NPs處理的小鼠均未檢測到特定參數的明顯變化,且注射PTCG NPs的小鼠的其它血液學指標均在正常范圍,表明此納米技術可避免全身毒性。
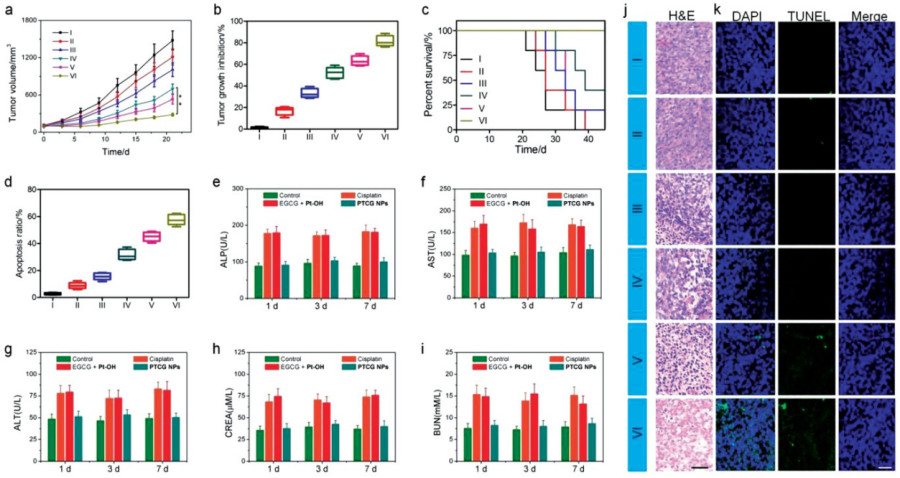
圖5. 體內抗腫瘤效果和全身毒性結果
小結:
綜上所述,此研究利用金屬-多酚配位作用制備了EGCG與Pt-OH相結合的有機納米治療藥物。PTCG NPs具有較高的載藥能力,在生理環境中表現出優異的穩定性。在細胞內化后,通過級聯反應,特異性打開癌細胞閘門,釋放抗癌藥物和活性氧,實現化療/化學動力聯合治療。在PTCG NPs中摻雜Gd,成功地引入了成像功能來監測納米藥物的傳遞和釋放行為,賦予了納米藥物診斷能力。體內實驗則證實了PTCG NPs的協同抗腫瘤性能和良好的生物相容性。與絕大多數傳統給藥系統相比,這種金屬-配體雜化大大提高了抗癌效果,豐富了所得納米藥物的治療功能。這一開創性的工作為治療納米藥物的發展提供了新策略,這些藥物在癌癥治療領域具有較高的潛力。
參考文獻:
Zhigang Ren, Shichao Sun, Ranran Sun, et al. A Metal–Polyphenol‐Coordinated Nanomedicine for Synergistic Cascade Cancer Chemotherapy and Chemodynamic Therapy. Adv. Mater., 2019.
https://doi.org/10.1002/adma.201906024











