
第一作者:Sheng Ma
通訊作者:陳學思,宋萬通
通訊單位:中國科學院長春應用化學研究所
研究亮點:
1. 開發了一種pH和氧化還原雙重響應性多肽-地塞米松結合物,用于抗腫瘤治療和調節腫瘤微環境。
2. 多肽-地塞米松結合物能顯著抑制小鼠體內腫瘤生長。
3. 多肽-地塞米松結合物可以逆轉腫瘤免疫抑制微環境。
背景介紹:
炎癥,尤其是慢性炎癥,是腫瘤發生的重要原因,并隨著腫瘤的發展而發揮不同的功能。研究表明,腫瘤微環境(TME)不僅由腫瘤細胞構成,還包含間質細胞(包括內皮細胞、成纖維細胞和炎癥細胞)。其中某些炎癥細胞,如腫瘤相關巨噬細胞(TAMs),通過分泌生長因子促進腫瘤細胞增生,分泌血管內皮生長因子(VGF)促進血管生成,分泌基質金屬蛋白酶(MMPs)促進腫瘤轉移和侵襲,分泌各種免疫抑制細胞因子抑制獲得性免疫。此外,據報道,一些炎癥細胞與耐藥性有關。因此,減少炎癥的免疫調節可能是重塑TME用于癌癥治療的重要策略。
抗炎藥物已應用于臨床癌癥預防,在抑制腫瘤發展、對抗化療耐藥、降低癌癥發病率和提高癌癥患者存活率方面也顯示出效果。然而,非甾體抗炎藥、類固醇和他汀類藥物有各種副作用,這些副作用阻礙了它們在癌癥治療中的充分應用。
近年來,基于納米技術的給藥系統在改善化療藥物水溶性,延長血液循環時間,調節生物分布和減少副作用方面已被廣泛探索。刺激響應型藥物遞送系統可以通過減少正常組織中不必要的藥物釋放和促進腫瘤內的快速釋放來進一步提高藥物遞送效率。然而,這種刺激響應型藥物輸送系統用于癌癥治療的報道仍然很少。
成果簡介:
有鑒于此,中科院長春應用化學研究所陳學思、宋萬通等人開發了一種pH和氧化還原雙重響應性多肽-地塞米松結合物(L-SS-DEX),用于抗腫瘤治療和調節腫瘤微環境。多肽因其良好的生物相容性、低毒和多功能而被選為該研究的骨架材料。L-SS-DEX在緩解免疫抑制的TME方面表現出巨大的潛力,治療效果優于游離DEX。這些結果為抗炎藥物在腫瘤治療中的應用提供了新的可能性。
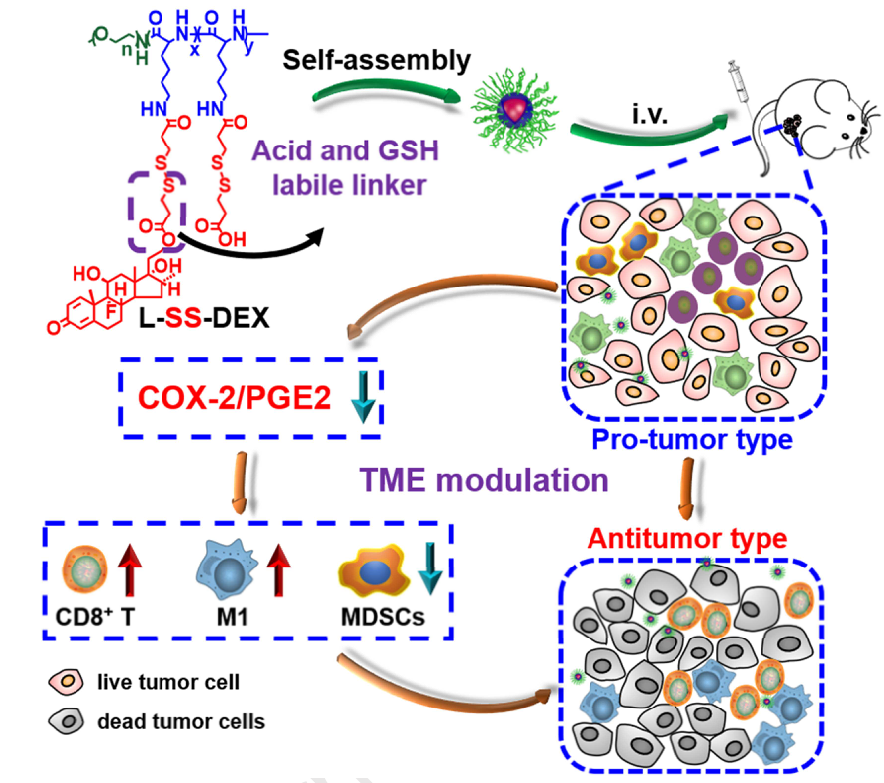
圖1. L-SS-DEX調節腫瘤微環境的示意圖
要點1: L-SS-DEX的自組裝和體外藥物釋放
由于具有兩親性, L-SS-DEX易溶解在PBS中并組裝成膠束。L-SS-DEX膠束的納米尺寸有助于其通過EPR效應在腫瘤組織中更好地蓄積。L-SS-DEX膠束在pH 5.0時的釋放速度比pH 7.4時快,證明L-SS-DEX具有酸觸發釋放的能力。在GSH存在下,二硫鍵被切斷,暴露的硫醇基團與羰基相連以釋放藥物。以10 mM GSH為引發劑,pH為7.4時,L-SS-DEX膠束中DEX的釋放率達66%以上。上述結果證明了pH和GSH的雙重刺激可使DEX從L-SS-DEX中釋放。
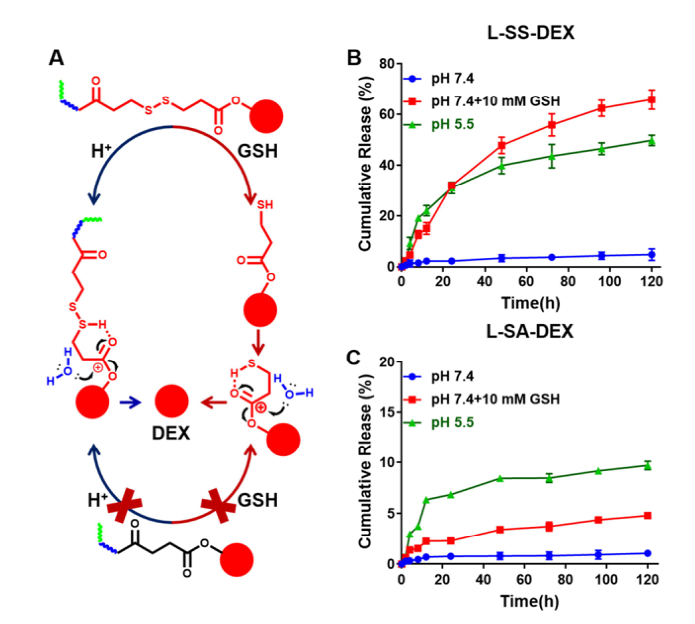
圖2. L-SS-DEX的體外釋放研究
要點2: L-SS-DEX的體外細胞毒性和細胞攝取
采用MTT法檢測L-SS-DEX對CT26小鼠結腸癌細胞的體外細胞毒性。與游離DEX相似,L-SS-DEX對CT26細胞無明顯的細胞毒副作用。FITC標記的L-SS-DEX用激光共聚焦掃描電鏡(CLSM)評價其細胞攝取情況,結果顯示L-SS-DEX可被腫瘤細胞內吞。
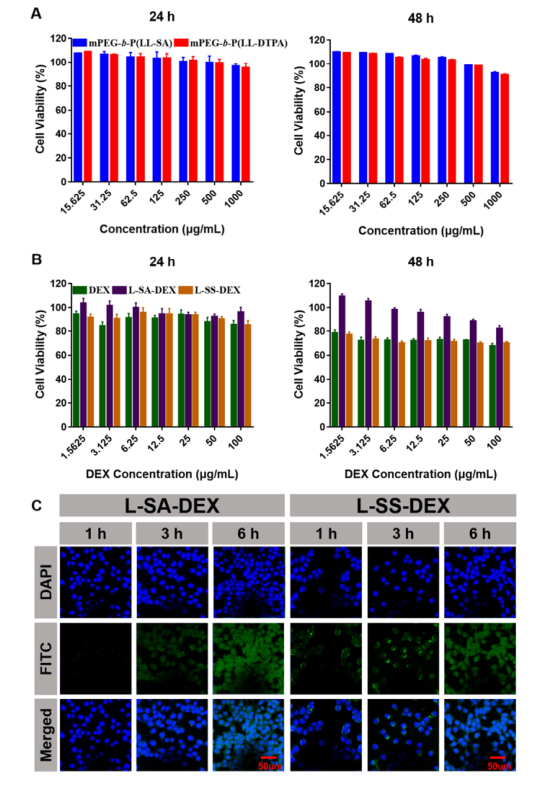
圖3. 體外細胞毒性和細胞攝取研究
要點3: L-SS-DEX藥代動力學研究和小鼠體內生物分布
與游離DEX相比,L-SS-DEX膠束可延長血液循環時間。注射后12h,游離DEX迅速從血液循環中清除。表明L-SS-DEX與游離DEX相比具有更長的半衰期和更好的生物利用率。
靜脈注射一次后,L-SS-DEX組腫瘤組織中DEX的蓄積量明顯高于游離DEX組,表明L-SS-DEX比游離DEX具有更好的腫瘤聚集能力。另外,L-SS-DEX在主要臟器的蓄積量高于游離DEX,可能與L-SS-DEX循環時間延長有關。但L-SS-DEX在主要臟器中的濃度隨時間增長呈下降趨勢,表明L-SS-DEX可從肝、腎等臟器中去除。

圖4. 生物分布情況
要點4: L-SS-DEX的全身毒性以及抗腫瘤效果
L-SS-DEX治療組與PBS組比較,血液學指標無明顯差異,游離DEX顯著降低白細胞數。表明L-SS-DEX在BALB/c小鼠體內的耐受性好于游離DEX。
與對照組結果相反,L-SS-DEX在整個治療過程中顯示出永久性的腫瘤抑制作用,另外,L-SS-DEX組在治療期間無明顯的體重下降,表明其可顯著延長小鼠存活時間。
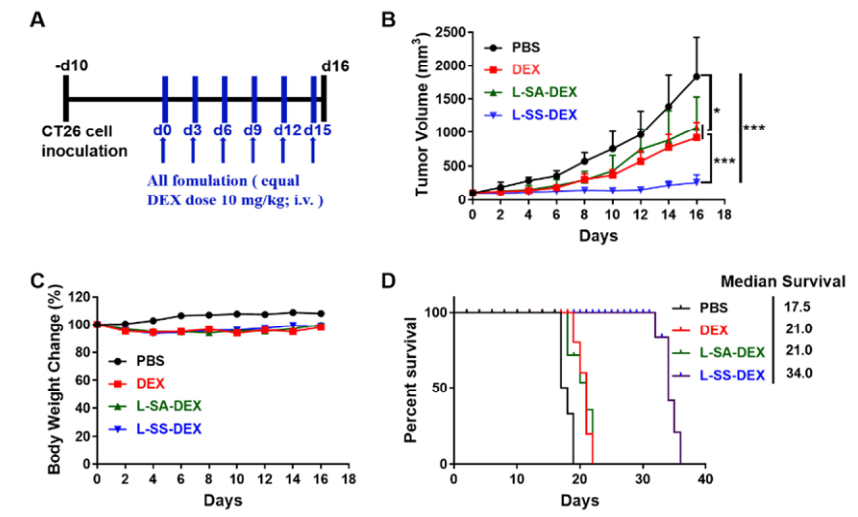
圖5. CT26腫瘤模型的治療效果
通過組織學和免疫熒光分析、組織學分析和免疫熒光染色進一步評價其抗腫瘤活性、對腫瘤微環境的調節作用和治療的安全性。與其他組相比,L-SS-DEX治療組可觀察到大面積壞死(尤其是腫瘤中心部分)。各治療組主要臟器組織形態正常,未見病理異常,提示各治療組無明顯的全身毒性。
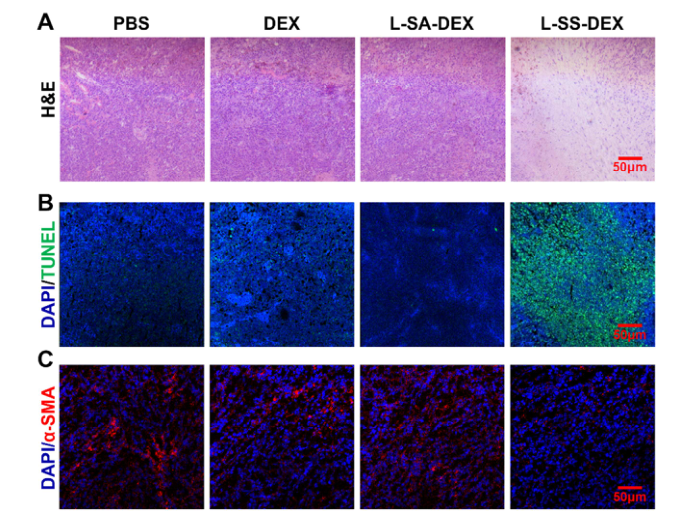
圖6. 腫瘤的組織學和免疫熒光染色
要點5: 腫瘤免疫微環境評價
L-SS-DEX治療后,環氧合酶-2(COX-2)和α-平滑肌肌動蛋白(α-SMA)的表達較對照組明顯降低。此外,經L-SS-DEX治療后,CT26腫瘤的免疫抑制微環境得到有效緩解,表現為CD8+T細胞浸潤增加,M1/M2巨噬細胞比值增加,調節性T細胞(Tregs)和髓源性抑制細胞(MDSCs)明顯減少。
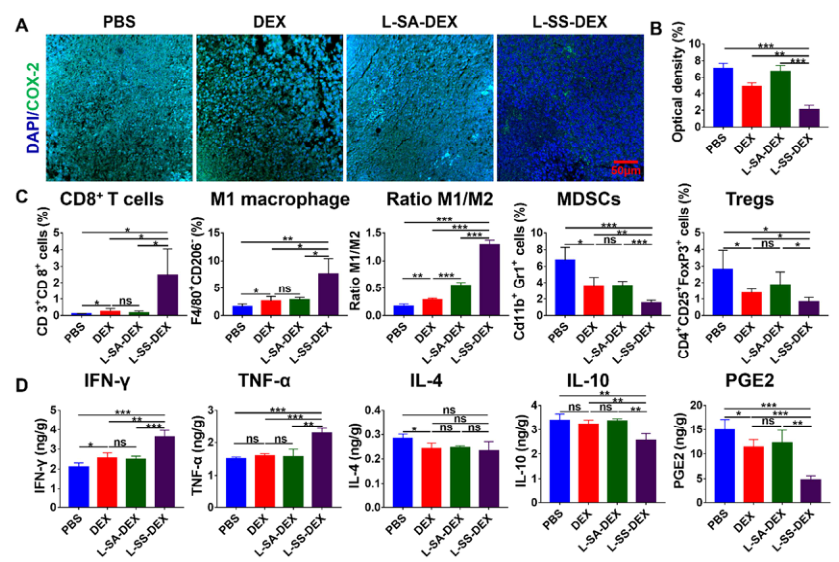
圖7. 腫瘤免疫微環境評價
小結:
本研究開發了多肽-DEX結合物來中和促腫瘤炎癥,用于結直腸癌治療。該結合物表現出pH和氧化還原雙重刺激響應釋放DEX,并極大地促進了DEX在腫瘤組織內的蓄積。體內抗腫瘤研究表明,與游離DEX或不敏感的DEX結合物相比,多肽-DEX結合物對小鼠CT26腫瘤生長有明顯的抑制作用,能顯著增加CD8+T細胞浸潤和M1/M2巨噬細胞比率,降低腫瘤內免疫抑制的MDSCs和Tregs含量。進一步分析表明,COX-2和PGE2的抑制可能是L-SS-DEX逆轉腫瘤免疫抑制微環境的主要原因。
不得不提的是,中和促腫瘤慢性炎癥的療效可能與腫瘤類型有關。在大多數情況下,癌癥發生在慢性炎癥的部位,豐富的免疫細胞維持著免疫抑制的微環境,并刺激腫瘤細胞的增殖。因此,抗炎治療有助于逆轉免疫抑制的TME,從而抑制腫瘤生長。在其他情況下,如肉瘤,缺乏足夠的免疫細胞浸潤,增加免疫細胞浸潤的策略是必要的,以刺激這些“冷”腫瘤變成“熱”腫瘤。由于上皮細胞癌主要伴有慢性炎癥,使用適當設計的抗炎藥物制劑進行癌癥治療是一種很有前途的方法。
參考文獻:
Sheng Ma, Wantong Song, Xuesi Chen, et al. Neutralizing tumor-promoting inflammation with polypeptide-dexamethasone conjugate for microenvironment modulation and colorectal cancer therapy,Biomaterials, 2019.
https://doi.org/10.1016/j.biomaterials.2019.119676












