
第一作者:Wenjing Xuan, Yinghao Xia
通訊作者:譚蔚泓,劉艷嵐
通訊單位:湖南大學(xué)
研究背景:
自由基是一組在幾乎所有類型的細(xì)胞中產(chǎn)生的活性化學(xué)底物,是各種低水平生物過(guò)程中不可缺少的管理者。實(shí)際上,自由基理論已經(jīng)有五十多年的歷史了。然而,僅僅在過(guò)去的十年里,人們才進(jìn)行了廣泛的研究,以探索它們?cè)诎ò┌Y在內(nèi)的疾病發(fā)展中的關(guān)鍵作用。與正常細(xì)胞不同,癌細(xì)胞通常在其一生中過(guò)度產(chǎn)生自由基,主要是過(guò)氧化氫(H2O2),以促進(jìn)腫瘤的快速增殖、轉(zhuǎn)移和其他事件,這是由代謝重編程引起的。然而,自由基是一把雙刃劍,這樣跨越自由基水平的閾值將導(dǎo)致不可逆轉(zhuǎn)的氧化損傷,最終導(dǎo)致細(xì)胞死亡。具有諷刺意味的是,癌細(xì)胞中高水平的固有自由基也使它們比正常細(xì)胞更容易受到額外的氧化攻擊。因此,化學(xué)動(dòng)力學(xué)療法(CDT)是一種新的、比傳統(tǒng)療法更有效的治療多種癌癥的方法。
到目前為止,我們已經(jīng)致力于開(kāi)發(fā)各種CDT治療癌癥的策略。本質(zhì)上,這些方法基本上依賴于經(jīng)典的Fenton或Haber-Weiss反應(yīng),通過(guò)過(guò)渡金屬將外源性低反應(yīng)H2O2轉(zhuǎn)化為抗癌羥基自由基(?OH)。然而,在這些過(guò)程中,有兩個(gè)關(guān)鍵瓶頸作為限制因素,它們對(duì)CDT原本廣泛的抗癌應(yīng)用產(chǎn)生了重大影響。一個(gè)與化學(xué)反應(yīng)動(dòng)力學(xué)有關(guān)。眾所周知,高Fenton和Haber-Weiss反應(yīng)速率要求很低的pH值(pH 2-4),使得它們?cè)谀[瘤微環(huán)境(TME)下難以充分利用。另一個(gè)原因是腫瘤間外源性過(guò)氧化氫水平的不均一性,導(dǎo)致消耗過(guò)氧化氫治療效果不足,顯著降低。更糟糕的是,癌細(xì)胞上調(diào)抗氧化防御(主要是谷胱甘肽)以適應(yīng)自由基引起的氧化損傷,揭示了另一個(gè)挑戰(zhàn),以提高治療效率。
因此,對(duì)于最大化的治療效果和最小化的安全關(guān)注,理想的化學(xué)動(dòng)力學(xué)藥物應(yīng)該至少滿足以下特征:(i)腫瘤靶向積累對(duì)正常的氧化還原信號(hào)的影響可忽略不計(jì);(ii)用于定點(diǎn)釋放的簡(jiǎn)便和空間控制的化學(xué)反應(yīng)有害的自由基;(iii)較少的腫瘤毒性氧自由基的形成依賴于腫瘤ROS;(iv)癌性抗氧化防御的同時(shí)耗盡,以及(v)良好的生物相容性、可生物降解性和質(zhì)量控制。然而,據(jù)我們所知,一種能夠滿足所有這些標(biāo)準(zhǔn)的治療方法仍然是難以捉摸的。
成果簡(jiǎn)介:
近日,湖南大學(xué)譚蔚泓、劉艷嵐等人提出了一個(gè)新的概念,即生物正交化學(xué)和前體藥物相結(jié)合,創(chuàng)造一種新型的適配體藥物共軛物(ApDC):適配體前體藥物共軛物(ApPdC)膠束,用于改進(jìn)癌癥靶向CDT。疏水性前藥堿不僅可以促進(jìn)適體的自組裝,而且還可以通過(guò)生物正交化學(xué)作為自由基生成劑。深入的機(jī)理研究表明,與傳統(tǒng)的CDT系統(tǒng)不同,ApPdC微粒通過(guò)級(jí)聯(lián)生物正交反應(yīng)使癌細(xì)胞中的有毒C-中心自由基原位激活和自循環(huán)生成,不依賴于既不含H2O2也不依賴pH。同時(shí),谷胱甘肽耗竭減少了癌的抗氧化作用,產(chǎn)生協(xié)同的CDT效應(yīng)。我們期望這項(xiàng)工作能為癌癥靶向治療的設(shè)計(jì)和自由基相關(guān)分子機(jī)制的研究提供新的見(jiàn)解。
總體思路:
在此,首次報(bào)道了生物正交化學(xué)和前藥設(shè)計(jì)的引入,以產(chǎn)生一種新型的適配體藥物共軛物(ApDC):適配體前體藥物共軛物(ApPdC)膠束,其能夠TME雙靶向和自循環(huán),用于原位擴(kuò)增在癌細(xì)胞中產(chǎn)生的毒性自由基。工程化的ApPdC膠束由三部分組成:適體作為腫瘤識(shí)別單元,Fe2+可激活的四氧烷(“T”)作為自由基前體藥物,以及氯高鐵血紅素作為TME反應(yīng)的Fe2+原位活化源。
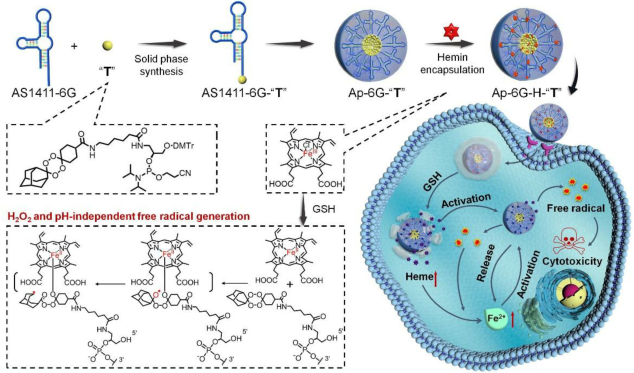
圖1. 示意圖
要點(diǎn)1:ApPdC的合成與分子組裝
成功地合成了一種新的靶向抗癌藥物,將前體藥物和生物正交化學(xué)相結(jié)合,以靶向腫瘤細(xì)胞氧化還原穩(wěn)態(tài)失調(diào)為靶點(diǎn),用于增強(qiáng)和靶向化療。凝膠電泳分析表明,AS1411分子量增加,膠束結(jié)構(gòu)導(dǎo)致電泳遷移率降低,呈現(xiàn)明亮而致密的條帶,而Ap-6G-T分子量增加,出現(xiàn)一條模糊的條帶。原子力顯微鏡(AFM)進(jìn)一步證實(shí)了這一特性,顯示出均勻且單分散的球形結(jié)構(gòu),平均尺寸為32.4nm。動(dòng)態(tài)光散射(DLS)和Z電位測(cè)定表明,Ap-6G-T膠束在生理?xiàng)l件下是穩(wěn)定的、帶負(fù)電的,沒(méi)有明顯的聚集現(xiàn)象。
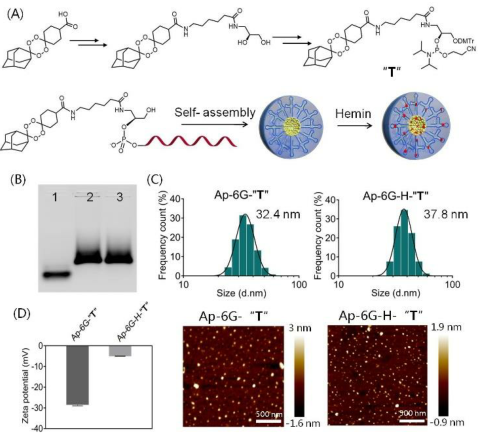
圖2. (A)“T”的合成示意圖;(B)凝膠電泳分析;(C,D)DLS分析、AFM成像和Z電位
要點(diǎn)2:血清和核酸酶穩(wěn)定性
由于充分的血清耐受性是決定一種新開(kāi)發(fā)的抗癌藥物是否可用于體內(nèi)應(yīng)用的先決條件和關(guān)鍵因素,隨后對(duì)ApPdC膠束的穩(wěn)定性進(jìn)行了檢查。為此,首先在37℃的90%磷酸鹽緩沖血清溶液中分析由Ap-6G-“T”、Ap-6G-2“T”或Ap-6G-3“T”組成的不同ApPdC膠束。作為參考,還評(píng)估了“T”自由適配體。發(fā)現(xiàn)游離的適配子在48小時(shí)的孵育后迅速降解,只剩下不到40%的適配體(圖2A,B)。令人印象深刻的是,在相同條件下與前藥堿偶聯(lián)后,其穩(wěn)定性顯著提高,70%以上的偶聯(lián)物殘留,從而顯示其對(duì)血清介導(dǎo)的降解具有較高的抗性。
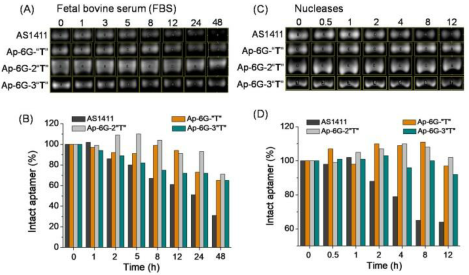
圖3. 瓊脂糖凝膠分析和定量分析自由適體和不同ApPdC膠束在FBS(A,B)或核酸酶(C,D)中的降解速率
要點(diǎn)3:激活機(jī)制
我們進(jìn)行了全面的機(jī)制研究,以提高我們對(duì)工程化ApPdC膠束的癌細(xì)胞特異性激活和治療活性的基本認(rèn)識(shí)。我們的研究結(jié)果表明,AppDC膠束中的前藥基礎(chǔ)可以被細(xì)胞內(nèi)Fe2+激活,從而觸發(fā)級(jí)聯(lián)的生物正交反應(yīng),用于原位擴(kuò)增產(chǎn)生有毒的C-中心的自由基。
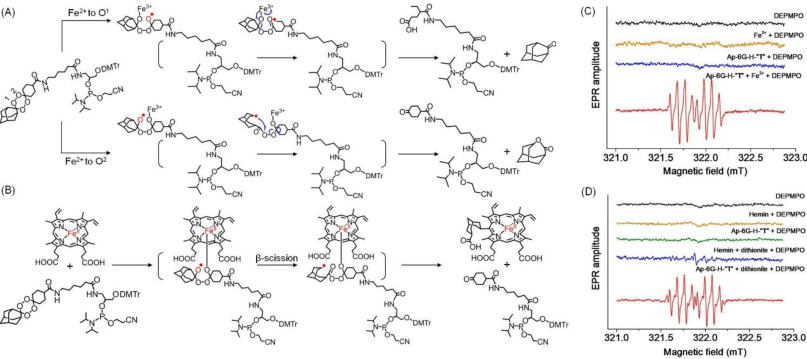
圖4. (A)游離Fe2+或(B)血紅素(Fe2+)介導(dǎo)的前藥堿“T”的激活機(jī)制
要點(diǎn)4:癌細(xì)胞識(shí)別與毒性自由基的原位生成及癌細(xì)胞的協(xié)同細(xì)胞毒性
強(qiáng)疏水性前藥堿允許在ApPdC膠束中裝載血紅素。腫瘤細(xì)胞內(nèi)GSH的升高可將負(fù)載的氯高鐵血紅素還原成血紅素,從而為促進(jìn)充分的生物正交反應(yīng)提供了Fe2+自供平臺(tái)。值得注意的是,這樣的自由基生成過(guò)程優(yōu)于傳統(tǒng)的細(xì)胞療法,不依賴于強(qiáng)酸性pH值或內(nèi)源性H2O2,同時(shí)通過(guò)消耗GSH同時(shí)減少癌性抗氧化。以AS1411為模型適體,系統(tǒng)評(píng)價(jià)了ApPdC膠束對(duì)癌細(xì)胞自由基的特異調(diào)節(jié)作用。我們的數(shù)據(jù)表明,ApPdC膠束可以通過(guò)受體介導(dǎo)的靶向性特異性識(shí)別癌細(xì)胞,與非靶向膠束相比,增強(qiáng)了細(xì)胞的攝取。胞吞作用后,ApPdC膠束能比非靶向膠束更有效地產(chǎn)生毒性自由基,對(duì)癌細(xì)胞有顯著的氧化損傷和增強(qiáng)的抗增殖作用。更令人印象深刻的是,這樣的抗癌效果可以通過(guò)合用血紅素或增加ApPdC鏈中前藥堿的數(shù)量來(lái)增強(qiáng)。
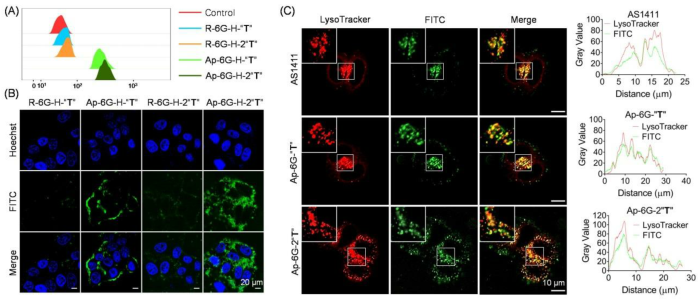
圖5. 流式細(xì)胞術(shù)(A)和共焦熒光成像 (B)分析不同ApPdC和非靶膠束在HepG2細(xì)胞中的結(jié)合能力 (C)自由適配體和ApPdC膠束的溶酶體共域化
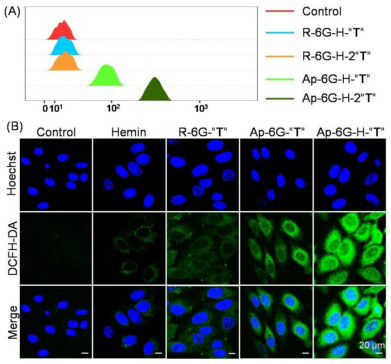
圖6. 不同處理HepG2細(xì)胞自由基水平的流式細(xì)胞術(shù)(A)和共聚焦熒光成像(B)
小結(jié):
雖然本人的研究結(jié)果顯示了很好的治療前景,但仍需要進(jìn)一步的研究,例如ApPdC膠束的體內(nèi)藥代動(dòng)力學(xué)和抗癌功效,以更好地說(shuō)明其治療癌癥的潛力。此外,盡管ApPdC膠束被設(shè)計(jì)用于靶向獨(dú)特的癌細(xì)胞代謝以減少副作用,但未來(lái)仍需要更多的研究來(lái)評(píng)估對(duì)正常細(xì)胞或組織的長(zhǎng)期安全性問(wèn)題。然而,由于鐵代謝紊亂和氧化應(yīng)激的易感性代表了癌癥之間的共同特征,這項(xiàng)研究可以為開(kāi)發(fā)新的有效的AppDCS奠定基礎(chǔ),以特異性治療各種晚期癌癥。
參加文獻(xiàn)及原文鏈接:
Wenjing Xuan, Yinghao Xia, Ting Li, et al. Molecular Self-assembly of Bioorthogonal Aptamer-Prodrug Conju-gate Micelles for Hydrogen Peroxide and pH-Independent Cancer Chemodynamic Therapy. Journal of the American Chemical Society, 2019.
DOI: 10.1021/jacs.9b10755
https://pubs.acs.org/doi/abs/10.1021/jacs.9b10755











