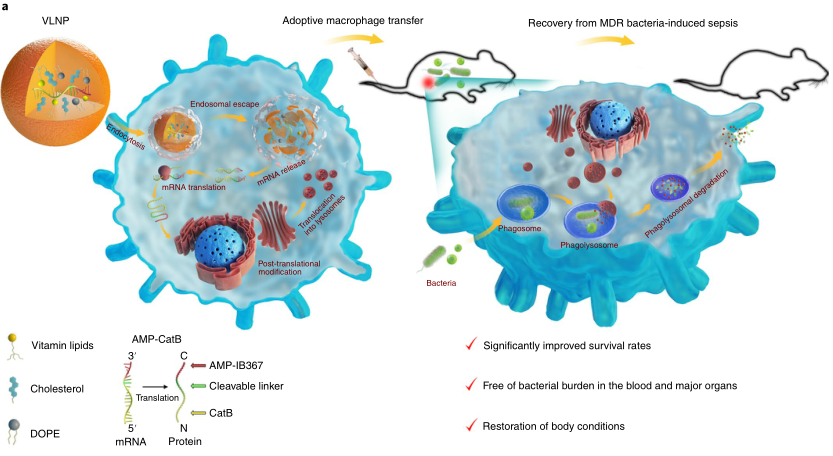
第一作者:Xucheng Hou
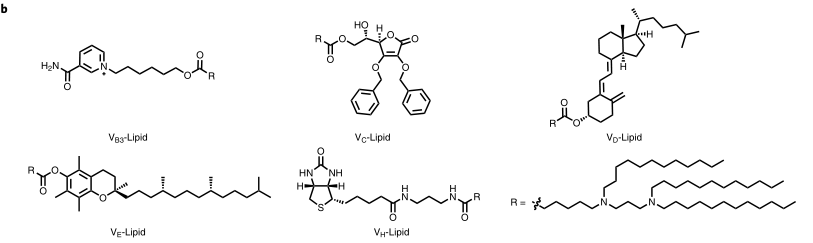
傳統上認為,膿毒癥是對病原體的一種不可控的炎癥反應。然而,最近的臨床數據顯示,超過60%的膿毒癥患者在最初的炎癥風暴中存活下來,但迅速發展成為更長的免疫抑制狀態,其特征是免疫細胞癱瘓和死亡,導致無法清除入侵的病原體,增加了對醫院獲得性感染的易感性,并導致高死亡率。因此,為了治療膿毒癥,已經廣泛研究了潛在的治療靶點。巨噬細胞是感染過程中最有效的病原體清除劑之一。事實上,在膿毒癥患者中,巨噬細胞/單核細胞受損似乎是抗菌素防御不足的主要原因。幾項免疫刺激劑的小型臨床試驗表明,在逆轉失活的巨噬細胞/單核細胞,從而增強感染根除方面有益處。然而,大型臨床試驗的Meta分析沒有顯示在降低患者死亡率方面有顯著變化。臨床結果的差異可以解釋如下。首先,免疫刺激劑不能將受損的巨噬細胞/單核細胞的功能恢復到原來的水平。其次,入侵的細菌通常被困在巨噬細胞吞噬溶酶體中,在巨噬細胞吞噬溶酶體中,活性氧、活性氮和溶菌酶協同作用清除細菌。然而,許多細菌,如金黃色葡萄球菌和大腸桿菌,已經進化出免疫逃逸機制來阻止吞噬酶體的殺傷,導致細胞內存活和反復感染。第三,雖然抗生素治療是膿毒癥臨床指南中的標準治療,但70-80%的膿毒癥死亡與持續性感染有關,因此表明抗生素耐藥性的流行和有效抗菌劑的缺乏。近日,俄亥俄州立大學董一洲等研究人員研究表明,在溶酶體(MACs)中過繼轉移含有與組織蛋白酶B相連的抗菌肽的巨噬細胞可以用于治療免疫抑制小鼠的多藥耐藥細菌誘導的膿毒癥。MACs是通過轉染維生素C脂質納米粒來構建的,該納米粒可以傳遞抗菌肽和組織蛋白酶B(AMP-CatB)mRNA。維生素C脂質納米粒允許AMP-CatB在巨噬細胞溶酶體中特異性積聚,這是殺菌活性的關鍵部位。研究結果表明,過繼的MAC轉移可以消除包括金黃色葡萄球菌和大腸桿菌在內的多藥耐藥細菌,從而使免疫受損的膿毒癥小鼠完全康復。圖1. 過繼巨噬細胞轉移和維生素衍生脂質化學結構的示意圖要點1:過繼巨噬細胞轉移的機理和維生素衍生脂質的化學結構首先設計并構建了編碼抗菌肽IB367(AMP-IB367)、組織蛋白酶B(CatB)和CatB敏感接頭的AMP-CatB mRNA。AMP-IB367是一種廣譜AMP,具有快速殺菌活性,已在臨床試驗中得到證實。CatB是一種內源性溶酶體蛋白,最初被翻譯為細胞質中的非活性前體。在轉位到溶酶體中后,前體被加工成成熟的CatB。在本研究中,CatB組分被摻入以將AMP-IB367轉運到溶酶體中。為了給巨噬細胞配備AMP-CatB mRNA,研究人員設計了一系列維生素衍生脂質納米材料。如圖1a所示,mRNA在細胞質中翻譯成功能蛋白,這些蛋白進一步移位到溶酶體,在溶酶體中,連接子被CatB蛋白切割,從而釋放APM-IB367。當包裹細菌的吞噬小體與溶酶體融合時,攝入的細菌同時暴露于預先儲存的AMP-IB367和溶酶體抗菌成分。雖然免疫逃避策略可以保護MDR細菌免受吞噬酶體殺傷機制的影響,但AMP-IB367能夠殺死這些細菌。因此,MACs過繼轉移通過恢復天然免疫,克服細菌免疫逃避,根除感染,從而挽救了MDR細菌誘導的膿毒癥小鼠的免疫抑制狀態。
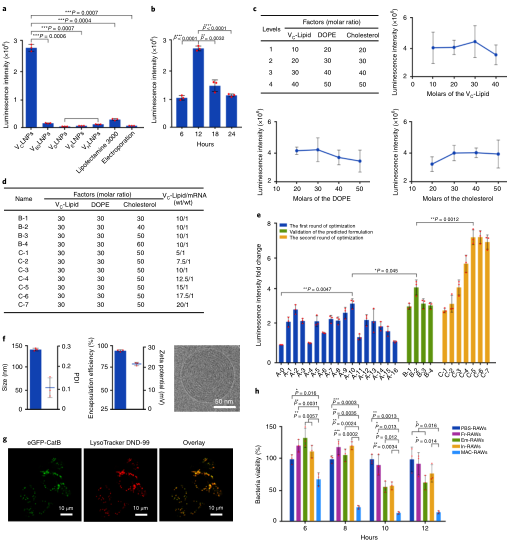
在使用編碼mRNA的螢火蟲熒光素酶在RAW264.7細胞中進行的初始篩選中,VCLNPs的mRNA遞送效率是其他四種熒光素酶的20倍(圖2a)。此外,在相同的基因濃度下,VCLNPs比脂質體3000好10倍,比電穿孔好50倍(圖2a)。此外,在6至24小時的處理時間過程中,在12小時觀察到VCLNP組的最高發光強度(圖2b)。為了進一步優化VCLNPs的配方,我們基于L16 (4)4正交表制備了16種不同的配方。配方B2(脂質/2-二油酰基-sn甘油-3-磷酸乙醇胺(DOPE)/膽固醇= 30/30/40)出現在該研究中(圖2c,d)。然后,研究人員通過與正交表中的頂級配方A10(脂質/DOPE/膽固醇= 30/30/50)進行比較來驗證其遞送效率。預測配方B2的發光強度顯著高于配方A10 (P < 0.05,圖2d,e)。在第二輪優化中,研究人員檢測了配方B2的VC-脂質/ mRNA的質量比,從5/1到20/1(圖2d)。當研究人員將VC-脂質/mRNA的質量比增加到15/1時,發光強度增強(配方C5,圖2d,e)。為了測試CatB是否能夠將有效載荷轉運到溶酶體中,研究人員構建了增強型綠色熒光蛋白(eGFP)-CatB mRNA,并用VCLNPs將其轉染RAW264.7細胞。活細胞的共聚焦圖像顯示,EGFP-CatB與LysoTracker Red DND-99共定位于溶酶體中,皮爾遜相關系數為0.93(圖2g),表明CatB將其有效載荷攜帶到溶酶體中。在這些處理中,MAC-RAWs在測試的所有時間點顯示出最強的殺菌活性,抑制率從33%到87%(圖2h)。
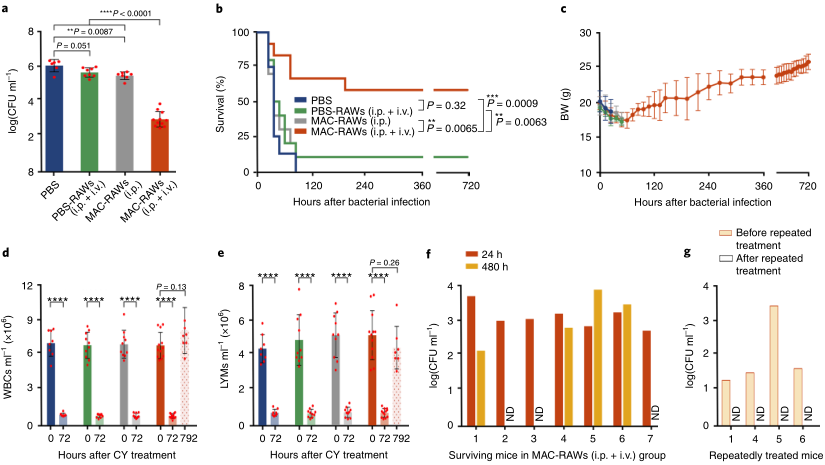
要點3:MAC-RAWs對MDRSA誘導的免疫抑制膿毒癥小鼠的治療作用由于免疫抑制膿毒癥的致死性與不可治愈的病原體有關,研究人員在細胞轉移24小時后測量了小鼠血液中的菌落形成單位(CFUs)。與PBS治療相似,PBS-RAWs并未減少血液中的細菌負擔,而MAC-RAWs (i.p.)和MAC-RAWs (i.p. + i.v.)顯著減少血液中的細菌菌落總數(分別P < 0.01和P < 0.001;圖3a)。這些結果證實了MACS在體內的殺菌活性。此外,MAC- RAWs (i.p.+ i.v.)顯示出比MAC- RAWs (i.p.)更強的清除細菌的能力(P<0.0001,圖3A)。重要的是,與MAC-RAW(i.p.+i.v., 58%)組相比,MAC-RAW(i.p.)組的生存率顯著提高(P<0.01,圖3b)。然后,研究人員對4只持續感染的小鼠進行重復治療,從而清除這些小鼠體內的剩余細菌(圖3g)。一個月后,7只存活小鼠的體重、白細胞和淋巴結水平完全恢復(圖3c-e)。 圖3. MAC-RAWs對MDRSA誘導的免疫抑制膿毒癥小鼠的治療作用
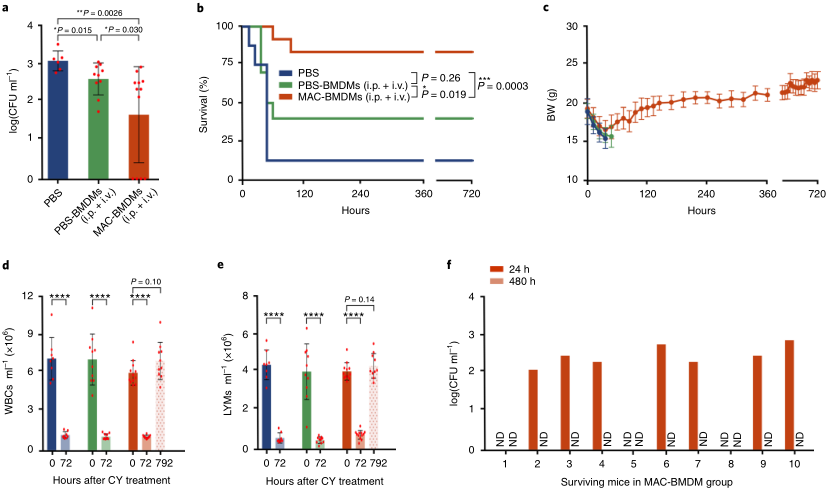
要點4:MAC-BMDMs對免疫抑制多藥耐藥菌混合感染的膿毒癥小鼠的治療作用由于膿毒癥宿主通常暴露在混合細菌感染中,這對治療膿毒癥是一個艱巨的挑戰,研究人員建立了一種同時由MDRSA和MDR大腸桿菌感染的小鼠膿毒癥模型。與PBS或PBS-BMDM治療相比,MAC-BMDM治療顯著降低了血液中的細菌負荷(圖4a)。MAC-BMDM的治療效果還體現在存活率(83%)上,明顯高于PBS組(P<0.001)和PBS-BMDM組(P<0.05) (圖4b)。最后,在所有存活的小鼠中觀察到正常的體重、白細胞和LYM水平(圖4c-f),在血液和主要器官中沒有檢測到持續性感染。圖4. MAC-BMDMs對免疫抑制多藥耐藥菌(金黃色葡萄球菌和大腸桿菌)混合感染的膿毒癥小鼠的治療作用
綜上所述,研究人員通過VCLNPs介導的mRNA傳遞開發了MACs。研究結果證實了MACs過繼轉移通過恢復先天免疫防御、防止細菌免疫逃逸和根除感染,有益地減輕了MDR細菌誘導的免疫抑制膿毒癥小鼠的細菌負擔,提高了小鼠的存活率。未來,這一平臺將主要專注于免疫抑制劑治療膿毒癥晚期。自體巨噬細胞可能在大約一周內制備好,但病人的虛弱和膿毒癥的緊急狀態可能會使收集和工程自體巨噬細胞變得具有挑戰性。隨著誘導多能干細胞技術的進步,可能會制造出同種異體的“通用”巨噬細胞,使來自誘導多能干細胞的巨噬細胞能夠成為包括膿毒癥在內的臨床應用的現成療法。總體而言,MACs的過繼轉移可能為膿毒癥和多藥耐藥細菌感染患者提供了一種治療策略。Xucheng Hou, Xinfu Zhang, Weiyu Zhao, et al. Vitamin lipid nanoparticles enable adoptive macrophage transfer for the treatment of multidrug-resistant bacterial sepsis. Nature Nanotechnology, 2019.DOI: 10.1038/ s41565-019-0600-1https://www.nature.com/articles/s41565-019-0600-1