
閻錫蘊,中科院生物物理所研究員,中國科學院院士。系統研究了具有重要臨床應用前景的腫瘤新靶點,實現了成果轉化。在國際上提出了納米酶新概念,第一次從酶學角度揭示了無機納米材料的酶促反應動力學、催化機制,并將其用于污水治理、腫瘤診斷和埃博拉等病毒的檢測,部分發明專利已進入美國、歐洲和日本。部分代表性成果包括:
1、提出納米酶新概念(Nature Nanotechnology,2007)。原始文章單篇他引超過1900次。設計并研發用于疾病診斷的納米酶試紙條,獲得醫療器械證書,成為全球首個納米酶新產品,探索納米酶催化治療新策略。
2、發現腫瘤血管新靶點CD146(Blood,2003)。此項發現被Faculty1000評為新發現。首次鑒定了CD146的配體,并制備出了靶向CD146的人源化抗體藥物,在肝癌、胰腺癌和結腸癌的治療研究中取得突破進展。其系統性工作成果相繼發表于Nature Communications、Blood 、PNAS 等高水平雜志。靶向CD146的腫瘤治療新策略,獲北京市科學技術獎一等獎并實現了成果轉化;功能性抗體AA98目前正處于臨床前研究階段。
課題組主要研究方向:
(1)納米酶催化機制及應用研究
(2)腫瘤免疫學研究
以下對閻錫蘊院士課題組2019年的部分研究成果進行匯總,供大家學習交流。
(以通訊作者為主,如有疏漏,歡迎指正)
本文內容按照三個部分展開:
(1)綜述
(2)納米酶
(3)CD146免疫
一、綜述
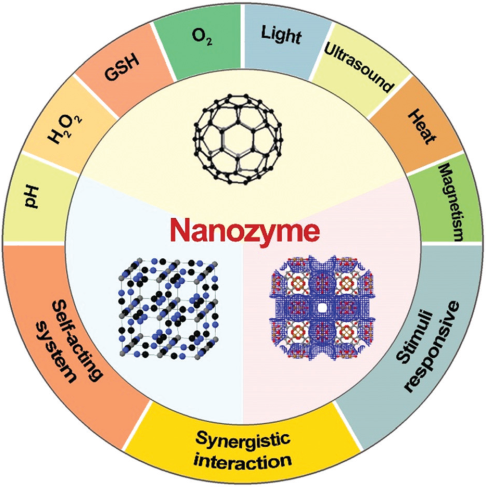
1. Chem. Soc. Rev.:納米酶用于響應性的生物醫學領域
納米酶是以納米材料為基礎的人工酶系統。該系統可通過有效地模擬天然酶的催化位點或囊括多價元素來替代傳統的催化酶。隨著納米技術的迅速發展,人們對納米酶的認識也在不斷加深,它具有比蛋白酶更高的催化穩定性、更易于被修飾和更低的制備成本。因此,納米酶材料不僅是自然酶的替代品,而且還可作為一種多模態平臺應用于復雜的生物環境。
威斯康星大學麥迪遜分校蔡偉波教授團隊、深圳大學黃鵬教授團隊和中科院生物物理研究所閻錫蘊院士團隊合作,對響應一個或多個底物的納米酶系統研究進行了綜述。在不同的微環境中,納米酶的催化活性受pH、H2O2和谷胱甘肽濃度及氧化程度的影響,因此納米酶可以被磁場、光、超聲波和熱等不同的刺激進行控制。通過調控這些刺激因素則可以最大限度地提高納米酶在不同疾病上的診斷和治療效果。

Dawei Jiang, Peng Huang, Xiyun Yan, Weibo Cai,et al. Nanozyme: new horizons for responsive biomedical applications. Chemical Society Reviews, 2019.
https://doi.org/10.1021/acs.accounts.9b00140
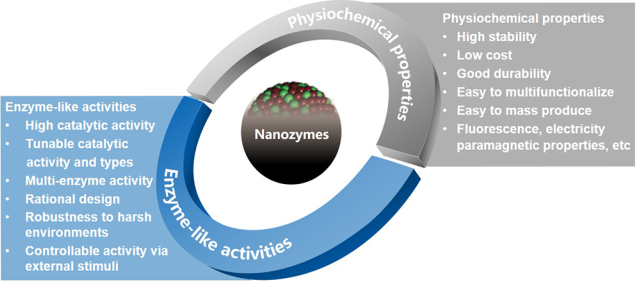
2. Acc. Chem. Res.:納米酶的概念、機理、標準及其應用
納米酶是一種具有類酶特性的納米材料。由于其可以解決天然酶的不足,如穩定性差、成本高、不易儲存等問題,因此在過去十年中得到了蓬勃發展。隨著納米科學技術的快速發展,納米酶也有望直接替代傳統酶用于生產和研究。目前,已有數百種納米材料被發現具有類過氧化物酶、氧化酶、過氧化氫酶、水解酶和超氧化物歧化酶等等多樣的催化活性,有些納米材料還能同時具有雙酶甚至多酶的活性。隨著納米酶學這一新概念的出現,納米酶已成為連接納米技術和生物學的一個重要橋梁。它具有獨特的理化性質和類酶催化活性,可以發展成為多種多功能平臺,進而在體外檢測和體內監測及治療等領域有著廣泛的應用前景。
中科院生物物理研究所梁敏敏博士和閻錫蘊院士合作介紹了關于功能特異性納米酶的設計與構建、納米酶研究的標準化以及納米酶在生物系統中替代天然酶的應用研究進展;并在最后對納米酶的研究前景進行了展望。
Minmin Liang, Xiyun Yan. Nanozymes: From NewConcepts, Mechanisms, and Standards to Applications. Accounts ofChemical Research. 2019
https://pubs.acs.org/doi/10.1021/acs.accounts.9b00140
3. Theranostics綜述:天然的和人工合成的鐵蛋白納米酶作為抗生素
納米酶是一類具有類酶活性的納米材料,可以有效解決了天然酶制備成本高、穩定性差、難以被大規模制備等缺點。由于納米酶結合了化學催化劑和天然酶的優點,因此其在生物醫學領域具有巨大的應用價值。然而,對納米酶進行尺寸可控的合成和靶向修飾仍然具有相當的挑戰性。
鐵蛋白是天然的納米酶,具有多種類酶活性(鐵氧化酶和過氧化物酶等)。而通過在鐵蛋白殼內仿生合成納米酶則可以構建具有自組裝鐵蛋白納米籠和酶活性的人工鐵蛋白納米酶。研究表明,鐵蛋白納米酶在疾病的靶向治療方面具有很好的應用價值。中國科學院生物物理研究所閻錫蘊院士和范克龍研究員等人綜述介紹了鐵蛋白的類酶活性、生物工程合成研究以及應用;最后也對鐵蛋白納米酶在生物醫學研究中的優勢、面臨的挑戰和未來的研究方向進行了重點說明。
Bing Jiang, Xiyun Yan, Kelong Fan. et al. Ferritins as natural and artificial nanozymes for theranostics. Theranostics. 2019
https://www.thno.org/v10p0687.htm
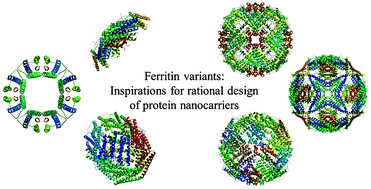
4. Nanoscale:鐵蛋白變體:對合理設計蛋白質納米載體的啟示
鐵蛋白是一種天然的鐵儲存蛋白,具有獨特的結構、自組裝能力和優良的理化性質。除此之外,基因操作可以很容易地調整鐵蛋白納米籠的結構和功能,這進一步擴展了鐵蛋白的生物醫學應用。
于此,中科院生物物理研究所閻錫蘊院士和范克龍研究員等人重點研究人類H-鐵蛋白(一種最近發現的轉鐵蛋白受體1的配體),以綜述其衍生的變體以及相關的結構和特性。希望這篇評論對如何合理設計多功能蛋白籠納米載體進行有效的疾病治療提供新的見解。

Jin Y, He J, Fan K, Yan X. Ferritin variants: inspirations for rationally designing protein nanocarriers. Nanoscale. 2019;11(26):12449-59.
https://pubs.rsc.org/ja/content/articlelanding/2019/nr/c9nr03823j#!divAbstract
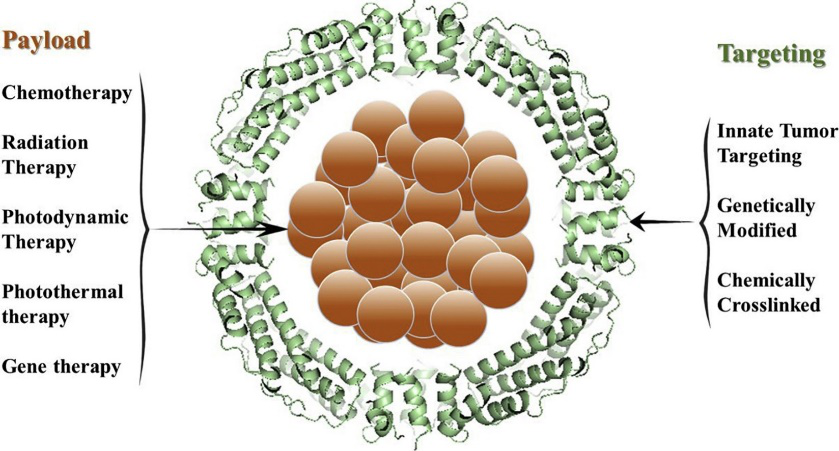
5. J. Control. Release: 鐵蛋白藥物載體用于腫瘤靶向治療
鐵蛋白是一種鐵儲存蛋白,在細胞內的鐵穩態和抗氧化作用中起著關鍵性的作用。由于鐵蛋白具有24個自組裝亞基和能夠包裹藥物的空腔結構,以及可以通過基因和化學修飾獲得額外功能的外表面,使鐵蛋白最近成為一種很有發展前景的藥物遞送載體。最近的研究表明,未經修飾的人重鏈鐵蛋白與其受體轉鐵蛋白受體1(TfR1)結合在不同類型的腫瘤組織中,包括肺癌和乳腺癌,從而突出了鐵蛋白在腫瘤靶向應用中的潛力。
中科院生物物理研究所閻錫蘊和范克龍等人綜述了鐵蛋白藥物載體(FDCs)作為腫瘤藥物載體的許多優點。特別是與抗體-藥物結合物(ADCs)相比,鐵蛋白在載藥能力、熱穩定性和易制備性等方面表現出優越性。因此,FDCs的出現可能是腫瘤靶向治療的下一步。
He J, Fan K, Yan X. Ferritin drug carrier (FDC) for tumor targeting therapy. Journal of Controlled Release. 2019;311-312:288-300.
https://doi.org/10.1016/j.jconrel.2019.09.002
二、納米酶
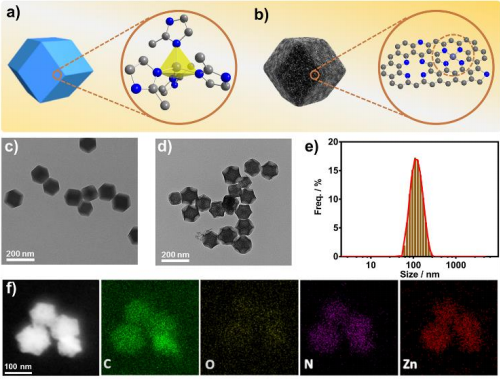
6. Angew:單原子納米酶用于傷口消毒
單原子催化劑(SACs)作為均相催化劑,在化學催化領域得到了廣泛的應用。然而,很少有研究關注SACs在酶催化中的應用。中國科學院生物物理研究所閻錫蘊院士、范克龍研究員和北京化工大學劉惠玉教授等人報道了一種含鋅原子的鋅基咪唑基骨架(ZIF-8)衍生的碳納米材料,可作為一種高效的單原子過氧化物酶模擬物。
為了揭示其構效關系,系統地研究了單原子納米酶(SAzyme)的結構演化。此外,利用密度泛函理論(DFT)計算揭示了SAzyme的協同不飽和活性鋅位和催化機理。SAzyme具有較高的治療效果和生物安全性,在傷口抗菌方面具有廣闊的應用前景。
B. Xu, H. Wang, W. Wang, L. Gao,et al, A Single‐Atom Nanozyme for Wound Disinfection Applications. Angew. Chem. Int. Ed. 2019, 58, 4911.
https://doi.org/10.1002/anie.201813994
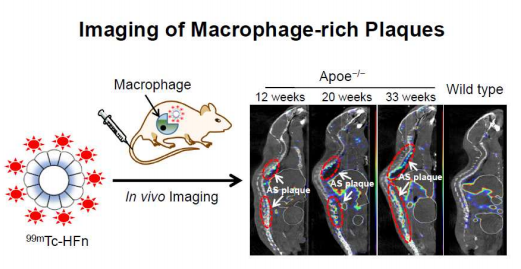
7. ACS Nano:人鐵蛋白納米技術用于動脈粥樣硬化斑塊的成像
炎癥和鈣化作用會同時驅動動脈粥樣硬化斑塊的發展和破壞,也是識別斑塊易損性的有效目標。然而,目前對脆弱的動脈粥樣硬化斑塊的成像受到特異性和敏感性的限制。中科院生物物理研究所閻錫蘊和復旦大學上海醫學院石洪成、程登峰及哈佛醫學院Hak Soo Choi等人報道了99 mTc標記的天然的H-鐵蛋白納米材料(99 mTc-HFn)通過SPECT-CT來識別和精確定位動脈粥樣硬化斑塊。
在斑塊中被攝取的99 mTc-HFn可以定量檢測斑塊的進展和抗炎治療期間炎癥的動態變化。這一策略為利用生物工程內源性人鐵蛋白納米技術來識別脆弱和早期活躍的斑塊以及對抗炎治療的評估奠定了基礎。
Liang, M.M., Tan, H. et al. Bioengineered H-Ferritin Nanocages for Quantitative Imaging of Vulnerable Plaques in Atherosclerosis. ACS Nano 2019.
https://pubs.acs.org/doi/10.1021/acsnano.8b04158
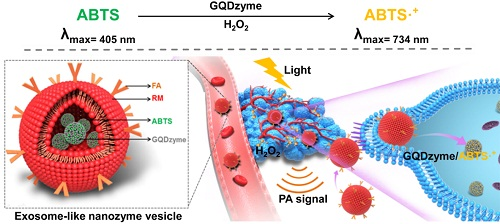
8. Nano Lett.:納米酶催化腫瘤光聲成像新進展
光聲成像結合了純光學成像的高對比度和純超聲成像的高穿透深度優點,能夠提供高對比度和高分辨率的組織成像,是目前非常有應用前景的一種成像模式。目前,光聲成像應用的難點在于設計在腫瘤部位發生的響應型光聲成像反應體系。于此,生物物理所閻錫蘊、范克龍和深圳市第二人民醫院聶國輝等人設計了葉酸修飾的紅細胞膜,將納米酶-底物復合體包裹于膜內,創制出類外泌體納米酶小體。
進入血液循環的類外泌體納米酶小體在外膜的導向下,最終定位并進入腫瘤部位,并釋放納米酶及其底物。腫瘤部位弱酸性環境和高濃度的H2O2觸發納米酶活性,高效催化其底物ABTS轉化成氧化型ABTS。后者具有很強的近紅外光吸收能力,吸收光能后釋放熱能導致腫瘤組織局部溫度升高,從而導致熱膨脹而發出壓力波,產生光聲信號。通過探測光聲信號能重建出組織中的光吸收分布圖像,實現腫瘤的光聲成像診斷。該研究為腫瘤部位響應型光聲成像設計提供了一個實例,為鼻咽癌的診斷提供了一種新思路和新技術。
Hui Ding, Yanjuan Cai, Lizeng Gao, Minmin Liang,et al. Exosome-like Nanozyme Vesicles for H2O2-Responsive Catalytic Photoacoustic Imaging of Xenograft Nasopharyngeal Carcinoma. Nano Letters 2019 19 (1), 203-209
https://pubs.acs.org/doi/10.1021/acs.nanolett.8b03709
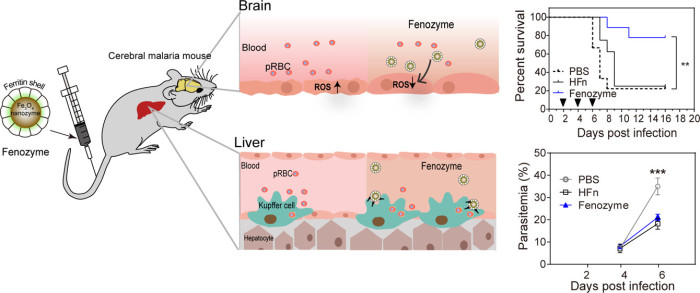
9. Nano Lett.:Fenozyme在腦瘧疾治療取得新進展
先前研究發現,人鐵蛋白(HFn)可以與BBB 內皮細胞(BBB ECs)上表達的HFn受體(HFRs)結合,并作為多功能納米載體用于疾病治療。且含Fe3O4的納米顆粒的納米酶具有類過氧化氫酶的活性,能有效地抑制體內ROS水平。有鑒于此,中科院生物物理研究所閻錫蘊院士和范克龍研究員等人利用HFn蛋白為殼和Fe3O4納米酶為核組成的Fenozyme。
當對患有實驗性腦瘧疾的小鼠給藥時,通過保護BBB ECs免受ROS損傷并通過使巨噬細胞極化至M1表型來降低寄生蟲血癥,Fenozyme大大提高了存活率。此外,將Fenozyme和抗瘧疾蒿甲醚聯合使用可減輕腦病和記憶障礙。結果證明了ROS在腦部瘧疾發展中的重要性,并表明將Fenozyme與抗瘧藥相結合是一種新穎的治療策略。
Zhao, S.; Duan, H.; Yang, Y.; Yan, X.; Fan, K., Fenozyme Protects the Integrity of the Blood–Brain Barrier against Experimental Cerebral Malaria. Nano Letters 2019.
https://doi.org/10.1021/acs.nanolett.9b03774
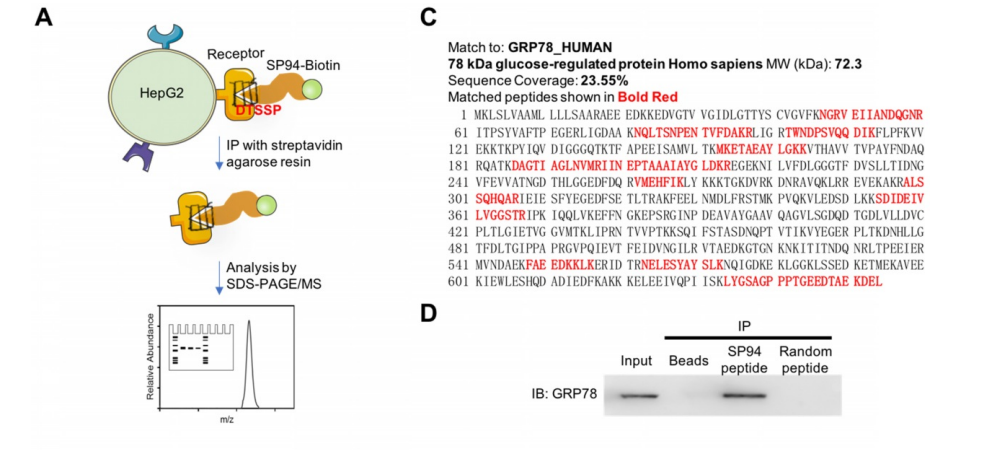
10. Theranostics:GRP78靶向鐵蛋白納米籠治療肝癌
肝細胞癌(Hepatocellular carcinoma,HCC)仍然是導致癌癥死亡的主要原因之一,其主要原因是其高復發率和高轉移率。因此,為開發有效的療法已付出了巨大的努力;然而,有效的抗肝癌治療依賴于確定合適的生物標記物,其中很少有可用于藥物靶向的。
中國科學院生物物理研究所閻錫蘊院士和范克龍研究員等人通過免疫沉淀和質譜分析鑒定GRP78為肝癌靶向肽SP94的膜受體。為了開發一種有效的抗肝癌藥物納米載體,研究人員首先通過基因工程的方法將GRP78靶向肽SP94修飾在Pyrococcus furiosus菌鐵蛋白Fn(HccFn)的外表面,然后通過基于尿素的拆卸/重組方法將多柔比星(Dox)負載到HccFn的空腔中,從而構建了一種稱為HccFn-Dox的藥物納米載體。
實驗結果證明HccFn納米籠包埋了超高劑量的Dox(多達400分子Dox/蛋白納米籠)。體內動物實驗表明,HccFn-Dox包埋的Dox可選擇性地進入HCC腫瘤細胞,有效地殺死皮下和肺轉移的HCC腫瘤。此外,與游離Dox相比,HccFn-Dox顯著減少了對健康器官的藥物暴露,并將最大耐受劑量提高了六倍。因此,GRP78是一種有效的肝癌治療生物標志物,GRP78靶向HccFn納米籠在不損傷健康組織的情況下有效地給藥。
Jiang B, Zhang R, Zhang J, Hou Y, Chen X, Zhou M, Tian X, Hao C, Fan K, Yan X. GRP78-targeted ferritin nanocaged ultra-high dose of doxorubicin for hepatocellular carcinoma therapy. Theranostics 2019; 9(8):2167-2182.
http://www.thno.org/v09p2167.htm
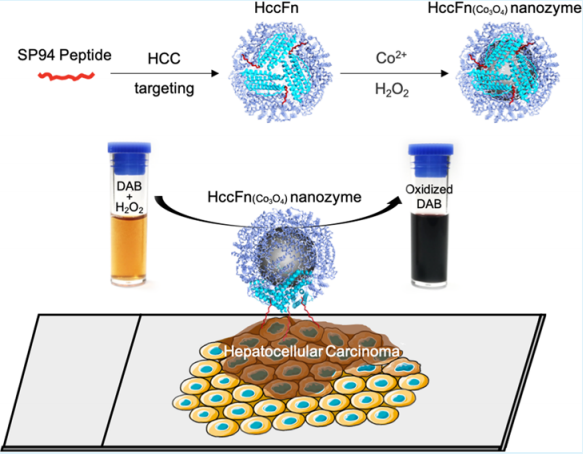
11. ACS AMI:鈷納米酶對肝癌預后診斷
中國科學院生物物理研究所閻錫蘊院士、范克龍研究員和北京大學腫瘤醫院郝純毅等人通過在SP94鐵蛋白納米籠進行生物礦化Co3O4,報道了一種單分散鐵蛋白鈷納米酶(HccFn(Co3O4))特異性靶向和可視化臨床肝細胞癌(HCC)組織。
Jiang B, Yan L, Zhang J, Zhou M, Shi G, Tian X, et al. Biomineralization Synthesis of the Cobalt Nanozyme in SP94-Ferritin Nanocages for Prognostic Diagnosis of Hepatocellular Carcinoma. ACS Applied Materials & Interfaces. 2019;11(10):9747-55.
https://doi.org/10.1021/acsami.8b20942
三、CD146免疫
12. Nature Commun.: 促進血管重塑和肺動脈高壓新機制
肺動脈高壓(PAH)是心肺單位的血管重塑疾病。由于對血管重塑的不完全了解,目前尚無治愈方法。于此,中科院生物物理研究所閻錫蘊和中國農業大學羅永挺等人確定CD146低氧誘導轉錄因子1α(HIF-1α)交叉調節是血管重塑和PAH發病機理中的關鍵決定因素。CD146在肺動脈平滑肌細胞(PASMCs / SMCs)中明顯上調,并與疾病嚴重程度成正比。CD146表達和HIF-1α轉錄程序相互促進,使PASMCs在生理上具有更為綜合的表型。
通過基因切除SMCs中的CD146以破壞CD146-HIF-1α串擾,可減輕慢性低氧小鼠的肺血管重塑。令人驚訝的是,在兩個嚙齒動物模型中,用抗CD146抗體靶向可減輕已建立的肺動脈高壓(PH),并增強心臟功能。這項研究為允許血管重塑的低氧重編程提供了機制性的見解,因此通過直接調節CD146-HIF-1α交叉調節為PAH的抗重塑治療提供了概念證明。
Luo, Y., Teng, X., Zhang, L. et al. CD146-HIF-1α hypoxic reprogramming drives vascular remodeling and pulmonary arterial hypertension. Nat Commun 10, 3551 (2019)
https://doi.org/10.1038/s41467-019-11500-6
除此之外,閻錫蘊院士課題組還有與其他課題組合作的研究成果和綜述在此不一一列舉,感興趣的讀者可前往閻錫蘊院士課題組網站進行學習。
課題組網站:http://www.ibp.cas.cn/yanlab/
閻錫蘊院士簡介

閻錫蘊,納米生物學家,中國科學院院士,中國科學院生物物理研究所研究員、博士生導師,蛋白質與多肽藥物所重點實驗室主任。研究方向:腫瘤免疫學研究:發現新靶點、發展腫瘤精準治療新策略;納米酶催化機制及應用研究:探究納米酶的催化機制,實現其可控制備,拓展納米酶在疾病診斷、傳染病監測、污水治理等方面應用研究。











