NanoLabs編輯部對2019年國內外重要科研團隊的代表性重要成果進行了梳理,今天,我們要介紹的是國家納米科學中心梁興杰研究員。

梁興杰課題組致力于研究如何發展生物材料,利用納米技術提高小分子化合物和生物大分子生物利用度的分子和細胞生物學機制,并探索新型納米結構促進重大惡性疾病的藥物療效和臨床治療的方法。
課題組正在探尋通過提高藥物分子的輸運效率來達到顯著改善治療效果或者預防癌癥和艾滋病的納米生物技術,利用生物響應型納米材料在細胞和組織水平提高藥物安全性和治療效果。
目前實驗室主要研究內容如下:
1、納米生物材料
2、納米生物技術
3、聚合物納米顆粒
4、納米佐劑
5、無機納米顆粒
6、納米技術逆轉腫瘤細胞耐藥性
7、納米技術用于發展新型納米藥物
下面,我們簡要總結了梁興杰研究員課題組2019年部分研究成果,供大家交流學習。
1)由于相關論文數量較多,本文僅限于通訊作者文章(不包括序言、短篇評述等),以online時間為準。
2)由于學術有限,所選文章及其表述如有不當,敬請批評指正。
3)由于篇幅限制,部分成果未列入編號,僅以發表截圖展示。
以下分為四個方面展開:
Part Ⅰ 納米藥物腫瘤治療與成像
Part Ⅱ 納米免疫治療
Part Ⅲ 納米抗菌應用
Part Ⅳ 其他
Part Ⅰ 納米藥物腫瘤治療與成像
1. Nature Nanotech.:碳點分散金原子用于治療癌癥
線粒體氧化還原穩態是活性氧和抗氧化劑(如谷胱甘肽)之間的平衡,在許多生物過程(包括生物合成和細胞凋亡)中起著關鍵作用,因此是癌癥治療的一個潛在靶點。于此,國家納米中心的梁興杰研究員與清華大學化學系的李景虹教授合作報道了一種線粒體氧化應激放大器,MitoCAT-g,它由碳點支撐的原子分散金(CAT-g)和表面修飾的三苯膦和肉桂醛組成。
研究結果發現,MitoCAT-g顆粒能特異性靶向線粒體并通過原子經濟性消耗線粒體谷胱甘肽,從而放大了由肉桂醛引起的活性氧損傷,并最終導致癌細胞凋亡。結果顯示,影像引導介入注射這些顆粒能有效地抑制皮下和原位模型中的腫瘤生長,而沒有不良影響。研究表明,MitoCAT-g可放大線粒體中的氧化應激并抑制體內腫瘤的生長,代表了應用與抗癌的一種有前景的藥物。
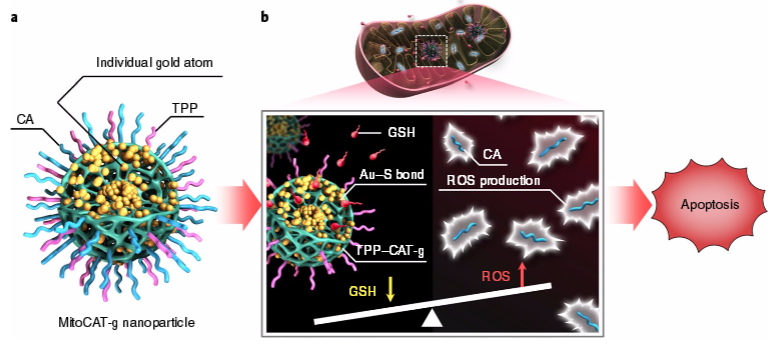
Xingjie Liang et al. Carbon-dot-supported atomically dispersed gold as a mitochondrial oxidative stress amplifier for cancer treatment. Nature Nanotechnology. 2019.
https://doi.org/10.1038/s41565-019-0373-6
2. Science Advances:向陽花一樣的多級次納米藥物!
為了增強和控制基于基因干擾的治療方法而開發有效的基因藥物遞送系統仍面臨巨大挑戰。然而,隨著納米技術的蓬勃發展,納米載體為核酸輸送提供了更有效的策略。因此,國家納米中心梁興杰研究員課題組開發一種由寡核苷酸序列形成的三鏈體及其互補鏈用來介導自組裝的超小金納米顆粒。
向日葵狀納米結構具有較強的近紅外(NIR)吸收和光熱轉化能力。在近紅外光照射下下,大尺寸的納米結構可分解并生成由c-myc癌基因沉默序列修飾的超小納米顆粒,該序列可直接靶向細胞核。此外,可通過與自組裝納米結構在體內體外的預孵育時間和近紅外照射時間點協同來實現基因沉默控制的效果。這項研究為構建用于基因干擾應用的更有效和可定制的納米載體提供了一種新方法。
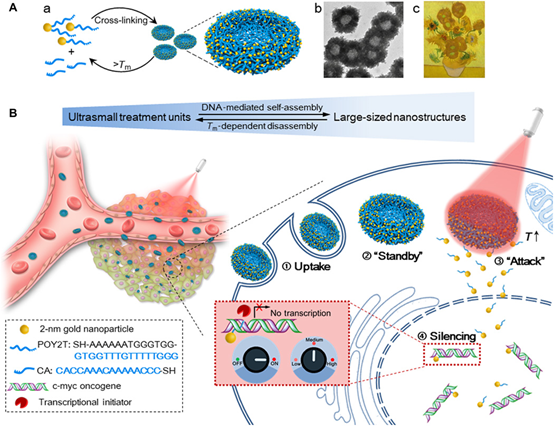
Huo, S.; Gong, N.; Jiang, Y.; Chen, F.; Guo, H.; Gan, Y.; Wang, Z.; Herrmann, A.; Liang, X.-J., Gold-DNA nanosunflowers for efficient gene silencing with controllable transformation. Science Advances 2019, 5 (10), eaaw6264.
https://advances.sciencemag.org/content/5/10/eaaw6264
3. Adv. Sci.:納米催化自給O2和H2O2以增強化學/化學動力學聯合療法
化學/化學動力學聯合療法是提高抗癌效率的一個非常有前景的策略。但是,大多數實體瘤中的低氧和少量H2O2的微環境嚴重限制了該治療方式的療效。于此,河北大學張金超教授和李振華副教授課題組聯合國家納米中心梁興杰研究員通過自下而上的方法構建納米催化藥物CaO2 @DOX@ZIF-67。
CaO2 @DOX@ZIF-67可以同時提供O2和H2O2,以提高化學/化學動力療法。 在腫瘤內的弱酸性環境中,CaO2 @DOX@ZIF-67被分解以快速釋放類Fenton催化劑Co2+和化學治療藥物阿霉素(DOX)。未保護的CaO2與H2O反應生成O2和H2O2。產生的O2可緩解腫瘤中的缺氧,并進一步提高DOX的療效。與此同時,生成的H2O2通過類Fenton反應與Co2+離子反應生成劇毒的?OH,從而提高了化學動力學治療。
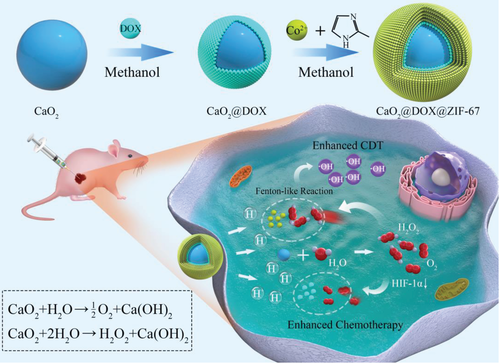
Gao, S., Jin, Y., Ge, K., Li, Z., Liu, H., Dai, X., Zhang, Y., Chen, S., Liang, X., Zhang, J., Self‐Supply of O2 and H2O2 by a Nanocatalytic Medicine to Enhance Combined Chemo/Chemodynamic Therapy. Adv. Sci.2019, 1902137.
https://onlinelibrary.wiley.com/doi/10.1002/advs.201902137
4. Adv. Sci.:酸觸發金納米粒子聚集用于增強的放療增敏和成像
放射增敏劑用于增強腫瘤的放射治療效果具有非常好的作用。中國醫學科學院放射醫學研究所劉鑒峰研究員聯合國家納米中心梁興杰研究員提出了一種由酸引發的金納米顆粒(GNPs)在腫瘤內聚集的策略,并將其作為放射增敏劑用于增強腫瘤的放療效果。
具有酸誘導聚集的GNPs可以增強GNPs在癌細胞和腫瘤中的積累和保留。體內抗腫瘤實驗結果表明,GNPs也提高了MCF-7異種移植腫瘤對放療的敏感性。此外,GNPs的聚集也可以改善了GNPs在體內光聲成像的效果。這項研究提供了一種新的策略來實現納米顆粒的聚合,以提高納米系統在體內的成像和治療效果。
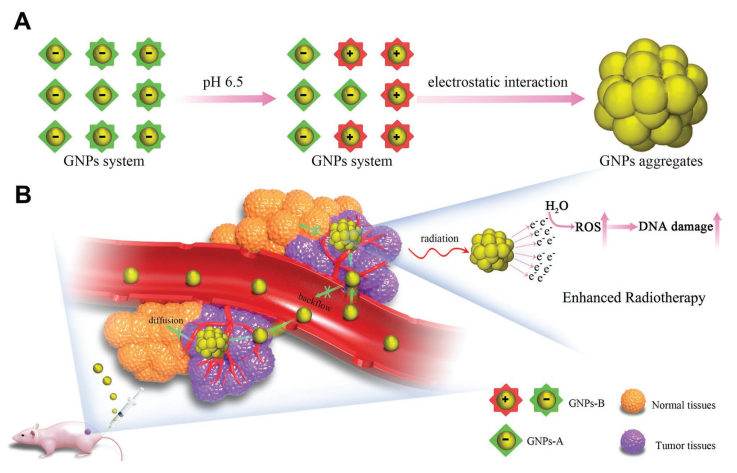
Zhang Y M, Huang F, etal. Enhanced Radiosensitization by Gold Nanoparticles with acid-Triggered Aggregation in Cancer Radiotherapy[J]. Advanced Science, 2019.
https://doi.org/10.1002/advs.201801806
5. Adv. Sci.:透明質酸納米顆粒用于靶向治療癌癥
靶向藥物遞送系統(TDDSs)可以實現特異性地腫瘤靶向和藥物釋放,為克服傳統化療的副作用提供了一種很好的方法。透明質酸(HA)作為一種可選擇性靶向CD44的藥物,在TDDSs研究中得到了廣泛的應用。然而,不同分子量的HA對CD44具有不同的結合能力,這也會產生不同的治療效果。大連理工大學樊江莉團隊和國家納米科學中心梁興杰團隊合作制備了一種負載了阿霉素(DOX)的二氧化硅/羥基磷灰石(MSNs/HAP)雜化材料(DOX@MSNs/HAP)。
隨后將HA和低聚HA(oHA)分別包覆在雜化材料上構建了HA-DOX@MSNs/HAP和oHA-DOX@MSNs/HAP,并研究了它們各自的腫瘤靶向性。結果發現由于oHA對于靶向CD44更加有效,oHA-DOX@MSNs/HAP在腫瘤內具有更高的細胞吸收和藥物釋放效率,因此其抗癌作用也有顯著增強,荷瘤小鼠模型實驗也同樣證明了這一點。因此,該研究也為今后設計靶向腫瘤的化療納米藥物遞送系統提供了新的思路。
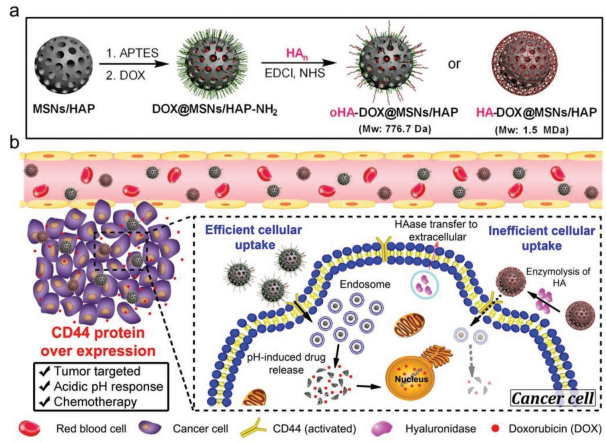
Yao Kang, Jiangli Fan, XingJie Liang, Xiaojun Peng. et al. Oligo Hyaluronan-Coated Silica/Hydroxyapatite Degradable Nanoparticles for Targeted Cancer Treatment. Advanced Science. 2019
https://doi.org/10.1002/advs.201900716
6. Nano Lett.:磁性鐵氧納米材料用于MRI/MPI和磁熱治療
磁熱治療所面臨的兩個主要難題是定量評估給藥期間和給藥后的藥物分布以及在不損傷周圍組織的情況下實現腫瘤的均勻熱療。中科院自動化研究所田捷團隊和國家納米科學中心梁興杰團隊合作開發了一種具有活性生物靶向作用的多模態MRI/MPI診療系統用于進行改善的磁熱治療(MHT)。
該系統具有增強的磁共振成像(MRI)和磁粒子成像(MPI)效應,并且研究發現18納米的氧化鐵NPs (IOs)可以作為一種高性能的體外MRI / MPI造影劑。為了提高其遞送的均勻性,實驗使用腫瘤靶向肽CREKA對18納米IOs進行修飾使其可以靶向腫瘤。MRI/MPI結果顯示,靶向劑可以顯著改善納米顆粒在4T1原位小鼠乳腺癌腫瘤中的遞送均勻性。治療結果顯示,通過提高靶向性和遞送均勻性可以使得該系統比其他非靶向的IOs具有更好的腫瘤磁熱治療效率。
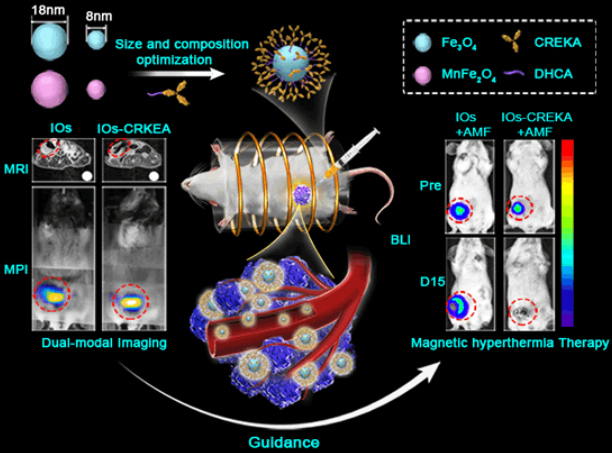
Yang Du, Xiaoli Liu, Qian Liang, Xing-Jie Liang, Jie Tian. Optimization and Design of Magnetic Ferrite Nanoparticles with Uniform Tumor Distribution for Highly Sensitive MRI/MPI Performance and Improved Magnetic Hyperthermia Therapy. Nano Letters. 2019
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00630
另外:

Part Ⅱ 納米免疫療法
7. ACS Nano: 鐵磁渦旋納米環介導的微磁熱療對抗腫瘤轉移
癌癥轉移是導致其治療失敗的一個主要原因。中科院自動化研究所杜洋博士、田捷研究員、西北大學樊海明教授和國家納米科學中心梁興杰研究員合作報告了一種有效安全的納米治療策略,可以根除原發性腫瘤,并抑制其肺部轉移,進而控制遠處腫瘤的轉移和生長。
該鐵磁渦旋氧化鐵納米環(FVIO)介導的輕度磁熱療會導致4T1乳腺癌細胞鈣網蛋白(CRT)的表達。而CRT的表達會傳遞“吃我”的信號,進而促進免疫系統對癌細胞的吞噬吸收,誘導有效的免疫原性細胞死亡,并進一步導致巨噬細胞極化。這種溫和的熱療法可以有效增強遠處腫瘤的CD8+細胞毒性T淋巴細胞的浸潤,并有效地使腫瘤對PD-L1檢查點阻斷治療敏感而觸發免疫治療。而在與PD-L1阻斷治療進行結合后,CD8+細胞毒性T淋巴細胞的比例可進一步從55.4%提高到64.5%。此外,該聯合治療也可抑制腫瘤的免疫抑制反應,使得骨髓源性抑制細胞(MDSCs)顯著下調。這一研究結果表明,FVIO介導的溫和磁熱療法可以激活宿主免疫系統,并可通過與PD-L1阻斷試劑的有效合作以抑制遠處腫瘤的轉移擴散和生長。
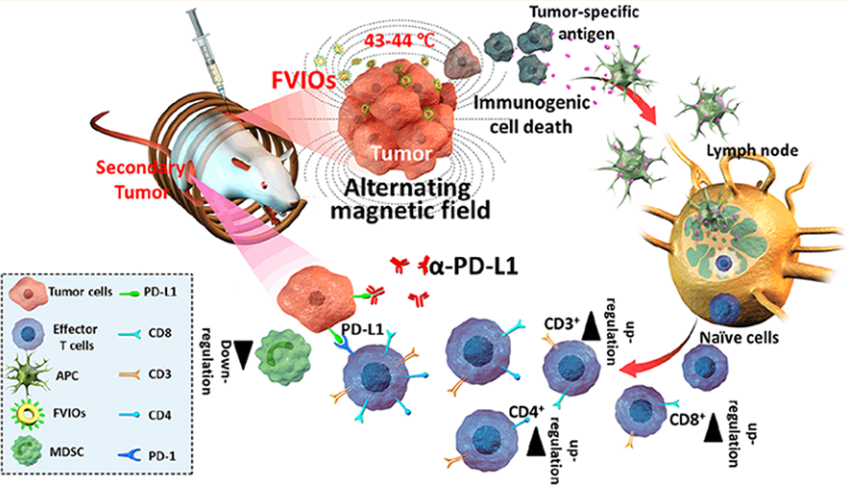
Xiaoli Liu, Yang Du, Haiming Fan, Jie Tian, Xing-Jie Liang. et al. Ferrimagnetic Vortex Nanoring-Mediated Mild magnetic Hyperthermia Imparts Potent Immunological Effect for Treating Cancer Metastasis. ACS Nano. 2019
https://pubs.acs.org/doi/10.1021/acsnano.9b01979
8. Biomaterials:納米藥物和納米疫苗的共定位遞送用于術后癌癥免疫治療
實體瘤的免疫治療受到腫瘤免疫原性差和T細胞免疫應答受限的限制,導致患者應答率低。為了提高腫瘤免疫治療的效率,中國醫學科學院王偉偉研究團隊聯合天津大學董岸杰研究團隊及國家納米科學中心梁興杰研究團隊開發了一種獨特的協同聯合腫瘤免疫治療方法,通過共定位遞送腫瘤納米藥物(增強腫瘤免疫原性)和納米疫苗(增強T細胞免疫力)用于術后腫瘤治療。其中,熱響應、負載姜黃素的聚合物納米顆粒(納米藥物)組裝的水凝膠能夠完全覆蓋原發性腫瘤的手術床,并在時空上傳遞同源納米藥物和封裝的納米疫苗。
更重要的是,納米藥物有效地誘導了殘余癌細胞的免疫原性死亡(ICD),從而增強了腫瘤的免疫原性,并使腫瘤對抗腫瘤T細胞免疫敏感。該腫瘤納米疫苗由抗原肽、CpG-ODN和陽離子聚合物納米顆粒組成,能顯著觸發樹突狀細胞(DCs)的成熟,并能引起強效的疫苗特異性T細胞免疫反應。采用高度惡性的術后乳腺癌4T1模型,發現聯合免疫治療策略顯著增強了全身宿主T細胞免疫水平,促進了腫瘤內CD8+ T淋巴細胞的浸潤,從而有效減弱了腫瘤局部復發和肺轉移。總的來說,這項工作為術后腫瘤免疫治療提供了一種先進的協同聯合療法。這種自組裝水凝膠能夠實現免疫調節納米藥物和疫苗的廣泛結合用于癌癥免疫治療。
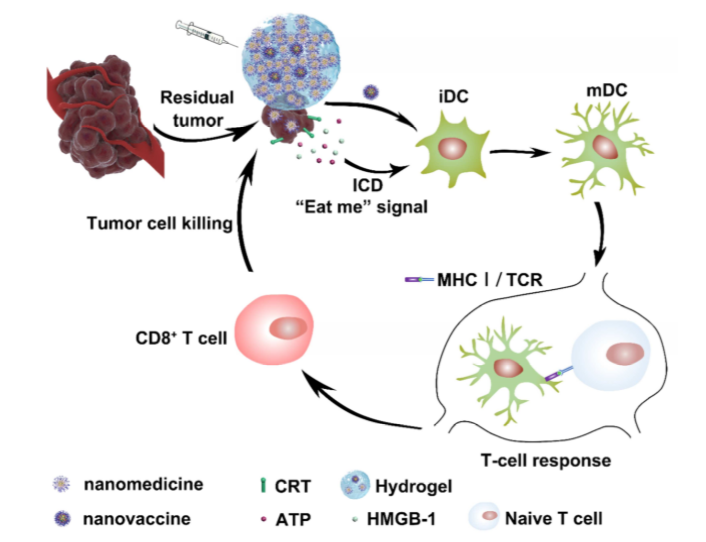
Xiang Liu, Zujian Feng, Changrong Wang, et al. Co-localized delivery of nanomedicine and nanovaccine augments the postoperative cancer immunotherapy by amplifying T-cell responses. Biomaterials, 2019.
https://doi.org/10.1016/j.biomaterials.2019.119649
Part Ⅲ 納米抗菌應用
9. Nature Commun.:熱響應三功能納米轉運體用于治療多藥耐藥細菌感染
據世界衛生組織統計,近80%多藥耐藥(MDR)或極度耐藥(XDR)微生物的出現是由于全球過度使用或濫用抗生素而導致的,這些菌株的感染伴隨有嚴重的副作用,如血栓性靜脈炎或表皮壞死松解,因此,迫切需要開發一種對多藥耐藥菌具有高抗菌作用的新策略。近日,國家納米科學中心梁興杰研究團隊聯合重慶大學羅陽研究團隊設計了一種巧妙的三功能納米結構,即TRIDENT(熱響應應激藥物輸送納米轉運體),用于可靠的細菌根除。其強大的抗菌效果歸功于將熒光檢測與協同化學光熱滅活相整合。
其中,近紅外輻射產生的升溫不僅通過相變機制熔化了納米轉運體,而且不可逆轉地破壞了細菌膜以促進亞胺培南的滲透,從而干擾細胞壁生物合成,最終導致細菌快速死亡。體內和體外實驗都表明,即使是封裝了低劑量的亞胺培南TRIDENT也能根除臨床耐甲氧西林金黃色葡萄球菌,而單用亞胺培南的效果是有限的。由于受感染部位的迅速恢復和良好的生物相容性,此抗菌策略可用于對抗多藥耐藥或極端耐藥細菌。
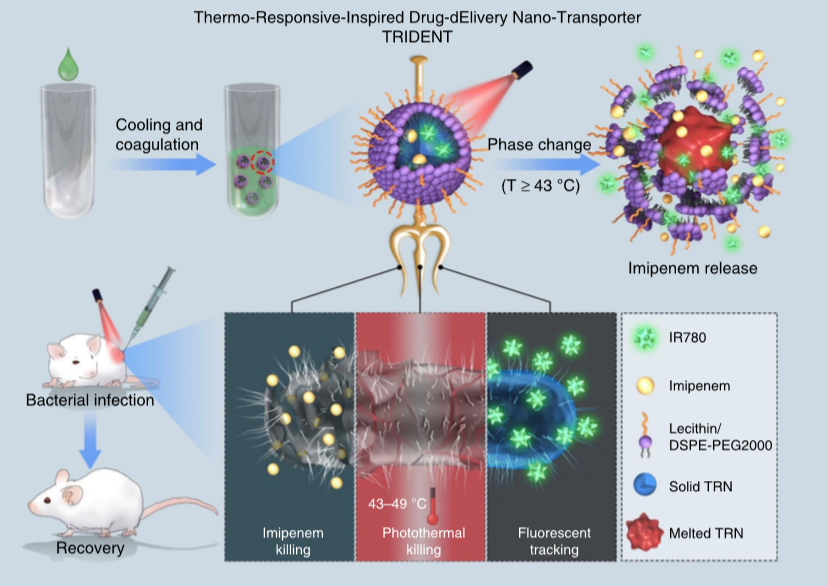
Qing, G., Zhao, X., Gong, N. et al. Thermo-responsive triple-function nanotransporter for efficient chemo-photothermal therapy of multidrug-resistant bacterial infection. Nat Commun 10, 4336 (2019)
https://doi.org/10.1038/s41467-019-12313-3
10. ACS Nano:天然中藥納米結構用于抗菌
傳統抗生素的濫用導致了一系列的健康問題,包括抗生素耐藥性,嚴重威脅著人類的健康。因此,尋找廣泛的抗菌藥物來源和開發多維策略來對抗細菌感染是當務之急。有鑒于此,北京中醫藥大學雷海民研究員、王鵬龍副教授聯合國家納米中心梁興杰研究員報道了黃連素(Berberine, BBR)與黃酮苷類化合物(flavonoid glycosides)之間的兩種天然自組裝模式:納米顆粒(NPs)和納米纖維(NFs),它們都主要受靜電和疏水作用的控制。
這兩種納米結構具有不同于BBR的抗菌性能。NPs的抑菌活性明顯增強,而NFs的抑菌效果遠弱于BBR。如此不同的區別可歸因于NPs和NFs的不同空間構型和自組裝過程。黃酮苷和BBR首先形成一維復合單元,然后自組裝成三維納米結構。隨著親水性葡萄糖醛酸的不斷向外遷移,NPs對細菌具有較強的親和力,從而導致細菌種群的分散和生物膜的減少。此外,體外溶血試驗、細胞毒性試驗和斑馬魚體內毒性評價表明,所獲得的自組裝體具有良好的生物相容性。這種超分子自組裝策略可應用于其他納米抗菌藥物的構建,從而為細菌感染治療中自遞送藥物的開發提供了武器。
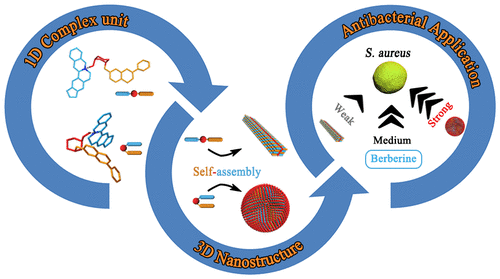
Tong Li, Penglong Wang, Xing-Jie Liang, Haimin Lei, et al. Natural Berberine-Based Chinese Herb Medicine Assembled Nanostructures with Modified Antibacterial Application. ACS Nano 2019 13 (6), 6770-6781
https://doi.org/10.1021/acsnano.9b01346
Part Ⅳ 其他
11. ACS Nano:納米藥物介導遞送甲氨蝶呤用于治療類風濕性關節炎
類風濕關節炎(RA)是最常見的慢性自身免疫性疾病之一。盡管目前對RA的臨床治療取得了相當大的進展,但也存在諸多尚未解決的挑戰。羅馬第二大學Massimo Bottini團隊、國家納米科學中心梁興杰團隊和廣州醫科大學郭偉圣團隊合作發現RA患者和膠原誘導關節炎(CIA)小鼠的滑膜液和滑膜中均有過表達的SPARC,它會分泌酸性蛋白并且富含半胱氨酸。
基于RA微環境中的SPARC特征和SPARC對白蛋白的高親和力,實驗制備了負載甲氨蝶呤的人血清白蛋白納米藥物(MTX@HSA NMs),并將其作為治療RA的仿生藥物遞送系統。在向CIA小鼠靜脈注射Ce6標記的MTX@HSA NMs后,熒光/磁共振雙模態成像結果表明,相對于游離的MTX分子來說,炎癥關節中MTX@HSA NMs的累積量更高,保留時間也更長。體內治療結果表明,MTX@ HSA NMs能夠有效減輕RA,即使劑量減半也比游離的MTX有著更好的療效和更少的副作用。這一研究通過揭示MTX@ HSA NMs在RA內高效積累的機制,證明其具有提高MTX安全性和治療效果的能力,也將為開發具有臨床轉化潛力的創新型抗RA納米藥物提供了新的方向。
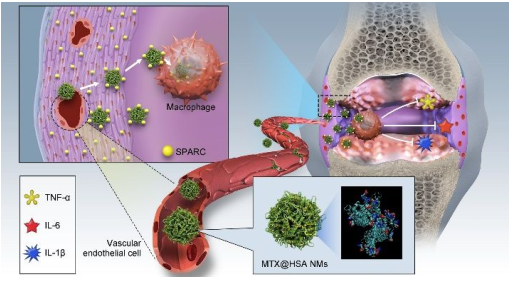
Lu Liu, Massimo Bottini, Weisheng Guo, Xing-Jie Liang. et al. Secreted Protein Acidic and Rich in Cysteine Mediated Biomimetic Delivery of Methotrexate by Albumin-Based Nanomedicines for Rheumatoid Arthritis Therapy. ACS Nano. 2019
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b01710
12. Nano Lett:Au NPs尺寸通過破裂高爾基體而對細胞粘附的影響
與納米材料的蓬勃生產和應用相比,納米顆粒的毒理學影響及其對組織和器官可能的危害的研究仍處于起步階段。高爾基體是細胞中最重要的細胞器之一,在細胞內蛋白質加工中起關鍵作用。高爾基體的結構完整性對其正常功能至關重要,高爾基體紊亂可能導致多種疾病和失調。
在這項研究中,國家納米中心梁興杰研究員與河北大學張金超教授等人首次發現金納米顆粒(Au NPs)誘導了大小依賴性的細胞質鈣增加和高爾基體碎裂,這阻礙了正常的高爾基體功能,導致異常的蛋白質加工,并導致細胞黏附力降低,而細胞活力卻沒有嚴重受損。另外,在體內誘導了早期的腎臟病理變化。這項工作對納米顆粒研究具有重要意義,因為它說明了尺寸對金納米顆粒誘導的高爾基體形態變化及其在體內外的影響的重要作用,這對納米材料的生物學應用具有重要意義。
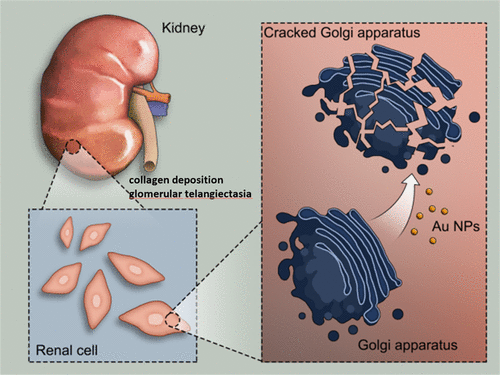
Xiaowei Ma, Jinchao Zhang, and Xing-Jie Liang, et al. Evaluation of Turning-Sized Gold Nanoparticles on Cellular Adhesion by Golgi Disruption in Vitro and in Vivo. Nano Letters 2019.
https://doi.org/10.1021/acs.nanolett.9b02826
梁興杰研究員簡介

梁興杰,國家納米科學中心研究員,享受國務院特殊津貼,國家杰青,科技部中青年科技創新領軍人才,中國科學院大學-教育部“長江學者”特聘教授。
目前主要從事納米結構的生物學效應,以及設計構建納米藥物研究其克服臨床適用性耐受的作用機制。已在Nature Nanotechnology, PNAS,Cancer Research,ACS Nano, Advanced Materials,Biomaterials等國際重要學術期刊發表論文290余篇,文章引用率超13000次, H-index > 62。現擔任《Current Drug Delivery》主編,《Biophysics Reports》和《Biomaterials》副主編,《ACS Nano》、《AdvancedTherapeutics》等雜志顧問委員會編委和編委。
(注:以上簡介及文中海報整理自網絡及梁興杰研究員課題組網站)











