在2018年,9價HPV疫苗(宮頸癌疫苗)在我國上市時候,國內(nèi)市場是一針難求,這說明癌癥疫苗的市場需求是非常巨大的。下面對近一個月來發(fā)表在頂刊上的與生物材料相關(guān)的癌癥疫苗進行整理,供大家學(xué)習(xí)和交流。
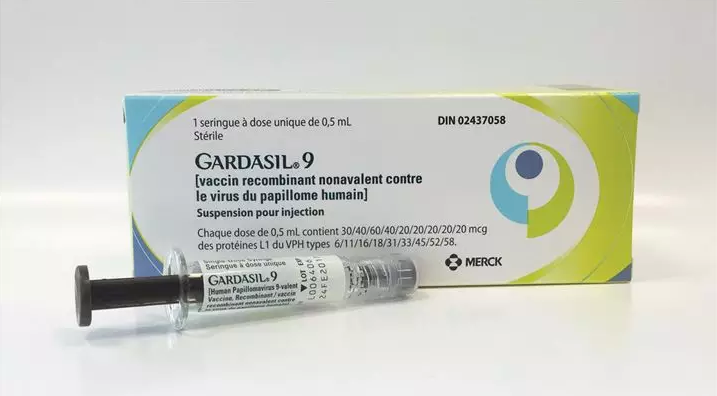
2020年1月14日,生物材料大牛David J. Mooney教授和David T. Scadden教授等人在Nature Biomedical Engineering在線發(fā)表使用生物材料基疫苗對急性白血病進行持久性治療。
Nature Biomed. Eng.:生物材料基疫苗持久抗白血病

急性髓細(xì)胞性白血病(AML)是源自造血系統(tǒng)的惡性腫瘤,治療方案有限。細(xì)胞減滅化學(xué)療法能消耗AML細(xì)胞,以緩解病情,但很少能治愈。骨髓中的免疫抑制性AML微環(huán)境和合適的免疫治療靶標(biāo)的缺乏限制了有效免疫應(yīng)答的誘導(dǎo)。
有鑒于此,在AML小鼠模型中,哈佛大學(xué)的生物材料大牛David J. Mooney教授和David T. Scadden教授設(shè)計了大孔生物材料疫苗,可用于遞送細(xì)胞因子(粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)),Toll樣受體9激動劑和一種或多種白血病抗原(以確定的肽抗原、細(xì)胞裂解物或源自體內(nèi)募集的AML細(xì)胞的抗原的形式),誘導(dǎo)局部免疫細(xì)胞浸潤和活化的樹突狀細(xì)胞,引起有效的抗AML反應(yīng)。基于生物材料的疫苗在預(yù)防劑和與化學(xué)療法結(jié)合使用時可防止AML細(xì)胞的植入,并且即使在沒有確定的疫苗抗原的情況下,也可根除已建立的AML。以生物材料為基礎(chǔ)的AML疫苗可以誘導(dǎo)有效的免疫應(yīng)答,消耗AML細(xì)胞,防止疾病復(fù)發(fā)。

Shah, N.J., Najibi, A.J., Shih, T. et al. A biomaterial-based vaccine eliciting durable tumour-specific responses against acute myeloid leukaemia. Nat Biomed Eng (2020)
https://doi.org/10.1038/s41551-019-0503-3
UCLA顧臻等人對此發(fā)表點評,題為:AML的預(yù)防和治療
Chen, G., Gu, Z. A prophylactic and a therapeutic against AML. Nat Biomed Eng (2020)
https://doi.org/10.1038/s41551-019-0509-x
2020年1月13日,來自國立衛(wèi)生研究院Robert A. Seder和Geoffrey M. Lynn等人的發(fā)表在Nature Biotechnology的一項研究利用肽自組裝形成納米疫苗以增強抗癌T細(xì)胞免疫。
Nature Biotech.:納米疫苗增強T細(xì)胞免疫

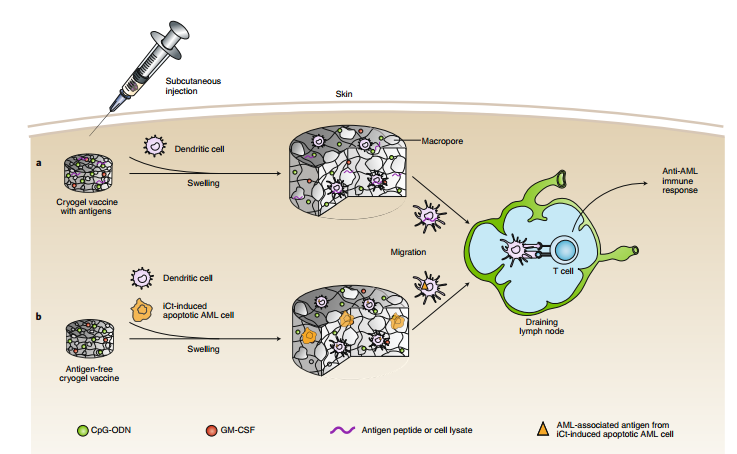
針對患者特異性新抗原的個體化癌癥疫苗是一種非常有前景的癌癥治療方法。然而,新抗原的物理化學(xué)易變性,可能會給最佳的個性化癌癥疫苗的生產(chǎn)帶來挑戰(zhàn)。于此,國立衛(wèi)生研究院Robert A. Seder、Geoffrey M. Lynn等人基于電荷修飾的肽TLR-7/8a共軛物開發(fā)了一個疫苗平臺(SNP-7/8a),該共軛物經(jīng)過化學(xué)編程可自組裝成大小均等(?20 nm)的納米顆粒,且與肽抗原成分無關(guān)。
該方法可在納米顆粒中精確裝載與TLR-7/8a(佐劑)相關(guān)的各種肽新抗原,從而增加了促進T細(xì)胞免疫的抗原呈遞細(xì)胞的攝取和活化。使用來自三種腫瘤模型的預(yù)測新抗原(n = 179)的SNP-7/8a對小鼠進行疫苗接種,誘導(dǎo)CD8 T細(xì)胞對抗約50%具有高預(yù)測MHC-I結(jié)合親和力的新抗原,并提高腫瘤清除率。總而言之,SNP-7/8a是一種通用的方法,用于在納米顆粒中共遞送肽抗原和佐劑,以誘導(dǎo)抗癌T細(xì)胞免疫。
Lynn, G.M., Sedlik, C., Baharom, F. et al. Peptide–TLR-7/8a conjugate vaccines chemically programmed for nanoparticle self-assembly enhance CD8 T-cell immunity to tumor antigens. Nat Biotechnol (2020)
https://doi.org/10.1038/s41587-019-0390-x
而在半個月前,2020年1月1日,Robert A. Seder研究團隊還在Nature正刊發(fā)表了使用卡介苗疫苗進行靜脈注射,以預(yù)防結(jié)核病的相關(guān)報道。
Nature:卡介苗靜脈注射預(yù)防結(jié)核病

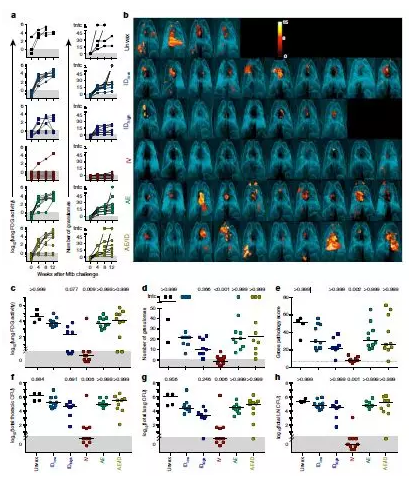
結(jié)核分枝桿菌(Mycobacterium tuberculosis,Mtb)是世界范圍內(nèi)感染致死的主要原因。唯一可用的疫苗卡介苗(Bacillus Calmette Guérin)是皮內(nèi)接種的,對肺結(jié)核(肺結(jié)核是導(dǎo)致死亡和疾病傳播的主要原因)有不同的療效。近日,美國國立衛(wèi)生研究院Robert A. Seder等研究人員,提出靜脈注射卡介苗(BCG)可在獼猴中預(yù)防結(jié)核病。與皮內(nèi)或氣霧劑給藥相比,靜脈免疫在血液、脾臟、支氣管肺泡灌洗液和肺淋巴結(jié)中誘導(dǎo)的CD 4和CD8 T細(xì)胞應(yīng)答明顯增強。
此外,靜脈免疫誘導(dǎo)了高頻率的抗原反應(yīng)性T細(xì)胞穿過所有肺實質(zhì)組織。卡介苗接種6個月后,用強毒Mtb攻擊獼猴。值得注意的是,在接受卡介苗靜脈接種的獼猴中,每10只獼猴中有9只受到了高度保護,其中6只獼猴沒有檢測到感染水平,這是由正電子發(fā)射斷層掃描成像、分枝桿菌生長、病理學(xué)和肉芽腫形成所決定的。靜脈注射卡介苗預(yù)防或?qū)嵸|(zhì)性限制高度敏感獼猴Mtb感染的發(fā)現(xiàn),對疫苗的接種和臨床發(fā)展具有重要意義,為確定疫苗誘導(dǎo)預(yù)防結(jié)核病的免疫相關(guān)性和機制提供了模型。
Patricia A. Darrah, Joseph J. Zeppa, Pauline Maiello, et al. Prevention of tuberculosis in macaques after intravenous BCG immunization. Nature, 2020.
https://www.nature.com/articles/s41586-019-1817-8
實體瘤是CAR-T技術(shù)亟需攻克的難題,2020年1月2日,來自德國BioNTech公司的一項關(guān)于利用RNA疫苗增強CAR-T細(xì)胞治療實體瘤的研究發(fā)表在Science正刊上。
Science:RNA疫苗可增加CAR-T細(xì)胞對實體瘤療效

嵌合抗原受體(CAR) T細(xì)胞已在B細(xì)胞惡性腫瘤患者中顯示出功效。然而,它們在實體瘤中的應(yīng)用面臨挑戰(zhàn),包括有限的癌癥特異性靶標(biāo)和過繼轉(zhuǎn)移CAR-T細(xì)胞的非持久性。近日,德國BioNTech公司U. Sahin等研究人員,發(fā)現(xiàn)一種RNA疫苗能夠促進claudin-CAR-T細(xì)胞擴增并對抗實體瘤。研究人員發(fā)現(xiàn),CLDN6蛋白(developmentally regulated tight junction protein claudin 6)可作為實體瘤中的CAR靶標(biāo),以及克服體內(nèi)無效的CAR-T細(xì)胞刺激的策略。
研究人員證明了一種納米顆粒RNA疫苗(旨在將CAR抗原在全身范圍內(nèi)傳遞到淋巴區(qū)室)能夠刺激過繼轉(zhuǎn)移的CAR-T細(xì)胞。天然折疊靶標(biāo)在駐留樹突狀細(xì)胞上的存在促進了CAR-T細(xì)胞的同源和選擇性擴增。在亞治療性CAR-T細(xì)胞劑量下,可改善CAR-T細(xì)胞的植入率,并在難以治療的小鼠模型中使大型腫瘤消退。
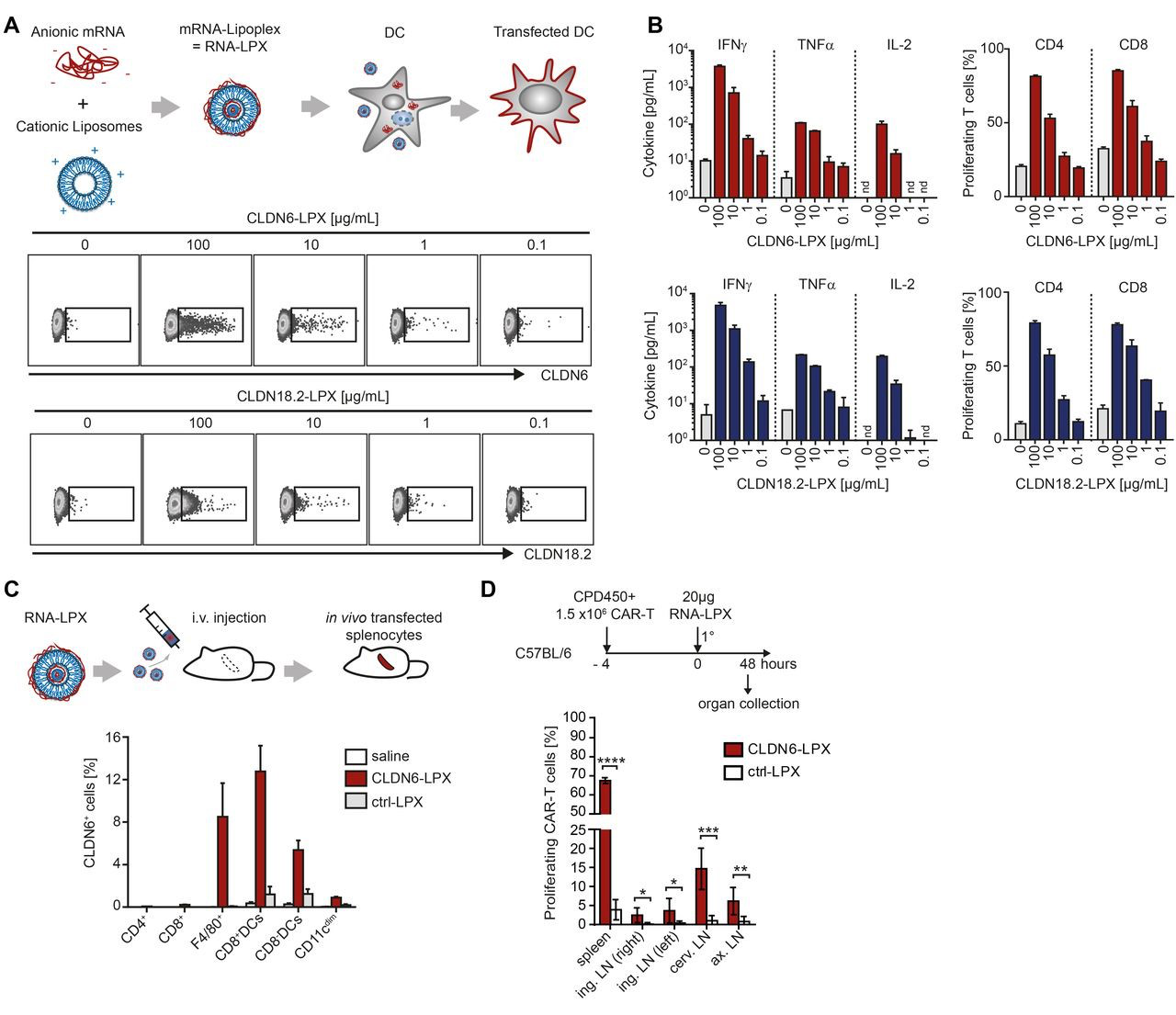
K. Reinhard, B. Rengstl, P. Oehm, K. Michel, et al. An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors. Science, 2020.
DOI: 10.1126/science.aay5967
https://science.sciencemag.org/content/early/2019/12/30/science.aay5967
另外,在2019年12月17日,來自赫爾辛基大學(xué)的研究人員利用癌細(xì)胞膜仿生病毒納米疫苗用于治療癌癥。
Nature. Commun:基于病毒的納米疫苗用于癌癥免疫治療

基于病毒的癌癥疫苗在目前被認(rèn)為是用于癌癥免疫治療的一種有效方法,但是它們所引起的大多數(shù)免疫反應(yīng)其實往往是針對病毒而非腫瘤的。赫爾辛基大學(xué)Hélder A. Santos教授和Vincenzo Cerullo教授等人利用多疫苗接種策略構(gòu)建了帶有腫瘤抗原的、腫瘤細(xì)胞膜包裹的溶瘤病毒作為納米疫苗ExtraCRAd。
實驗結(jié)果表明,ExtraCRAd在體內(nèi)外均能夠表現(xiàn)出增強的感染性和溶瘤作用,并且這個納米疫苗平臺也可以在體內(nèi)控制侵襲性黑色素瘤和肺腫瘤的生長,同時也可以產(chǎn)生高度特異性的抗癌免疫反應(yīng)。因此,ExtraCRAd可以作為下一代個性化的癌癥疫苗以增強改進對癌癥的靶向免疫治療。
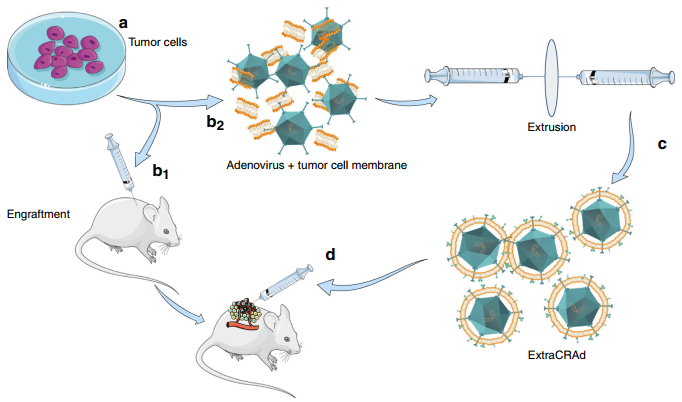
Manlio Fusciello, Hélder A. Santos, Vincenzo Cerullo. et al. Artificially cloaked viral nanovaccine for cancer immunotherapy. Nature Communications. 2019
https://www.nature.com/articles/s41467-019-13744-8
我們知道,流感是一個嚴(yán)重的公共衛(wèi)生問題,注射流感疫苗是預(yù)防和控制流感的主要措施之一,而在2019年12月30日,來自美國新澤西州立大學(xué)的一項研究則利用流感疫苗進行癌癥治療。
PNAS:瘤內(nèi)注射季節(jié)性流感疫苗用于癌癥免疫治療

對腫瘤微環(huán)境進行重組以增強免疫應(yīng)答是目前研究的一大熱點。一般來說,免疫浸潤的“熱”性腫瘤患者往往表現(xiàn)出更高的免疫治療響應(yīng)率。然而,只有少數(shù)腫瘤是熱性的,因此也只有少數(shù)患者能夠受益于免疫治療。而開發(fā)可以使腫瘤變“熱”的創(chuàng)新方法也成為了人們關(guān)注的重點。
新澤西州立大學(xué)Andrew Zloza等人報道了一種通過瘤內(nèi)注射未加佐劑的季節(jié)性流感疫苗的策略來將“冷”性腫瘤轉(zhuǎn)化為熱性,進而產(chǎn)生系統(tǒng)性CD8+ T細(xì)胞介導(dǎo)的抗腫瘤免疫,并使耐藥腫瘤對檢查點阻斷治療更加敏感,并且在瘤內(nèi)接種疫苗后也能夠預(yù)防活動性流感病毒造成的肺部感染。
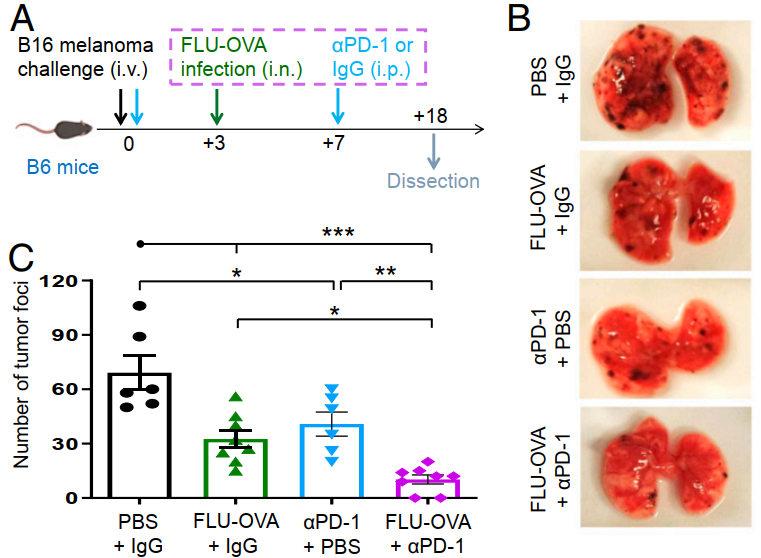
Jenna H. Newman, Andrew Zloza. et al. Intratumoral injection of the seasonal flu shot converts immunologically cold tumors to hot and serves as an immunotherapy for cancer. Proceedings of the National Academy of Sciences of the United States of America. 2019
https://www.pnas.org/content/early/2019/12/26/1904022116
最后,我們相信,經(jīng)過各國科學(xué)家的努力,預(yù)防和治療癌癥的疫苗就如上述的流感疫苗一樣,將會“飛入尋常百姓家”。











