納米藥物在腫瘤處累積量是目前臨床轉(zhuǎn)化的關(guān)鍵問題之一,目前科學家開發(fā)納米粒子在體內(nèi)自組裝轉(zhuǎn)化,以滯留于腫瘤,這可能有助于增加納米藥物在腫瘤區(qū)域的量。NanoLabs先前也對相關(guān)的研究進行了報道:
2019年10月21日,約翰霍普金斯醫(yī)學院Jeff W. M. Bulte等人在Nature Materials上發(fā)表關(guān)于一種基于弗林蛋白酶介導的腫瘤藥物胞內(nèi)自組裝策略。(點擊閱讀詳細解讀)

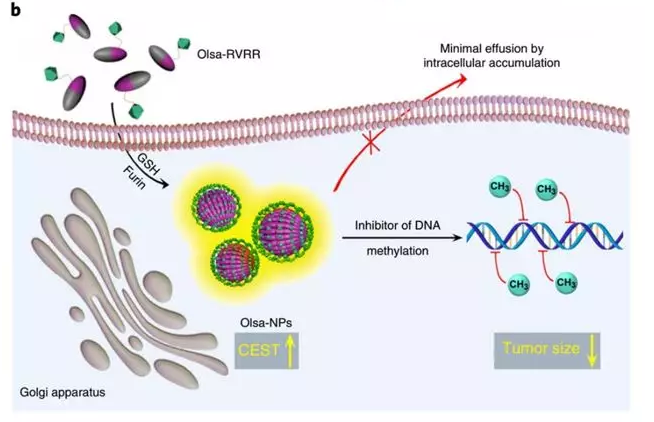
2019年10月24日,國家納米科學中心趙宇亮院士、王浩研究員以及哈爾濱醫(yī)科大學徐萬海教授等人在Nature Communication上發(fā)表關(guān)于構(gòu)建了一種新型腫瘤選擇性級聯(lián)激活自滯留系統(tǒng)(TCASS)作為腫瘤納米醫(yī)藥的研究。(點擊閱讀詳細解讀)
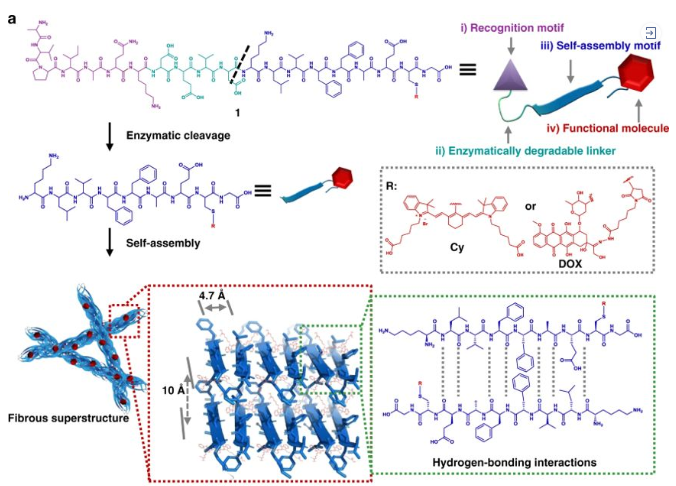
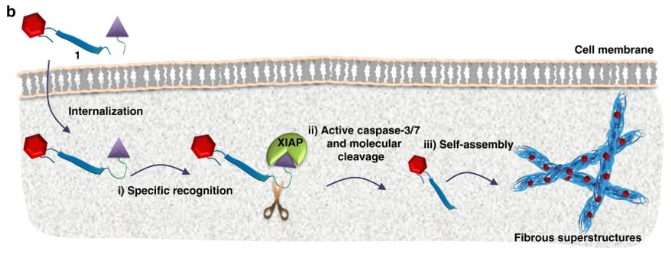
2020年1月27日,國家納米中心王磊研究員等人在Nature Nanotechnology上發(fā)表了關(guān)于受體介導的變形納米粒子的研究工作。

第一作者:Lu Zhang、Di Jing,
通訊作者:王磊、Kit S.Lam
通訊單位:國家納米科學中心、加州大學戴維斯分校
HER2與腫瘤
人表皮生長因子受體2(HER2)在20%以上的乳腺癌中過度表達,在胃癌、結(jié)直腸癌、卵巢癌和膀胱癌中則較少表達。與那些由突變或融合癌基因(如肺癌中的表皮生長因子受體(EGFR))引起的對單一療法反應良好的癌癥不同,HER2過表達的癌癥通常需要藥物聯(lián)合治療。這是因為這組腫瘤是由基因擴增和HER2的大量過度表達驅(qū)動的。
HER2是一種受體酪氨酸激酶(RTKs),通常通過與自身或其家族成員EGFR、HER3或HER4的誘導二聚作用而被激活。在HER2+腫瘤中,HER2大量過度表達并構(gòu)成二聚體,導致下游增殖和生存途徑的持續(xù)激活和惡性表型。
超分子化學
超分子化學是指分子亞基通過非共價相互作用自組裝而形成的化學體系。利用超分子化學的動態(tài)性和適應性的優(yōu)勢,已有報道提出了一種“體內(nèi)自組裝”策略,用于在體內(nèi)原位構(gòu)建納米材料。
成果簡介
有鑒于此,國家納米中心王磊研究員和加州大學戴維斯分校Kit S. Lam等人設(shè)計并合成了一種智能超分子肽BP-FFVLK-YCDGFYACYMDV,在體內(nèi)受體HER2介導下進行結(jié)構(gòu)轉(zhuǎn)化,以作為一種單一療法即可進行HER2+腫瘤治療(常需要聯(lián)合療法)。這些基于結(jié)構(gòu)轉(zhuǎn)換的超分子肽代表了一類受體介導的靶向抗癌納米療法。

圖1. 示意圖
要點1:總體設(shè)計:
該智能肽首先在水和血液循環(huán)中組裝成納米顆粒(NPs),然后在腫瘤部位與細胞表面HER2結(jié)合時原位轉(zhuǎn)化成納米纖維(NF)結(jié)構(gòu),從而抑制了HER2的二聚化并阻止了下游細胞信號傳導以及細胞核中增殖和存活基因的表達。
可轉(zhuǎn)化肽單體(TPM)的組成:
(1)具有聚集誘導發(fā)射(AIE)特性的雙芘(BP)部分用于熒光報告,并作為疏水核誘導膠束NP的形成;
(2)FFVLK,衍生自β-淀粉樣蛋白(Aβ)肽的KLVFFβ-折疊形成肽結(jié)構(gòu)域的反向序列;
(3)YCDGFYACYMDV二硫環(huán)肽HER2結(jié)合結(jié)構(gòu)域。
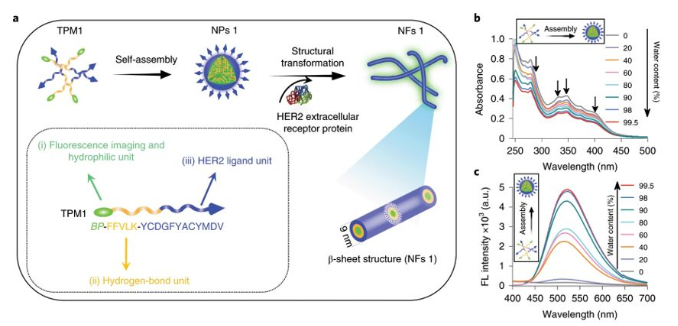
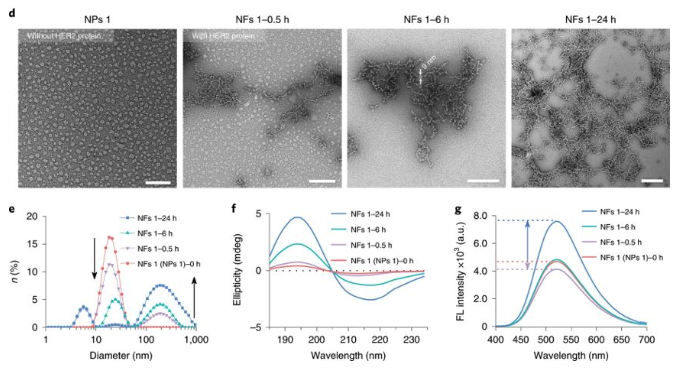
圖2. 組裝及纖維轉(zhuǎn)化
要點2:特異性表面轉(zhuǎn)化
研究人員將HER2+乳腺癌細胞系(SKBR-3和BT474細胞)與NPs1孵育后,在細胞表面而非細胞內(nèi)觀察到了強烈的綠色熒光信號。相比之下,對于HER2表達水平較低的MCF-7乳腺癌細胞,則在細胞內(nèi)發(fā)現(xiàn)了大部分熒光信號,這表明對于NPs1到細胞附近進行納米纖維網(wǎng)絡(luò)的轉(zhuǎn)化,需要HER2蛋白的表達。
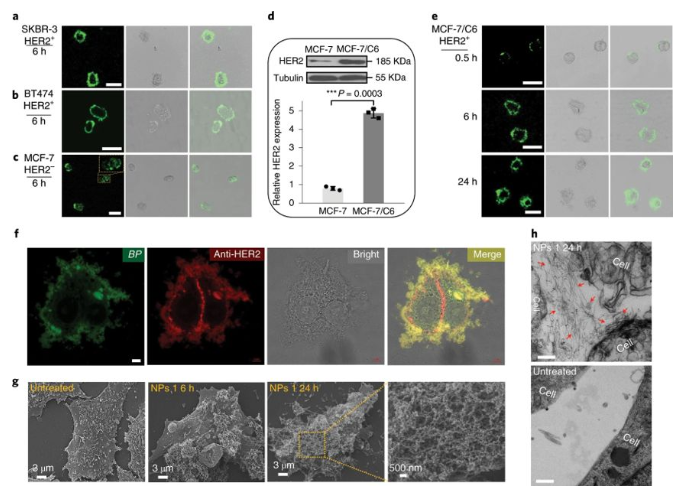
圖3. NPs1細胞表面形態(tài)學表征
要點3. 明顯的腫瘤滯留與治療效果
研究人員再進行動物實驗,發(fā)現(xiàn)熒光信號在腫瘤組織中持續(xù)> 3 d,甚至在7 d后仍存在明顯的殘留信號。相反,正常器官中的熒光信號在10 h后開始下降,而在72 h時在主要器官中幾乎無法檢測到。并且在體內(nèi)進行的抗腫瘤實驗中,NPs1組具有非常明顯的抗腫瘤效果。
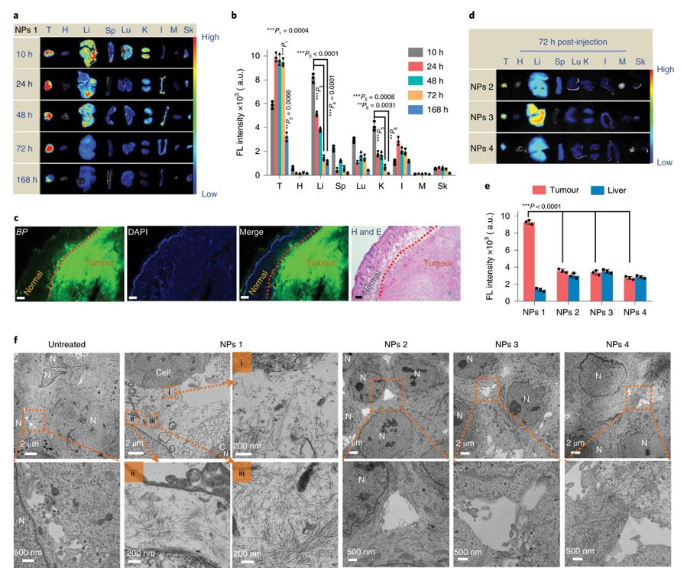
圖4. 明顯的腫瘤滯留
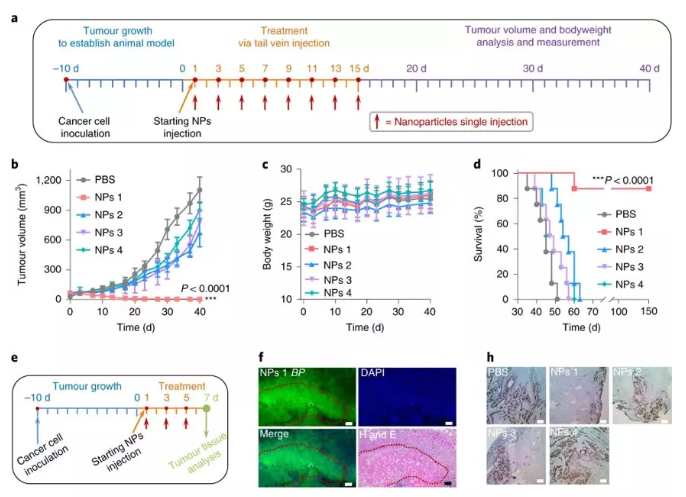
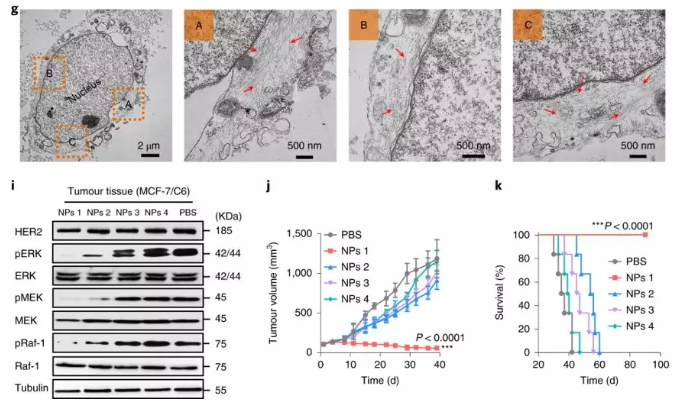
圖5. 體內(nèi)抗腫瘤效果
小結(jié)
綜上所述,實驗證明了NPs1本身作為一種單一療法是無毒的,并且可以有效治愈大量攜帶HER2+乳腺癌異種移植的小鼠。經(jīng)過實驗比較,證實了在這種原位可轉(zhuǎn)化納米技術(shù)中配體-受體相互作用的重要性。因此,細胞表面受體介導的可轉(zhuǎn)化肽納米平臺具有巨大的臨床潛力。
參考文獻:
Zhang, L., Jing, D.,Jiang, N. et al. Transformable peptide nanoparticles arrest HER2 signalling and cause cancer cell death in vivo. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-019-0626-4











