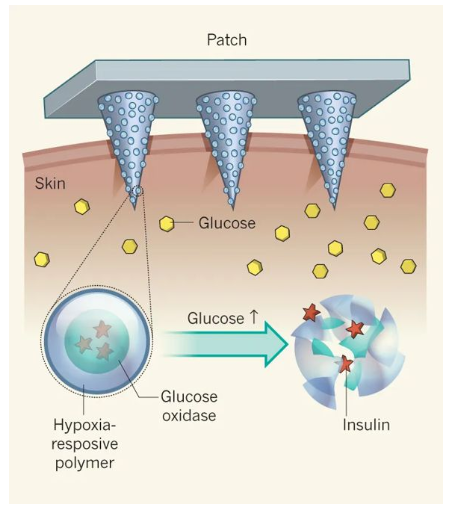
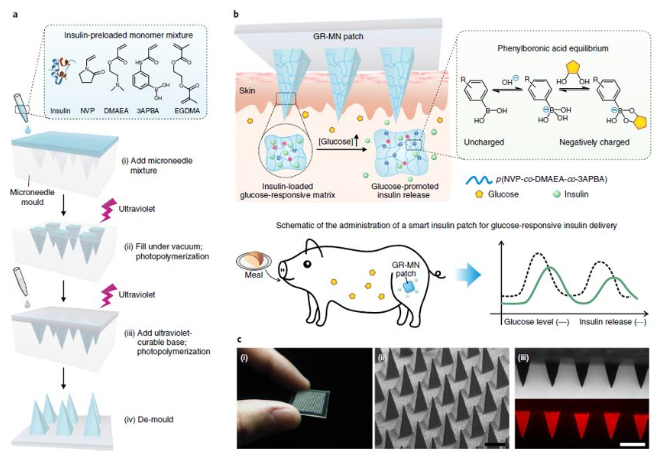
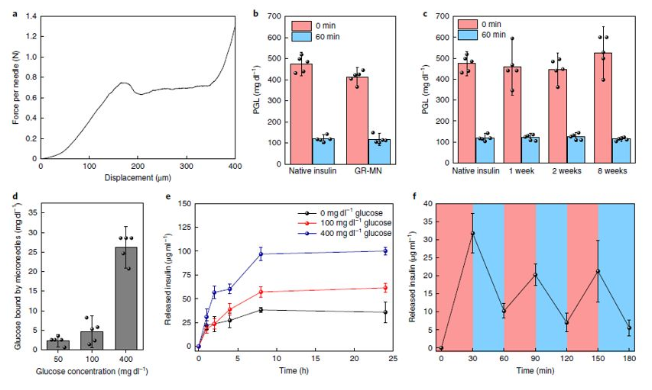
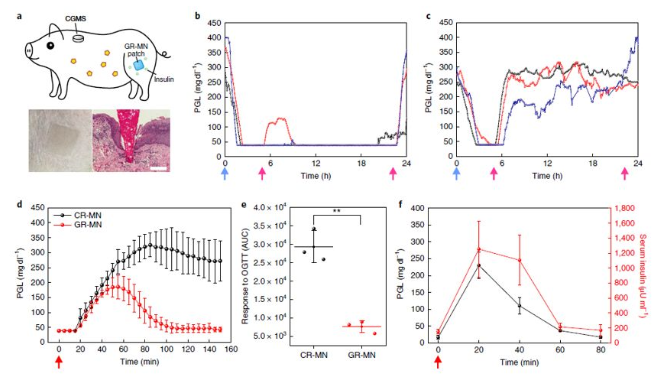
糖尿病——一種經常導致嚴重繼發并發癥的慢性疾病,影響全球超過4.25億人。胰島素治療在1型糖尿病患者的生活中是必需的,并且通常用于胰島β細胞功能減退的2型糖尿病患者。日常注射通常遇到很多痛苦,包括頻繁監測血糖水平和每天多次皮下注射或輸液。這種方法更是繁重且復雜,并且常常由于控制不當和由于錯誤計算的劑量而導致危及生命的低血糖。為了解決這全球性問題,早在2015年,顧臻教授研究團隊開創性地開發出第一代智能控制血糖的微針貼片,并在此之后不斷開拓關于智能胰島素釋放的研究。以期望可以實現根據患者體內的血糖變化進行自動調節血糖水平,從而降低低血糖的風險。然而,一些挑戰性的問題仍然存在,葡萄糖響應釋放胰島素制劑或裝置需要結合以下幾個特點:(1)體內快速的葡萄糖反應行為,與胰腺β細胞的藥代動力學相似;有鑒于此,UCLA顧臻教授團隊于近日開發出新一代的經皮智能胰島素貼片——“智能胰島素貼片2.0”。該胰島素貼片只有硬幣大小(5 cm2),易于工業生產制造,可實現臨床相關劑量的和快速葡萄糖依賴性的胰島素釋放,調節葡萄糖釋放時間可超過20h。在這種葡萄糖反應微針(GR-MN)貼片中,整個微針聚合物基質是以苯硼酸(PBA)作為葡萄糖響應成分。重要的是,研究人員將胰島素、單體和交聯劑(EGDMA)的混合物通過非常方便的原位光聚合方法形成聚合基質,以獲得足夠的胰島素載量供臨床使用。PBA能與葡萄糖可逆地相互作用生成環硼酸酯。即:當暴露在高血糖條件下時,聚合物基質中的負電荷增加,并導致微針溶脹,然后將胰島素快速擴散到皮膚組織中。而在正常血糖條件下,基質不再溶脹和靜電相互作用的恢復,可減緩胰島素釋放速率,降低了低血糖的風險。與以前的胰島素微針制劑不同,GR-MN貼片可高劑量負載胰島素,使該系統能夠達到臨床目標劑量,且貼片中裝載的胰島素的生物活性可以在室溫下保持8周以上。由于GR-MN貼劑的交聯聚合物基質不可降解,因此可以在治療后將其從皮膚上完全去除。與可溶解的微針不同,后者可能引起與異物對沉積的針尖材料的反應有關的安全問題,精心設計的GR-MN貼片顯示出與皮膚組織的良好生物相容性。小鼠和小型豬體內實驗(僅有少量報道使用大型動物進行相關實驗)表明,GR-MN貼片可在目標范圍內調節葡萄糖水平,另外,還可以使用不同大小的貼片來調節胰島素劑量,以改變每個人對葡萄糖激發的反應能力,以實現臨床個性化治療。葡萄糖響應制劑與基于微針的經皮胰島素技術的結合,為改善葡萄糖水平的調節提供了廣闊的前景。另外,在這項研究中開發的GR-MN貼片還為其他藥物(如胰島素類似物,類胰高血糖素肽1受體激動劑和胰高血糖素)的刺激響應性經皮遞送系統的開發提供了技術。據了解,該技術已被FDA的新興技術計劃接受,且研究人員正在為人類臨床試驗申請FDA批準,預計可以在幾年內開始實施。Yu,J., Wang, J., Zhang, Y. et al. Glucose-responsive insulin patch for theregulation of blood glucose in mice and minipigs. Nat Biomed Eng (2020).https://doi.org/10.1038/s41551-019-0508-y