納米人編輯部對2019年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是中國科學院長春應用化學研究所研究員,中國科學院院士陳學思研究員課題組。
陳學思研究員從要從事高分子化學與物理領域的研究,尤其是在手性聚合化學領域形成了獨具特色的研究思想,提出了“分子內多核協同”催化與“生物可降解導電高分子”等概念。具體研究領域包括高分子基因載體、藥物緩釋、電活性生物可降解高分子的設計與合成、智能高分子水凝膠的制備,及其在藥物控制釋放與組織工程中的應用。

以下對陳學思院士課題組2019年部分研究工作進行介紹,供大家學習交流。內容按照以下四個部分進行介紹:(以通訊作者和0nline時間為主,如有疏漏,歡迎指正)
1. 藥物緩釋
2. 骨組織工程
3. 聚乳酸材料產業化
4. 生物降解醫用高分子材料
一、藥物緩釋
1. Nano. Today:如何增強納米藥物的腫瘤滲透
由于具有多種優勢,納米藥物在臨床上被廣泛用于增強化療的療效,但往往效果一般。其中的主要原因是由于腫瘤微環境的特異性,如血供不足、腫瘤細胞和細胞外基質密度高和間質液壓力增高等。近年來,許多研究報道了一些可以提高納米藥物在腫瘤內穿透效果的策略,包括調節腫瘤微環境和優化納米顆粒的性能等等,但這些策略也都有著各自的局限性。
近年來,隨著腫瘤穿透肽介導的細胞外轉運等策略的出現,多功能可轉變的納米顆粒已成為具有優越的腫瘤穿透能力的新一代納米藥物。中科院長春應化所陳學思研究員與新加坡生物工程與納米科技研究院Su SeongLee研究員合作對納米藥物的最新發展趨勢和具有的局限性進行了綜述,并對提高其在腫瘤內穿透性的策略進行了詳細的討論和展望。
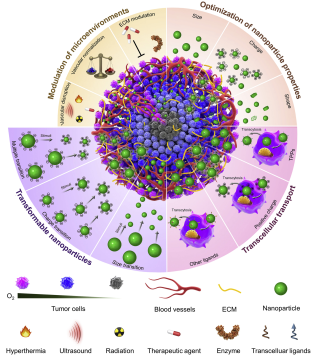
JianxunDing, Jinjin Chen, Liqian Gao, Su Seong Lee, Xuesi Chen. et al. Engineered nanomedicines with enhanced tumor penetration. Nano Today. 2019
https://www.sciencedirect.com/science/article/pii/S1748013219303470
推薦圖解綜述:https://mp.weixin.qq.com/s/RqLGPVfBMdBAQhKZYAnQdw
2. Materials Today Nano:利用生物材料進行癌癥免疫治療:靶向模式識別受體
固有免疫是機體應對外來病原生物入侵的最初防衛手段,表達在固有免疫細胞表面或胞內的模式識別受體(pattern recognition receptors, PRRs)是介導固有免疫應答的重要分子。利用多種天然或合成的小分子、核酸或蛋白類免疫激動劑靶向PRRs能夠有效激活固有免疫應答,并進一步促進抗腫瘤免疫響應。但是,PRR激動劑的使用必須謹慎控制,否則會出現致命的毒副作用。
基于生物材料的納米制劑、凝膠及可植入支架等能夠通過緩控釋方式顯著降低PRR激動劑的毒副作用,同時增強PRR激動劑的免疫激活效果,為腫瘤免疫治療提供了新的發展方向。有鑒于此,中科院長春應化所陳學思研究員團隊介紹了靶向PRRs來激活抗腫瘤免疫的基本概念,并總結了基于生物材料的不同形式的PRRs激動劑在腫瘤免疫治療中的最新進展。
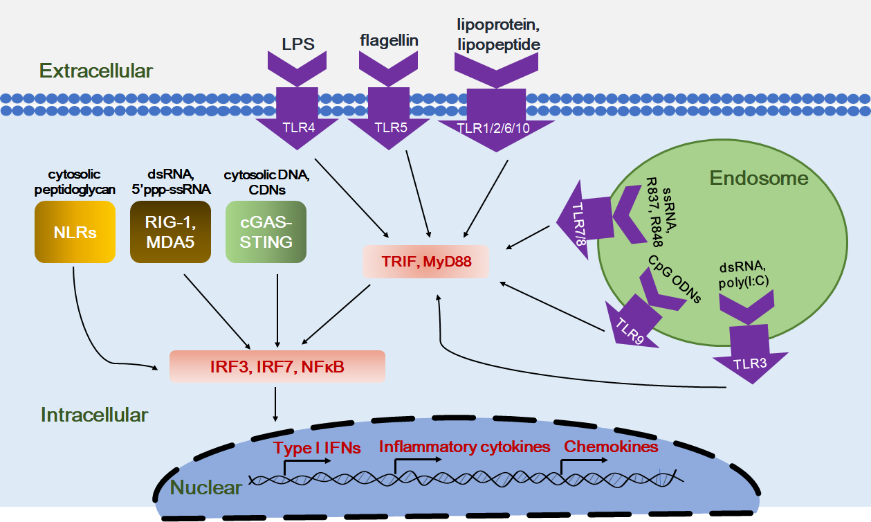
SongW, Das M, Xu Y, Si X, Zhang Y, Tang Z, Chen X. Leveraging Biomaterials for Cancer Immunotherapy: Targeting Pattern Recognition Receptors. Materials Today Nano, 2019.
https://doi.org/10.1016/j.mtnano.2019.100029
推薦閱讀:http://www.pswbw.com/e/action/ShowInfo.php?classid=32&id=8332
3. Adv. Mater.: CA4納米藥物選擇性增強低氧水平以治療實體瘤
缺氧激活的前藥(HAPs)能選擇性殺死缺氧細胞,并將從腫瘤缺氧問題轉變為選擇性治療的優勢。然而,由于II期臨床試驗的進一步研究表明,由于治療的腫瘤內的缺氧不足,HAPs在大多數臨床試驗中均不成功。于此,中科院長春應化所陳學思研究員和湯朝暉研究員等人提出了一種將HAPs與血管阻斷劑(VDA)納米藥物聯合應用于實體瘤治療的新策略。
制備了一種有效的聚(L-谷氨酸)-甲氧基聚乙二醇/康布汀他汀A4(CA4-NPs)的VDA納米藥物,它可以選擇性增強腫瘤缺氧并增強的典型HAP替拉帕明(TPZ)治療轉移性4T1乳腺腫瘤。結合TPZ和CA4-NPs治療后,在4T1異種移植小鼠中觀察到腫瘤完全縮小(初始腫瘤體積為180 mm3),而且在初始體積為500 mm3的具有挑戰性的大腫瘤中觀察到明顯的腫瘤縮小和抗轉移作用。該研究強調了將HAPs和VDA納米藥物結合應用于實體腫瘤治療的潛力。
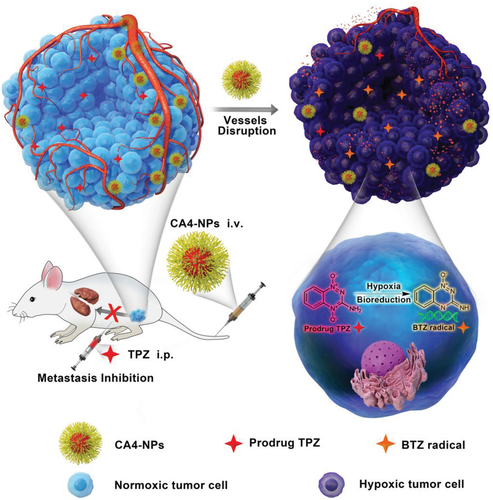
Yang, S., Tang, Z., Hu, C., Zhang, D., Shen, N., Yu, H., Chen, X., Adv. Mater. 2019, 31, 1805955.
https://doi.org/10.1002/adma.201805955
4. Adv. Mater.:被腫瘤微環境激活的、納米酶介導的納米反應器用于腫瘤診療
可被腫瘤微環境激活的納米診療試劑往往具有很高的特異性和敏感度。中科院長春應化所陳學思研究員、田華雨研究員等人開發了一種可被激活的、納米酶介導的、負載有ABTS的納米反應器ABTS@MIL-100/聚乙烯吡咯烷酮(AMP NRs),并將其用于成像指導的腫瘤聯合治療。
該AMP NRs可以通過納米酶介導的兩步過程被腫瘤微環境特異性地激活,從而產生光聲成像和光熱治療(PTT)的功能。此外, AMP NRs也可以對腫瘤微環境內高水平的H2O2做出響應并產生羥基自由基,并且可以破壞細胞內的谷胱甘肽(GSH)來進一步增強AMP NRs的化學動力學治療效果。由于AMP NRs會被腫瘤微環境特異性地激活,因此它對正常組織具有很好的安全性。這一研究也為開發有納米酶參與的納米反應器以實現智能高效的癌癥診療應用開辟了一條新的途徑。
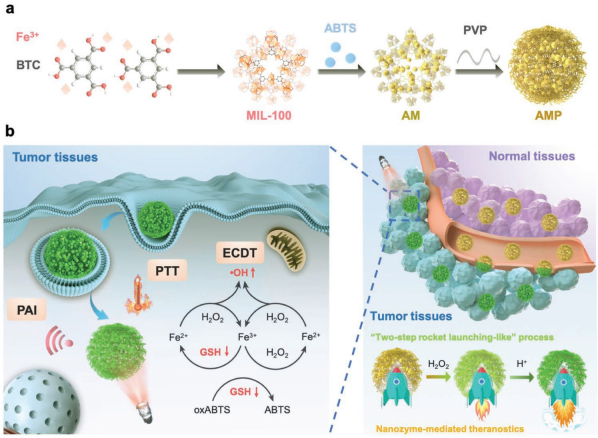
Feng Liu, Huayu Tian, Xuesi Chen. et al. A Tumor-Microenvironment-Activated Nanozyme-Mediated Theranostic Nanoreactor for Imaging-Guided Combined Tumor Therapy. Advanced Materials. 2019
https://onlinelibrary.wiley.com/doi/10.1002/adma.201902885
5. Adv. Mater.:納米藥物誘導的MMP9擴增以促進阿霉素前藥在腫瘤的選擇性釋放
開發可被腫瘤相關酶激活的前藥能夠有效提高化療藥物的選擇性。中科院長春應化所陳學思研究員、湯朝暉研究員,加州大學洛杉磯分校顧臻教授等人提出了一種利用康普瑞汀納米藥物(CA4-NPs)和可被基質金屬蛋白酶9 (MMP9)激活的阿霉素前藥(MMP9-DOX-NPs)的協同策略。
CA4是一種典型的血管阻斷劑,可選擇性地破壞未成熟的腫瘤血管,從而加重腫瘤乏氧狀態。在CA4-NPs治療后,腫瘤中MMP9的表達可提高5.6倍,因此可進一步提高原位4T1乳腺腺癌小鼠模型中MMP9-DOX-NPs的腫瘤選擇性藥物釋放(3.7倍),進而可以顯著增強抗腫瘤效果,并降低對全身的毒副作用。
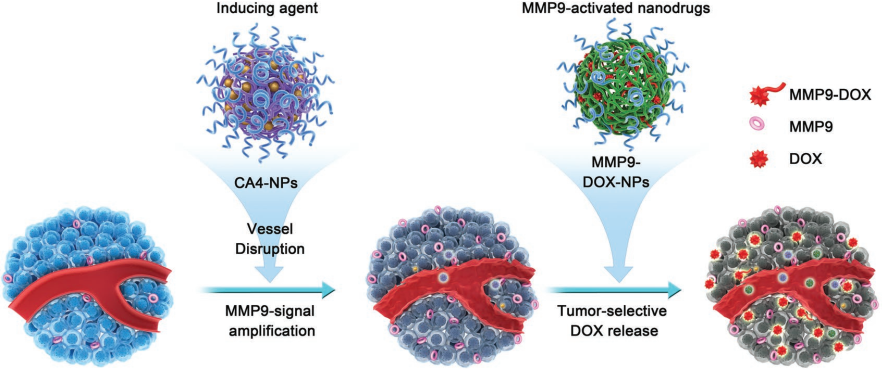
Jian Jiang, Zhaohui Tang, Zhen Gu, Xuesi Chen. et al. Combretastatin A4 Nanodrug-Induced MMP9 Amplification Boosts Tumor-Selective Release of Doxorubicin Prodrug. Advanced Materials. 2019
DOI: 10.1002/adma.201904278
https://onlinelibrary.wiley.com/doi/10.1002/adma.201904278
6. Nano Lett.:康普瑞汀A4納米粒子聯合乏氧敏感的咪喹莫特應用癌癥治療
血管阻斷劑(VDAs)在癌癥治療中具有巨大的應用潛力。然而,VDAs除了具有使腫瘤血管塌陷的作用外還會激活宿主的免疫反應,從而顯著削弱其抗癌作用。中科院長春應化所陳學思研究員、湯朝暉研究員和吉林大學第一醫院陳京濤教授等人開發了一種VDA納米藥物CA4-NPs,它可誘導未成熟的漿細胞樣樹突狀細胞(pDCs)在瘤內的浸潤,從而抑制抗癌免疫。
為了解決這一問題,實驗將CA4-NPs與乏氧敏感的咪喹莫特(hs-IMQ)相聯合,它可在CA4-NPs誘導的硝基還原酶(NTR)的催化作用下被選擇性地激活為咪喹莫特(IMQ)。結果表明,hs-IMQ和CA4-NPs聯合后可使腫瘤中的活性IMQ濃度提高6.3倍,并改變腫瘤微環境使其從免疫抑制狀態變為免疫激活狀態。通過CA4-NPs和hs-IMQ聯合治療可協同抑制4T1荷瘤小鼠的腫瘤生長和轉移。這一工作也為利用瘤內pDCs來逆轉VDA治療引起的免疫抑制提供了新的方法,并為將VDAs與TLR激動劑聯合使用以觸發原位的免疫激活和增強抗癌效果提供了機制基礎。
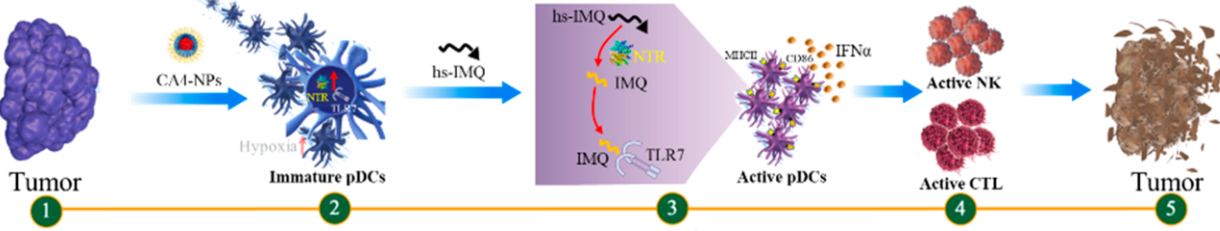
Na Shen, Jingtao Chen, Zhaohui Tang, Xuesi Chen. et al. Combretastatin A4 Nanoparticles Combined with Hypoxia-Sensitive Imiquimod: A New Paradigm for the Modulation of Host Immunological Responses during Cancer Treatment. Nano Letters. 2019
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03214
7. Biomaterials:多肽-地塞米松復合物對腫瘤促炎作用的微環境調節與結直腸癌治療
腫瘤被稱為“無法愈合的傷口”。腫瘤促進炎癥在腫瘤的發生、發展、轉移以及化療抵抗中起著重要作用。因此,減少腫瘤促進性炎癥可能是腫瘤微環境靶向治療的一個關鍵方面。地塞米松(DEX)是一種治療多種炎癥疾病的商業藥物,能有效抑制炎癥物質的釋放。然而,作為一種皮質類固醇藥物,直接使用DEX會導致許多嚴重的副作用。有鑒于此,中科院長春應化所陳學思研究員課題組合成了一種氧化還原和pH雙敏感的多肽DEX結合物(L-SS-DEX),與游離DEX相比,L-SS-DEX顯著增加了小鼠結直腸癌模型(CT26)中DEX的腫瘤堆積。
重要的是,在相同劑量(10mg/kg)下,L–SS–DEX比游離DEX顯示出更高的抗腫瘤活性:L-SS-DEX治療組的腫瘤抑制率為86%,而游離DEX治療組為49%。對腫瘤組織的進一步分析顯示,與對照組相比,L-SS-DEX治療后環氧合酶-2(COX-2)和α-平滑肌肌動蛋白(α-SMA)顯著降低。此外,L-SS-DEX治療后CT26腫瘤的免疫抑制微環境得到有效緩解,其特點是CD8+ T細胞浸潤增加,M1/M2巨噬細胞比例增加,調節性T細胞(Tregs)和髓源性抑制細胞(MDSCs)明顯減少。以上結果表明,抗炎藥在適當的給藥條件下,對腫瘤微環境有很大的調節作用,并能產生顯著的抑瘤作用。由于臨床上大量使用抗炎藥,該研究結果可能為腫瘤治療提供更好的選擇。
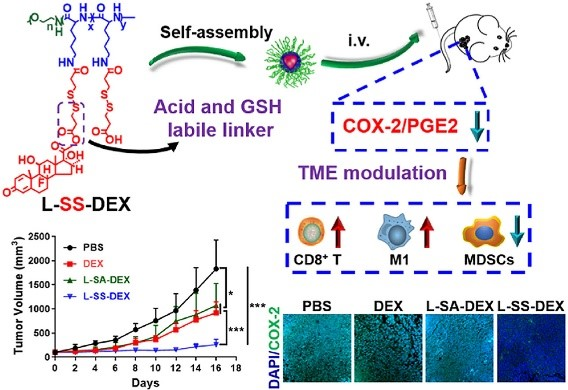
Sheng Ma, Wantong Song, Yudi Xu, et al. Neutralizingtumor-promoting inflammation with polypeptide-dexamethasone conjugate formicroenvironment modulation and colorectal cancer therapy. Biomaterials, 2019.
https://www.sciencedirect.com/science/article/pii/S0142961219307756
推薦閱讀:https://mp.weixin.qq.com/s/g9v1u0LkywJERLfFwPbPfA
二、組織工程
8. Prog. Polym. Sci.:電紡高分子生物材料
靜電紡絲技術為制備具有微/納米纖維的基體提供了一種多用途的技術。靜電紡絲制備的非織造聚合物材料具有極高的表面體積比、復雜的多孔結構、良好的孔連通性和多種纖維形態。這些顯著特征賦予電紡基質廣泛的理想性能,以滿足先進生物醫學應用的要求,如藥物庫、組織工程支架、傷口愈合、傳感器、增強、吸聲和過濾。中科院長春應化所陳學思研究員、丁建勛、化學所肖海華以及福州大學張進等人綜述了近年來電紡聚合物基質及其作為生物材料的研究進展和潛在發展。
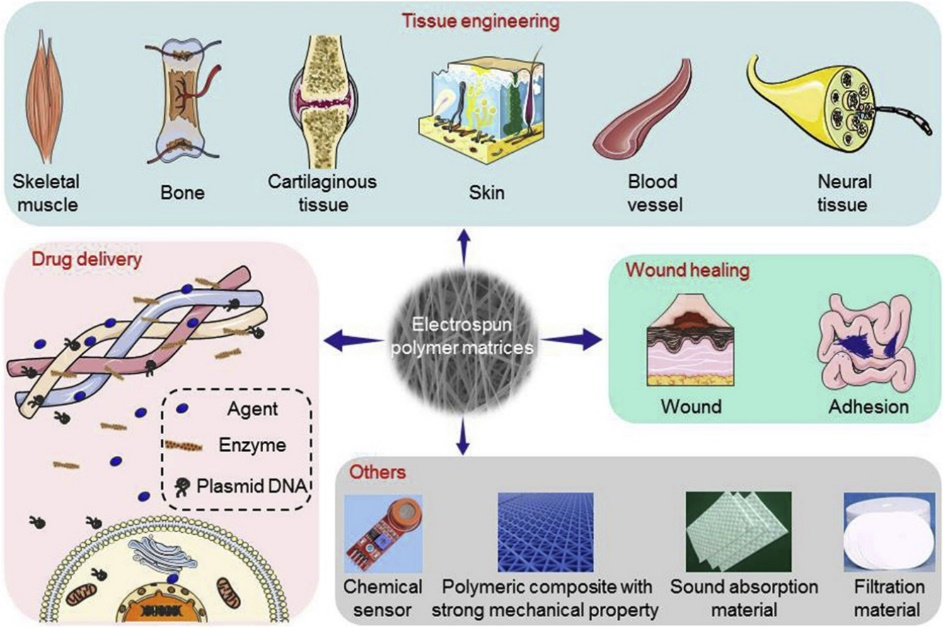
Ding J, Zhang J, Li J, Li D, Xiao C, Xiao H, et al. Electrospun polymer biomaterials. Progress in Polymer Science. 2019;90:1-34.
https://doi.org/10.1016/j.progpolymsci.2019.01.002
9. Biomaterials: 局部表達骨誘導因子的電活性復合支架協同電刺激骨修復
組織工程是修復大規模骨缺損的一種有前景的策略,其中支架和生長因子是影響骨再生功效的兩個關鍵問題。遺憾的是,生長因子在支架中穩定性差,限制了其廣泛應用。中科院長春應化所陳學思研究員和丁建勛副研究員等人通過在非病毒人工重組質粒載體(pSTAR)中加入hBMP-4基因片段,形成pSTAR-hBMP-4質粒(phBMP-4),實現了人骨形態發生蛋白-4(hBMP-4)在強力霉素(Dox)存在下的嚴格控制表達。
此外,通過將聚(L-乳酸)-苯胺五聚體-聚(L-乳酸)(PLA-AP)與聚(乳酸-乙醇酸)/羥基磷灰石(PLGA/HA)的三嵌段共聚物結合生成的電活性組織工程支架,可獲得phBMP-4的控釋。這種PLGA/HA/PLA-AP/phBMP-4復合支架在電刺激下具有基因釋放和Dox調控基因表達的協同作用,在兔橈骨缺損模型中具有提高細胞增殖能力、增強體外成骨分化和體內有效骨愈合的作用。綜合以上研究結果,提出的PLGA/HA/PLA-AP/phBMP-4智能支架為多功能材料在骨組織工程中的應用奠定了堅實的理論和實驗基礎。
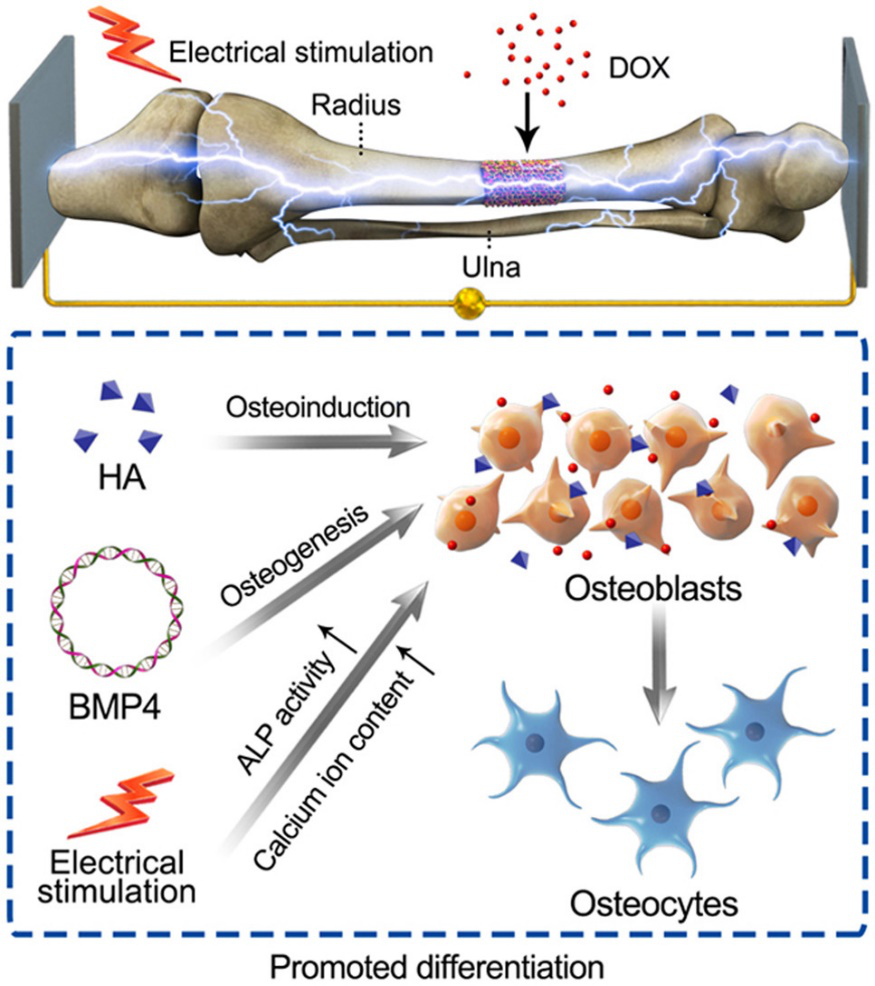
Cui, L., et al. (2019). "Electroactive composite scaffold with locally expressed osteoinductive factor for synergistic bone repair upon electrical stimulation." Biomaterials: 119617.
https://doi.org/10.1016/j.biomaterials.2019.119617
三、聚乳酸材料產業化
10. Macromolecules:丙交酯、環氧化物和酸酐催化三元聚合一步合成二嵌段聚酯
嵌段聚合物為設計具有增強功能和性能的材料提供了無與倫比的機會。因此,中科院長春應化所陳學思研究員、龐烜研究員等人報道了一種二嵌段聚酯的合成策略,即通過使用二元催化劑橋接丙交酯開環聚合(LA)和環氧化物與酸酐的開環共聚這兩個不同的反應。具體地說,在LA、環氧氯丙烷(ECH)和苯酐(PA)的三元共聚反應中,光譜分析表明,這一過程首先是由ECH/PA共聚,然后再與LA均聚,形成二嵌段聚酯。
密度泛函理論(DFT)計算表明,在PA存在下,ECH/PA的偶聯反應比LA的均聚反應更為有利,同時由于競爭勢壘和熱力學優先性,也可能將LA摻入ECH-PA序列中。計算還發現,如實驗觀察到的,LA均聚發生在消耗PA后,以獲得二嵌段聚酯。此外,通過引入不同的單體,二嵌段聚酯結構可以得到擴展和改性。
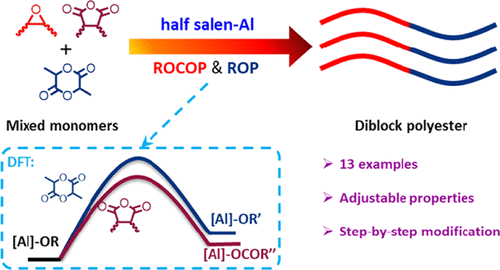
Yanchuan Zhou, Chenyang Hu, Tianhui Zhang, Xiaowei Xu, et al. One-Pot Synthesis of Diblock Polyesters by Catalytic Terpolymerization of Lactide, Epoxides, and Anhydrides. Macromolecules 2019 52 (9), 3462-3470
https://doi.org/10.1021/acs.macromol.9b00001
四、生物降解醫用高分子材料
11. Polym. Degrad. Stabil.:簡單降解法促進多孔聚乳酸微球的細胞生長
聚乳酸(PLA)微球被廣泛用于組織工程領域。然而,由于在微球表面缺乏親水性和細胞識別位,因此在PLA微球上的細胞粘附和增殖受到限制。用于修飾PLA微球的當前方法既復雜又昂貴。氨解和水解是兩種簡單且經濟的降解方法。但是,到目前為止,很少有研究使用氨解或水解直接修飾PLA微球并改變微球上的細胞生長行為。于此,中科院長春應化所陳學思研究員和北京化工大學甘志華教授等人通過氨解和水解被用來修飾多孔PLA微球的表面。
表面改性后,PLA微球顯示出微孔結構。細胞培養實驗表明,改性成功地使多孔聚乳酸微球表面更利于細胞結合和生長。微球表面孔隙率,極性基團,親水性和粗糙度的增加有利于細胞的附著和增殖。研究表明,氨解和水解是一種簡單有效的方法,可用于多孔聚乳酸微球的改性,促進其細胞生長。

Shi X, Cui L, Sun H, Jiang N, Heng L, Zhuang X, et al. Promoting cell growth on porous PLA microspheres through simple degradation methods. Polymer Degradation and Stability. 2019;161:319-25.
https://doi.org/10.1016/j.polymdegradstab.2019.01.003
此外,陳學思研究員課題組2019年還有其他相關的研究成果,由于內容較多,在此不一一列出,感興趣的讀者可以前往課題組官網或者相關數據庫進行學習:
http://ecomaterials.ciac.cas.cn/kydw/yjy/201104/t20110402_3107137.html
陳學思院士簡介

陳學思,研究員,2004年以來分別獲國家杰出青年科學基金、國務院政府特殊津貼、吉林省高級專家、長春市特等勞動模范,2013年入選科技部科技創新創業人才和萬人計劃。2016年入選國際生物材料與工程聯合會會士。任學術期刊Advanced Healthcare Materials, Advanced Therapeutics, Journal of Controlled Release等編委或顧問編委。 發表SCI學術論文700余篇,SCI他引2萬余次,授權專利260余項。











