奇物論聯合納米人編輯部對2019年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是加州大學圣地亞哥分校張良方教授課題組。

張良方教授課題組主要致力于研究仿生納米藥物的研究,尤其是在創建和評價納米結構生物材料的藥物輸送、解毒和疫苗接種治療感染性疾病和癌癥。
課題組主要研究內容為:
1、仿生納米給藥
2、納米海綿
3、納米疫苗

下面,我們簡要總結了張良方教授課題組2019年部分研究成果,供大家交流學習。
1)由于相關論文數量較多,本文僅限于通訊作者文章(不包括序言、短篇評述等),以online時間為準。
2)由于學術有限,所選文章及其表述如有不當,敬請批評指正。
3)由于篇幅限制,部分成果未列入編號,僅以發表截圖展示。
以下分為四個方面展開:
Part Ⅰ 微納米馬達
Part Ⅱ 納米海綿與抗菌
Part Ⅲ 綜述
Part Ⅳ 其他
Part Ⅰ 微納米馬達
1. AM: 巨噬細胞-鎂混合生物馬達
基于鎂(Mg)的微型馬達與活巨噬細胞(MΦ)結合,形成了獨特的MΦ–Mg生物混合馬達系統。所得的生物馬達具有源自Mg微型馬達的快速推進能力以及由活MΦ細胞提供的生物學功能。有鑒于此,加州大學圣地亞哥分校Joseph Wang和張良方等人制備了一種生物混合微型馬達。為了制備生物混合馬達,將涂有二氧化鈦和聚(L-賴氨酸)(PLL)層的Mg微粒與活MΦ細胞在低溫下孵育。這種生物混合馬達的形成取決于MΦs和Mg顆粒的相對大小,其中MΦ吞噬小于5 μm的Mg顆粒。
實驗結果和數值模擬表明,MΦ–Mg馬達的運動由Mg微馬達的尺寸和MΦ在附著過程中的位置決定。MΦ–Mg馬達還具有與游離MΦ相關的生物學功能,例如內毒素中和。細胞膜染色和毒素中和研究證實了MΦ與Mg微型馬達結合后可以保持其生存力和功能性(例如內毒素中和)。這種新的MΦ–Mg馬達設計可以擴展到不同類型的活細胞,以完成各種生物學任務。
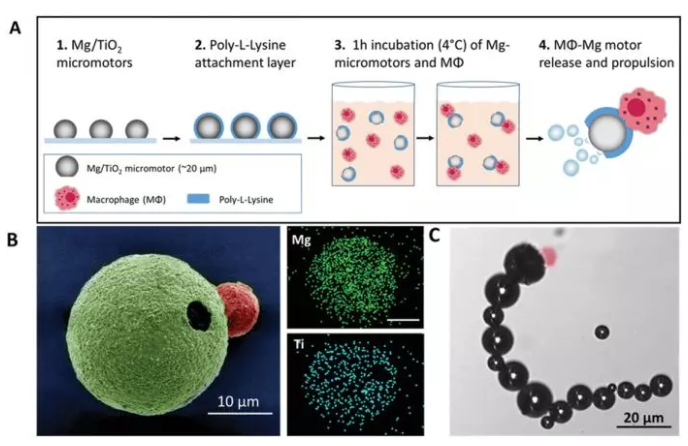
Zhang, F., Mundaca‐Uribe, R., et al., A Macrophage–Magnesium Hybrid Biomotor: Fabrication and Characterization. Adv. Mater. 2019, 31, 1901828.
https://doi.org/10.1002/adma.201901828
2. ACS nano: 基于納米馬達的胞內氧氣運輸的主動傳輸系統
氣體分子的主動轉運對維持生物體的生理功能至關重要。氧作為最基本的氣體分子,在維持細胞新陳代謝和活性中起著重要的作用。基于此,加州大學圣地亞哥分校Joseph Wang和張良方研究團隊報告了一種基于納米馬達的傳遞系統,該系統結合了聲動力金納米線(Au NW)的快速推進和紅細胞膜包裹的全氟碳納米乳(RBC-PFC)的高攜氧能力,用于細胞內氧氣的主動運輸。主要在超聲場下研究了載有RBC-PFC的AuNW納米馬達(Motor-PFC)的氧傳輸能力和動力學特征。
具體而言,Motor-PFC在聲場下的快速運動加速了J774巨噬細胞的胞內氧氣運輸。進入細胞后,Motor-PFC中負載的氧氣會持續釋放,可在缺氧條件下維持細胞活性。與游離RBC-PFC或被動Motor-PFC相比,聲動力Motor-PFC可在72h內顯著提高細胞活性(84.4%)(游離RBC-PFC為44.4%,被動Motor-PFC為32.7%)。實驗結果表明,Motor-PFC可作為高效的運輸載體用于胞內氧氣的主動運輸。盡管此項研究中僅使用氧氣作為模型氣體分子,但Motor-PFC平臺可以輕易擴展到將其他氣體分子主動輸送到各種靶細胞。
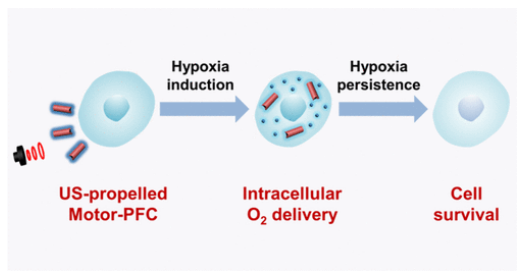
Fangyu Zhang, Liangfang Zhang, Joseph Wang, et al. A Nanomotor-Based Active Delivery System for Intracellular Oxygen Transport. ACS nano, 2019.
https://doi.org/10.1021/acsnano.9b06127
3. Nano Lett:主動運輸礦物質微馬達治療缺鐵性貧血
缺鐵是最常見的營養失調,是嚴重的公共健康問題,對身心發展有著重大影響。然而,鐵的生物利用率低和不良的副作用常常會降低治療效果。于此,加州大學圣地亞哥分校Joseph Wang和張良方等人報道了基于鎂基微馬達的主動礦物質輸送工具的發展,這種馬達可以在胃腸道體液中自動推進,有助于礦物質的動態輸送。在微馬達平臺中,鐵和硒常作為模型礦物荷載組合。
實驗證明,在治療30天后,在貧血小鼠模型中此負載礦物質的微馬達仍具有補充鐵和硒的能力,使紅細胞計數、血紅蛋白和紅細胞比容等血液學參數正常化。此外,在此治療方案中微馬達平臺無任何毒性。這項概念驗證研究表明,基于微馬達的礦物質補充劑的主動輸送是緩解營養不足的有效方法。
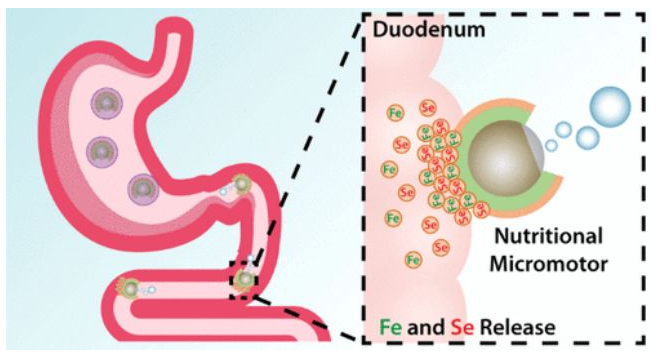
Emil Karshalev, Liangfang Zhang, Joseph Wang, et al. Micromotors for Active Delivery of Minerals toward the Treatment of Iron Deficiency Anemia. Nano Lett., 2019.
https://doi.org/10.1021/acs.nanolett.9b02832
另外:
Part Ⅱ 納米海綿與抗菌
4. ACS Nano:細胞膜油納米海綿可實現雙模式排毒
缺乏用于致命毒物的解毒劑,已引起廣泛關注,以尋求合成的納米清除劑來吸收和中和有害的生物或化學試劑。于此,張良方教授等人報道了一種具有雙重模式解毒功能的細胞膜包裹的油納米海綿制劑。仿生油納米海綿由由一個橄欖油納米液滴和一個紅細胞膜包裹而成。其中,油核可以通過物理隔離非特異性地吸收毒物,而細胞膜殼可以通過生物結合特異性地吸收和中和毒物。
使用三種不同的有機磷(OPs,包括對氧磷、氟磷酸二異丙酯和敵敵畏)驗證了油納米海綿的雙重模式解毒能力。OPs通過抑制乙酰膽堿酯酶,引起乙酰膽堿的積累,從而導致神經肌肉疾病甚至死亡。在OP中毒的小鼠模型中,油納米海綿減輕了OP中毒的臨床體征,降低了組織中OP的濃度,并大大提高了治療方案和預防方案中的小鼠存活率。總體而言,油納米海綿結合了細胞膜和油納米液滴的優點,可實現安全有效的排毒,也可以作為多模式解毒平臺的原型。

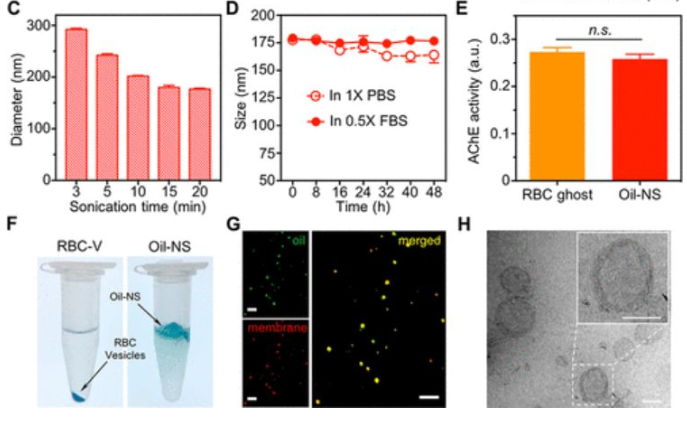
Yijie Chen, Yue Zhang, Jia Zhuang, Joo Hee Lee, et al., Cell-Membrane-Cloaked Oil Nanosponges Enable Dual-Modal Detoxification. ACS Nano 2019 13 (6), 7209-7215
https://doi.org/10.1021/acsnano.9b02773
5. Small:仿生納米海綿用于抑制全分泌致病蛋白細菌產生的體內殺傷性
包裹完整紅細胞膜的聚合物納米顆粒可作為一種仿生納米海綿(RBC-NS)去吸收和中和與許多細菌感染相關的細菌毒性因子。耐甲氧西林金黃色葡萄球菌(MRSA)的全分泌蛋白(wSP)在小鼠體內可以誘導產生致死性。wSP不僅保持了細菌毒性的復雜性,同時也解決了活細菌感染的復雜性和動態性問題。
張良方教授等人分析了RBC-NS對MRSAwSP的體外中和能力。通過小鼠模型的體內研究進一步證明, RBC-NS可顯著降低wSP誘導的致死率。此外,當小鼠服用亞致死劑量的MRSA上清液時,RBC-NS也可減少肺損傷并抑制脾臟核轉錄因子kappa B的活化。這些結果也為RBC-NS治療MRSA感染(如MRSA菌血癥和MRSA誘導的敗血癥)提供了系統的評價。
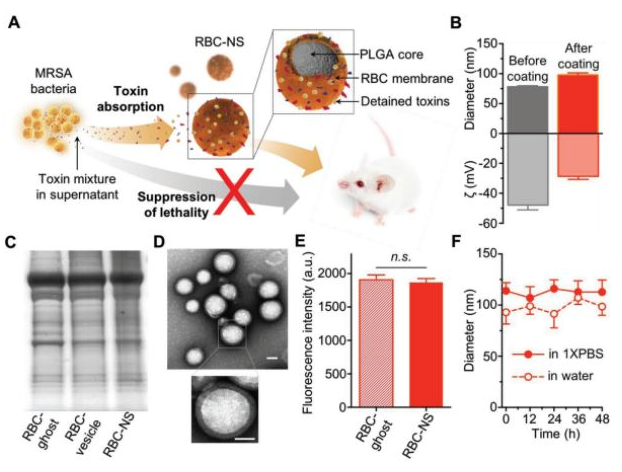
Chen Y J, Zhang Y, et al. Biomimetic Nanosponges Suppress In Vivo Lethality Induced by the Whole Secreted Proteins of Pathogenic Bacteria[J]. Small, 2019.
https://doi.org/10.1002/smll.201804994
6. Angew:細菌外膜包裹納米粒抑制病原菌粘附
抗粘附療法會干擾細菌與宿主的粘附,從而避免直接破壞細菌的殺滅周期,這可能會減緩耐藥性的發展。于此,加州大學圣地亞哥分校張良方教授等人通過用細菌外膜包裹合成聚合物核,制備了一種抗粘附納米藥物平臺。由此產生的仿細菌納米顆粒(OM-NPs)與源細菌競爭以結合宿主。
“自上而下”制造的OM-NPs避免了粘附素的識別,并繞過了針對這些粘附素的激動劑的設計。在本研究中,OM-NPs是由幽門螺桿菌膜制成的,并顯示與胃上皮細胞(AGS細胞)結合。用OM-NPs治療AGS細胞可降低幽門螺桿菌的粘附力,這種抗粘附作用取決于OM-NP濃度及其給藥順序。
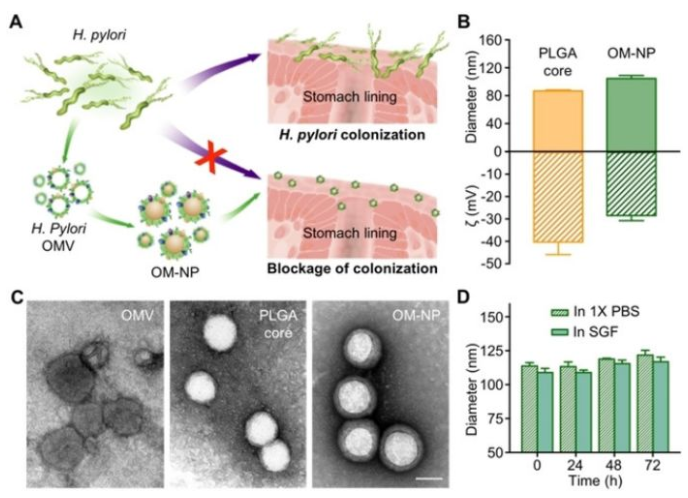
Y. Zhang, Y. Chen, et al., Inhibition of Pathogen Adhesion by Bacterial Outer Membrane‐Coated Nanoparticles. Angew. Chem. Int. Ed. 2019, 58, 11404.
https://doi.org/10.1002/anie.201906280
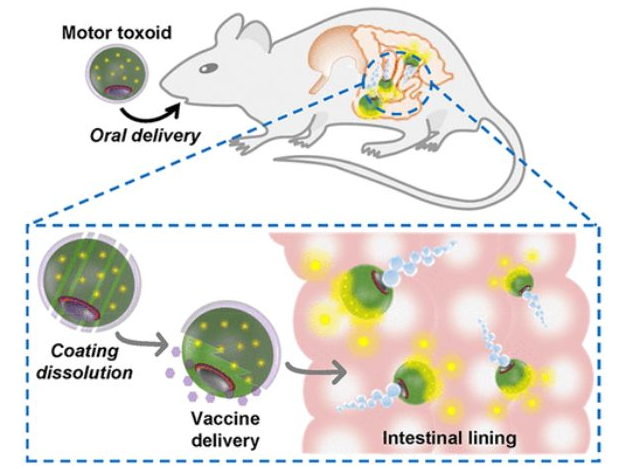
7. Nano Lett.:多抗原納米類毒素用于對抗耐藥革蘭氏陰性細菌
由耐多藥的革蘭陰性菌引起的感染已成為全球公共衛生所面臨的一項重大威脅。加州大學圣地亞哥分校Ronnie H. Fang和張良方教授等人報道了一種基于巨噬細胞膜包裹的納米顆粒的多抗原納米類毒素疫苗,該疫苗可誘導對致病性銅綠假單胞菌的強免疫反應。這種仿生納米疫苗的設計利用了巨噬細胞在清除病原體中的特殊作用以及它們對細菌分泌的各種毒性因子的天然親和力。
結果表明,巨噬細胞納米類毒素能有效表達銅綠假單胞菌抗原,其體外和體內的安全性也得到了充分的證實。當通過不同的給藥途徑給肺炎模型小鼠接種疫苗時,該納米類毒素能夠激發強大的體液免疫反應來對抗炎癥感染。這一工作也為利用仿生納米技術設計安全的、多抗原抗病毒疫苗以及應用這些納米疫苗預防耐多藥革蘭氏陰性感染提供了新的策略。
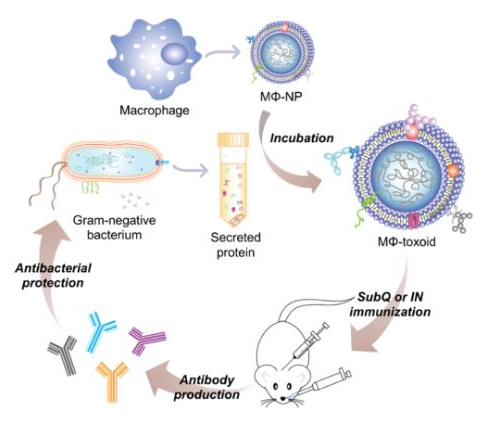
Xiaoli Wei, Danni Ran, Ronnie H. Fang, Liangfang Zhang. et al. Multiantigenic Nanotoxoids for Antivirulence Vaccination against Antibiotic-Resistant Gram-Negative Bacteria. Nano Letters. 2019
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b01844
另外:

Part Ⅲ 綜述
8. AM綜述:仿生納米技術用于構建個性化疫苗
雖然現代醫學為治療很多傳統疾病帶來了新的希望,但在目前的現狀基礎上還可以有很大的改進空間。例如一些傳染病,具有抗生素耐藥性的超級病原體對大多數目前臨床批準的藥物已經沒有反應。而在癌癥治療領域,設計“靈丹妙藥”的想法也早已被人們拋棄。因此,越來越多的人提倡個性化治療,即根據患者的具體情況制定醫療保健計劃。而開發針對細菌和腫瘤的疫苗則是一種很好的體現個性化治療的方案。接種有效的疫苗可以幫助解決許多具有挑戰性的疾病,但目前的疫苗仍受到效力不足和抗原廣度等因素的限制。最近,一些研究人員開始使用仿生納米技術來解決這些障礙。加州大學圣地亞哥分校Ronnie H. Fang教授和張良方教授等人綜述了近年來仿生納米疫苗在抗菌和抗癌方面的研究進展,并著重介紹了其在個體化治療方面的應用潛力。
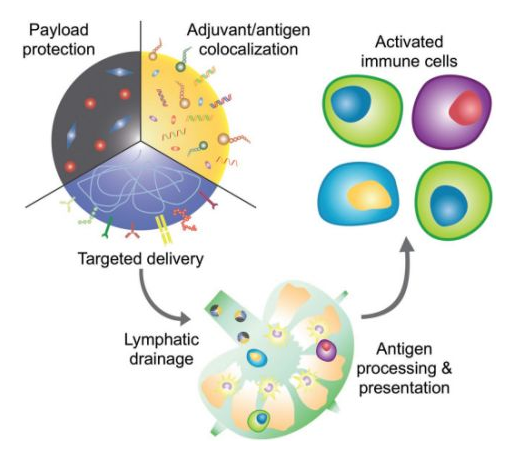
Jiarong Zhou, Ronnie H. Fang, Liangfang Zhang. et al. Biomimetic Nanotechnology toward Personalized Vaccines. Advanced Materials. 2019
https://doi.org/10.1002/adma.201901255
9. Nanoscale Horizons:納米仿生技術用于心血管疾病的診療
心血管疾病(CVD)包括許多會影響心臟和血管的疾病,是現代醫療所面臨的一大重要挑戰。研究表明,由近三分之一的人患有不同形式的CVD,其中許多人還患有多種相互影響的疾病,最終往往導致心臟病發作或中風等嚴重后果。即使在發達國家,心血管疾病也仍然是導致死亡的主要原因之一。
最近,許多研究人員探索了利用納米技術以對目前臨床治療CVD的策略進行改進。納米級給藥系統具有許多優點,包括可靶向病變部位、提高藥物生物利用度和遞送多功能載荷的能力等等。加州大學圣地亞哥分校Ronnie H. Fang和張良方教授等人綜述了納米材料技術在CVD診療領域中的應用,對開發具有增強功能的新型仿生平臺進行了詳細的討論。
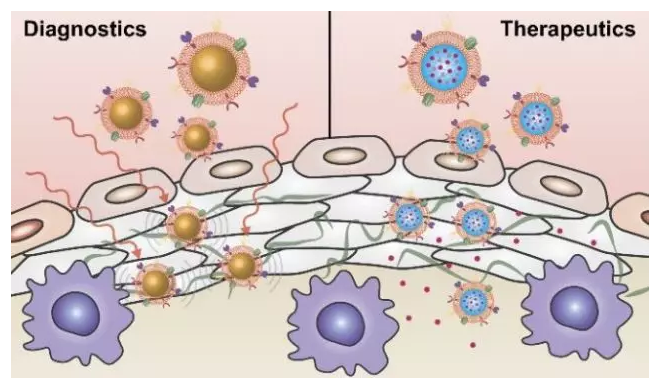
Joon Ho Park, Diana Dehaini, Ronnie H. Fang, Liangfang Zhang. et al. Biomimetic nanoparticle technology for cardiovascular disease detection and treatment. Nanoscale Horizons. 2019
https://doi.org/10.1039/C9NH00291J
另外:


Part Ⅳ 其他
10. ACS Nano:配體修飾的細胞膜輔助藥物納米晶體靶向膠質瘤
安全有效地遞送化療藥物是化療抗癌的關鍵。復旦大學陸偉躍教授團隊和加州大學圣地亞哥分校張良方教授團隊合作制備了一種基于配體修飾的細胞膜和藥物納米晶體(NCs)的靶向藥物遞送系統。實驗利用紅細胞(RBC)膜去包裹藥物納米晶體NCs得到RBC-NCs,其具有高載藥量、高的長期穩定性、良好的生物相容性和較長的循環時間,適合用于進行有效的藥物遞送。而經腫瘤靶向肽c(RGDyK)修飾后的RGD-RBC-NCs對皮下腫瘤小鼠和原位膠質瘤均有較好的腫瘤積累和治療效果。
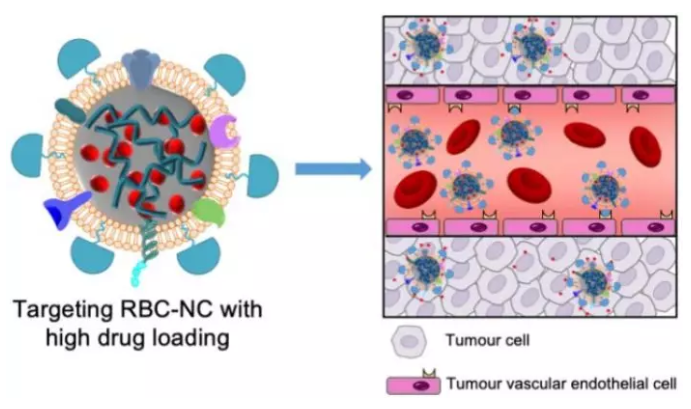
Zhilan Chai, Liangfang Zhang, Weiyue Lu. et al. Ligand-Modified Cell Membrane Enables Targeted Delivery of Drug Nanocrystals to Glioma. ACS Nano. 2019
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b00661
11. ACS Nano:生物膜修飾場效應晶體管用于檢測生物毒素和病原體
利用復雜的、動態的和未知的分子特征來檢測生物活性靶點的工作激發了各種生物傳感器平臺的發展。于此,加州大學張良方和Sheng Xu等人報道了細胞膜修飾場效應晶體管(FET)作為一種基于功能的納米傳感器,用于檢測和定量測量多種毒素和生物樣品。通過用天然紅細胞膜包覆碳納米管FET,所得到的仿生納米傳感器無論其分子結構如何,都能選擇性地與廣譜溶血毒素相互作用和吸收。
毒素-生物膜相互作用以超靈敏和濃度依賴的方式改變FET表面的局部電荷分布,毒素與生物膜的相互作用以超靈敏和濃度依賴性的方式改變了FET表面的局部電荷分布,從而導致檢測限降至飛摩爾(fM)范圍。通過傳感器的內置校準機制可以進行準確和定量的測量,克服了批次之間的制造差異,并使用三種不同的毒素和各種復雜的細菌上清液進行了演示。細菌分泌蛋白的測量信號與實際細菌數量線性相關,這使生物傳感器成為一種非傳統方法,可以快速檢測細菌濃度而無需計算細菌菌落。
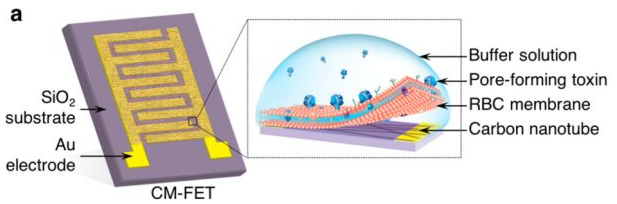
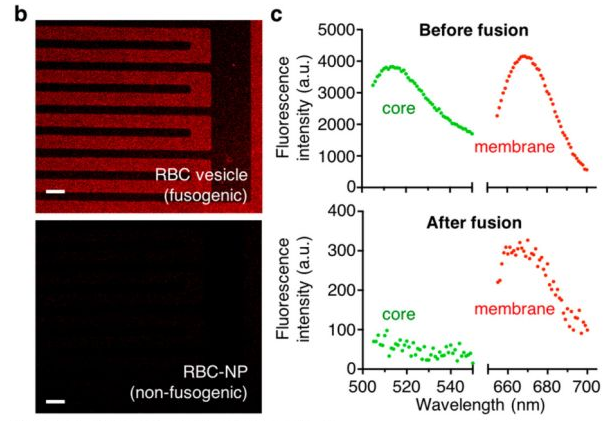
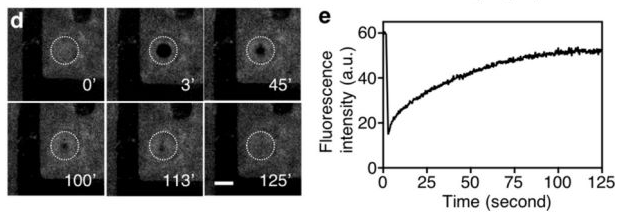
Hua Gong, Fang Chen, et al., Biomembrane-Modified Field Effect Transistors for Sensitive and Quantitative Detection of Biological Toxins and Pathogens. ACS Nano 2019 13 (3), 3714-3722
https://doi.org/10.1021/acsnano.9b00911
另外,還有一些張良方教授其他成果不在此一一列舉,感興趣的讀者可前往課題組網站進行學習。
課題組網站:http://nano.ucsd.edu/~l7zhang/index.php
張良方教授簡介

張良方,2002年進入美國伊利諾伊大學香檳分校化工系,在Steve Granick教授的指導下攻讀博士學位。2006~2008年加入麻省理工學院化工系,在Robert Langer教授的研究組進行博士后工作。2008年7月,加入加州大學圣地亞哥分校納米工程系任助理教授,于2012年3月晉升為終身副教授,2014年7月晉升為終身正教授。
2009年獲得美國化學會的Victor K. LaMer獎;2013年被《麻省理工學院技術商評》雜志評為“2013年度世界最杰出青年創新專家”;2014年獲美國化學工程師學會的Allan P. Colburn獎;2015年入選美國醫學和生物工程學會會士。
(注:以上簡介及文中海報整理自網絡及張良方教授課題組網站)











