全身毒性是抗癌藥物成敗的最重要決定因素之一。由于全身藥物暴露而產生的副作用使血漿藥物濃度達到的上限,通常遠低于體外最佳劑量。克服這一問題的一般做法是將藥物特異性靶向至腫瘤細胞,或者在作用部位局部激活前藥。

丹麥奧胡斯大學Alexander N. Zelikin發表了一篇文章闡明腫瘤微環境具有獨特的酶譜,為腫瘤治療提供了契機:
腫瘤的微環境在許多方面與正常組織不同,這些差異為癌癥檢測、成像和治療提供了多種設計思路。即:
1)腫瘤內通常為低氧環境,為開發缺氧激活的前藥提供了理論基礎;
2)腫瘤通常以血管通透性增加和淋巴排出障礙為特征,這被用來構建大分子/超分子藥物載體通過被動靶向以增加遞送藥物劑量;
3)癌細胞表面過度表達多種標志物,可用于主動藥物靶向。
腫瘤微環境還在另一重要方面與正常組織不同,即含有獨特的酶譜。癌細胞經常過度表達代謝酶,且在腫瘤細胞外空間中也存在正常組織細胞內的各種酶。這一發現為通過酶前藥療法(EPT)進行瘤內藥物合成提供了基礎。雖然過去已經使用位點特異性酶定位的方法建立了多種形式的EPT,但現在很明顯,腫瘤內部獨特的酶譜本身可能提供所需的生物催化機制,以實現位點特異性的局部藥物合成。

EPT的不同在于將酶定位到腫瘤部位的方法,一般通過使用抗體、定位基因表達、將酶工程化到可植入生物材料中來實現。通過先天的、疾病介導的EPT(i-EPT)使用腫瘤本身的酶譜是一種絕妙而獨特的癌癥治療干預策略,而成功的i-EPT則需要最大限度地將前藥輸送到腫瘤。
成果簡介
有鑒于此,丹麥奧胡斯大學Alexander N. Zelikin等人專注于葡糖苷酸支架和工程分子、高分子和超分子前藥,所有設計的前藥都成功地掩蓋了被摻入藥物的毒性,所有的前藥都在體外通過酶生物轉化釋放了藥物,但只有一種前藥在體內有顯著的抗癌作用。這項研究的結果對于提出一種新穎的、優越的支架作為腫瘤前藥載體具有重要意義。
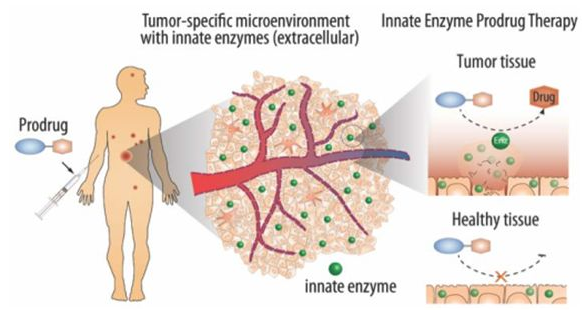
示意圖
前藥的設計
基于鄰位取代對羥基苯甲醇(PHBA)的模塊化自分解前藥支架構建了一個分子、大分子和超分子前藥庫。該支架的獨特之處在于,提供了三個修飾部位以安裝i)效應器分子、ii)藥物釋放觸發器和iii)延長臂。使用了單甲基auristatin E(MMAE)作為藥物,,這是一種在醫學實踐中使用的最有效的毒素之一。最后,在合成后期引入延長臂R(PEG),以及二硬脂酰基磷脂酰乙醇胺(DSPE)、4-(對碘苯基)丁酸(Albu Tag)和三苯甲基(Tr),其中后三種是已知的白蛋白粘合劑。
通過改變延長臂R,共獲得了8種前藥。分子前藥結構最簡單,水溶性高,在合成的前藥中有望具有最短的血液停留時間。大分子前藥通過PEG化來設計,該策略通過增加流體力學半徑來限制分子的腎臟排泄,并通過EPR效應來增強腫瘤積聚。超分子前藥是為了受益于白蛋白有益的藥代動力學特性而設計的,包括延長血液停留時間和潛在增加腫瘤積聚。
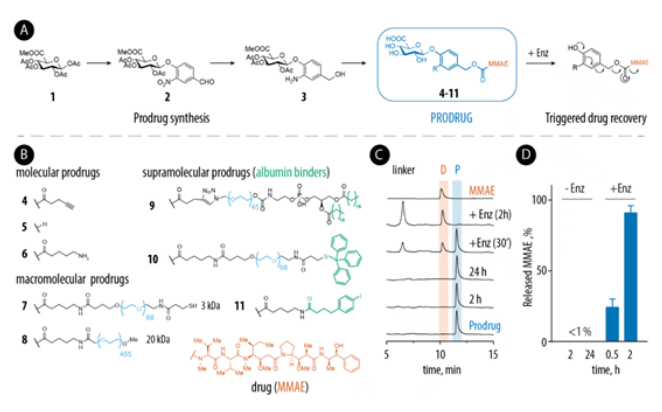
前藥結構、合成方案和生物轉化
不同前藥的性能
所有合成的葡糖苷酸前藥都表現出高度的穩定性。所有前藥均在β-葡萄糖苷酸酶存在下定量釋放MMAE,表明延長臂R不阻礙酶前藥的激活。
前藥的結構,特別是延長臂R對前藥的IC50,及它們進行酶生物轉化的能力有深遠的影響。且所設計的前藥生物轉化機制依賴于內源性酶,而不是外部給藥酶。
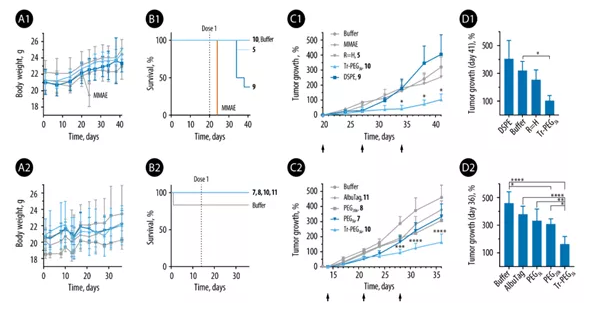
體內分析數據
原始的MMAE證明是劇毒的,且沒有療效。分子前藥顯著降低了MMAE的全身毒性,耐受性良好,但沒有明顯的抗癌作用。這項工作中測試的大多數大分子(PEG3k)和超分子(DSPE,Albu Tag)前藥也是如此,雖然治療的毒性比MMAE單一療法有很大改善,但并未觀察到治療效果的顯著改善。
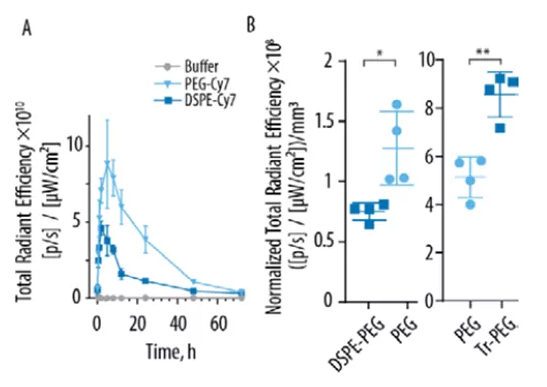
藥代動力學
基于Tr-PEG的前藥具有較高的體內活性,而其無白蛋白結合基團(R=PEG3k)的類似物則無活性,證明白蛋白結合是發揮抗癌作用的關鍵。然而,基于DSPE-PEG和Albu Tag的前藥都是白蛋白親合物,都是無效的,這表明白蛋白親合物本身并不足以成功。無論是用于疫苗還是抗癌藥物的輸送,白蛋白結合物對于產生的超分子加合物的體內表現是不同的。最重要的是,體外毒性篩查似乎不能提供預測性知識,也無法為體內評估指定先驗線索。經過實驗證明,Tr-PEG延長臂是實現前藥增強腫瘤定位并隨后抑制腫瘤生長的最有效工具。
計算建模
小結:
這項研究的重要之處在于設計并比較了MMAE的分子、大分子和超分子葡糖苷酸前藥,以實現腫瘤體內的局部自主生物轉化,隨后抑制腫瘤生長。在體內外觀察,所有前藥均能顯著掩蔽MMAE毒性,且所有前藥在生物轉化后均釋放MMAE。
值得注意的是,只有兩種前藥表現出統計上顯著的抑制腫瘤生長作用,其中一種制劑表現出明顯的領先地位。從體外毒性篩選或體內藥代動力學參數(總藥物暴露AUC、Cmax、Tmax和血漿半衰期T1/2β)不能預測識別出最佳者,當比較具有相同延長臂的成像探針和抗癌前藥時,發現抗癌效果只與另一個參數相關,即探針的腫瘤定位程度。
參考文獻:
1.Alexander N. Zelikin.Unique enzymatic repertoire reveals the tumour, Nat. Chem., 2019.
DOI: 10.1038/s41557-019-0400-0
https://doi.org/10.1038/s41557-019-0400-0
2.Morten T. JarlstadOlesen, et al. Molecular, macromolecular, and supramolecular glucuronide prodrugs:an unexpected lead identified for anticancer prodrug monotherapy, Angew. Chem.Int. Ed., 2020.
DOI:10.1002/anie.201916124
http://dx.doi.org/10.1002/anie.201916124











