奇物論聯合納米人編輯部對2019年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是中國科學院院士,發展中國家科學院院士,JACS副主編,湖南大學譚蔚泓教授課題組。
譚蔚泓院士長期致力于生物分析化學,化學生物學和分子醫學方面的研究,在核酸適體、分子識別、納米生物傳感等領域做了大量系統的原創性工作,主要包括:
1)提出了核酸適體活細胞篩選的新方法,利用獲得的分子探針實現了癌癥等多種重大疾病細胞的特異性識別,為解決細胞研究缺乏分子探針的難題開辟了全新的途徑;
2)探索了分子醫學,納米生物學和化學生物學的交叉研究新方向,開發了DNA膠束、DNA水凝膠等生物納米新材料;
3)提出多種高靈敏、高時空分辨納米生物傳感方法,在國際生物分析化學領域有著重要的影響。

下面對譚蔚泓院士課題組2019年的部分研究成果進行匯總,供大家學習交流。
(文章以通訊作者為主,因學術水平有限,如有表述不當,敬請批評指正。)
以下分五個部分展開:
Part 1. 生物傳感器
Part 2. 近紅外成像
Part 3. 適體-藥物結合物
Part 4. 人工細胞
Part 5. 其它
Part 1. 生物傳感器
1. JACS:用于編程細胞相互作用的細胞膜錨定DNA納米平臺
細胞-細胞相互作用,對單個細胞和多細胞組織的命運和功能都至關重要,而細胞間的相互作用是通過膜上表達的組分介導的。將細胞表面功能化賦予其高生物相容性、高可控性和高穩定性的功能模塊,將為研究和操縱這些細胞間反應提供很好的機會。然而,由于細胞膜的復雜性和動態性,這仍是一項技術挑戰。
有鑒于此,湖南大學譚蔚泓院士、邱麗萍等人以三維(3D)兩親性金字塔DNA為支架,開發了一種可生物相容、高效和多功能的DNA探針,用于細胞表面工程化。與線性DNA結構相比,這些金字塔探針顯示出更高(近100倍)的膜錨定穩定性和更高(約2.5倍)的靶向可及性。同時,它們能夠在細胞之間建立特定的、有效的和可調的連接。此外,研究結果表明,緊密連接細胞是啟動細胞間通訊的關鍵。通過結合DNA探針的高可編程性和高多樣性,這一策略有望為研究多細胞通信網絡提供一個強大的、可設計的膜錨定納米平臺。
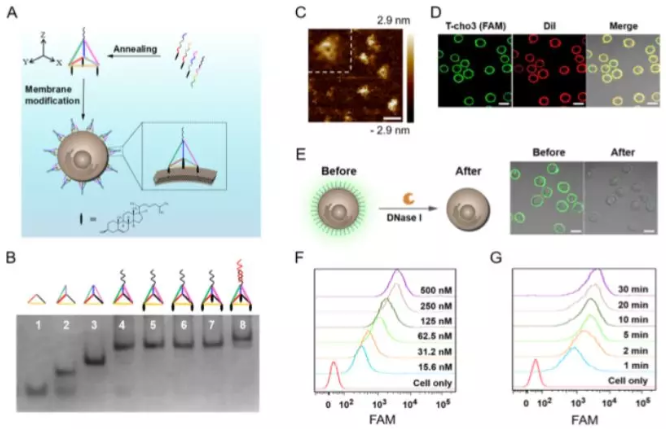
Jin Li, Kanyu Xun, Ke Pei, et al. Cell-Membrane-Anchored DNA Nanoplatform for Programming Cellular Interactions. J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.9b04725
2. JACS:三螺旋末端固定可增強工程化適體親和性
適體的親和性依賴于它們的適應性折疊,但適體骨架的過度靈活性通常會阻礙折疊過程。因此,迫切需要設計出具有更穩定和更明確結構的適體。有鑒于此,湖南大學譚蔚泓院士、Liqin Zhang,中國海洋大學王賽等人報告了一種通過固定端粒長度與優化的三螺旋結構用于構建穩定適體結構的策略。
首先通過這種方式構建了一種抗溶菌酶適體,其親和力提高了近10倍。接著在此工程化核酸適體基礎上,以DNA四面體為間隔體對適體進行定向設計了一種電化學適體傳感器。與無末端固定的適體傳感器相比,此適體傳感器的檢測限降低了180倍,并且對真實紅葡萄酒樣品中的溶菌酶表現出較高的靈敏度和選擇性。這項工作有助于工程化適體實現親和力的增強,同時為適體傳感器在復雜基質中的應用提供了參考。
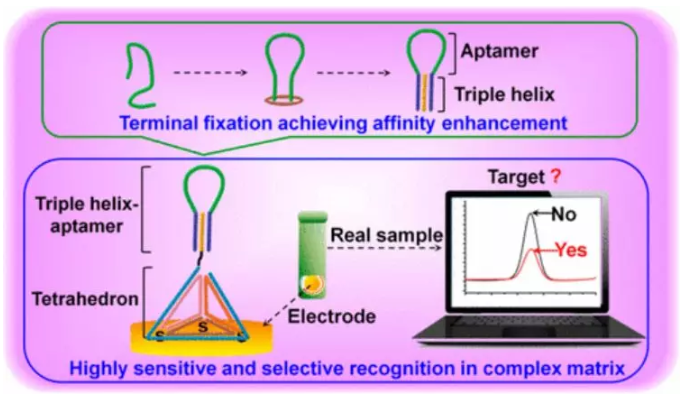
Lianhui Zhao, Xiaoyan Qi, Xiaochen Yan, et al. Engineering Aptamer with Enhanced Affinity by Triple Helix-Based Terminal Fixation. J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.9b09292
3. JACS:乏氧激活的PEG化適體/抗體用于提高特異性癌癥成像
作為分子識別探針,適體和抗體在癌癥的診斷和治療中起著至關重要的作用。但是,它們的識別能力是基于疾病細胞中靶標的過度表達,而不是靶標的排他性,后者可能導致on-target off-tumor效應。為了解決該局限性,湖南大學譚蔚泓院士、中科院化學研究所方曉紅研究員等人報道了一種新策略來開發有條件的適體配合物以識別其細胞表面靶標,但只能在選擇性激活后才能識別,該激活是由疾病微環境的特征所確定的,如該項工作選擇腫瘤缺氧。
該條件適體是將適體與對缺氧有反應的PEG5000-偶氮苯-NHS結合的結果,PEG在此處充當條件識別的籠蔽部分。更具體地說,籠蔽部分在完整的結合物中無反應并阻止靶標識別。但是,在連二亞硫酸鈉存在或低氧(<0.1% O2)下或在腫瘤微環境中,籠蔽部分會通過允許條件識別細胞表面靶標而作出反應,從而降低on-target off-tumor效應。該工作還證實該策略可用于開發條件抗體。因此,這項研究展示了一種有效策略,用于開發基于適體/抗體的診斷探針和治療藥物用于具有獨特的低氧微環境的癌癥。
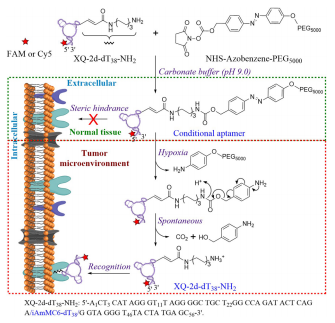
Fang Zhou, Ting Fu, Qin Huang, et al. Hypoxia-Activated PEGylated Conditional Aptamer/Antibody for Cancer Imaging with Improved Specificity. J. Am. Chem. Soc., 2019.
DOI: 10.1021/jacs.9b05063
https://doi.org/10.1021/jacs.9b05063
4. JACS: 活細胞表面適體置換反應及其應用
DNA鏈置換反應在構建復雜的核酸網絡方面一直具有重要的科學意義。然而,將基本機制擴展到復雜環境中更多樣化的生物分子仍然是具有挑戰性的。適體以高親和力和高選擇性與靶生物分子結合,從而為將核酸的能量與不同的信號聯系起來提供了一條很有前途的途徑。
有鑒于此,湖南大學譚蔚泓院士、上海交通大學Juan Li等人描述了三種方法,可以使用補體DNA(CDNA)、toehold標記cDNA(tcDNA)和單鏈結合蛋白(SSB)從活細胞表面進行簡單有效的適體置換反應。自然膜的復雜物理化學性質嚴重影響了DNA鏈置換反應的動力學。Toehold介導和SSB介導的適體置換表現出顯著的動力學增強,并且它們能迅速完全去除適體,避免適體內化造成假信號。由于適體置換的簡單性,使膜蛋白翻譯后的檢測成為可能,提高了細胞SELEX的選擇效率。
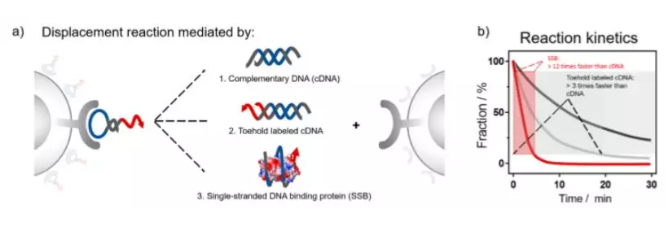
Long Li, Xigao Chen, Cheng Cui, et al. Aptamer Displacement Reaction from Live-Cell Surfaces and Its Applications, J. Am. Chem. Soc., 2019.
DOI:10.1021/jacs.9b07191
https://doi.org/10.1021/jacs.9b07191
5. JACS:活細胞膜上基于多適體的DNA邏輯門的構建以實現癌細胞的特異性識別
準確識別和分離細胞的能力是精確診斷和治療疾病的基礎。基于多個表面標志物邏輯分析的單步細胞識別方法,由于其準確性和有效性將具有獨特的優勢。
有鑒于此,譚蔚泓院士、上海交通大學韓達等人以識別腫瘤生物標志物的多個DNA適體及信號整合和擴增的聯合toehold激活為兩個分子鍵,成功地操作了一個細胞表面裝置,該裝置可以對多個生物標志物進行AND Boolean邏輯分析,并通過存在或不存在不同的生物標志物,在大量相似的細胞中精確地標記靶細胞亞型。該方法可以實現癌細胞的一步識別和分離,具有良好的靈敏度和準確性,在生物科學、生物醫學工程和個性化醫學等領域具有廣泛的應用前景。
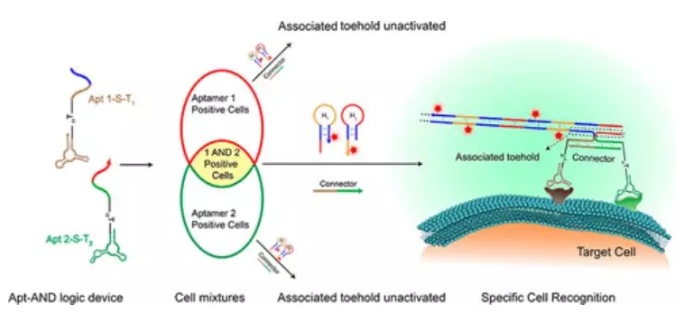
Xu Chang, Chao Zhang, Cheng Lv, et al. Construction of a Multiple-Aptamer-Based DNA Logic Device on Live Cell Membranes via Associative Toehold Activation for Accurate Cancer Cell Identification, J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.9b05470
6. JACS:CD71作為細胞特異性適體結合分子靶點的解釋及結構模擬
胰腺癌是一種與胰腺組織相關的高致死性惡性腫瘤。早期診斷和有效治療是提高胰腺癌患者生存率的關鍵。在先前的研究中,采用細胞-SELEX策略獲得了一個與胰腺癌具有高結合親和力的ssDNA適體XQ-2d。
有鑒于此,湖南大學譚蔚泓院士、葉茂等人首先將CD71確定為XQ-2d結合目標。結果發現,CD71的敲除取消了XQ-2d的結合,XQ-2d的結合親和力與膜結合的CD71有關,而與CD71的總量無關。競爭分析表明,XQ-2d與轉鐵蛋白(Tf)在CD71上有相同的結合位點,但不與抗CD71抗體結合。然后用表面能量轉移(SET)納米尺測量了XQ-2d與抗CD71抗體的結合位點之間的距離,約為15 nm。此外,分子動力學模擬闡明XQ-2d和Tf的空間結構與CD71競爭結合。接著還設計了XQ-2d介導的胰腺癌靶向治療,使用基于XQ-2d的復合物來負載阿霉素(Dox)。由于CD71不僅在胰腺癌中過表達,在多種腫瘤中都過表達,該工作為研究潛在的生物標記物提供了一種系統的新方法,也為癌癥診斷和治療提供了有前途的工具,為有效的癌癥治療打開了新的大門。
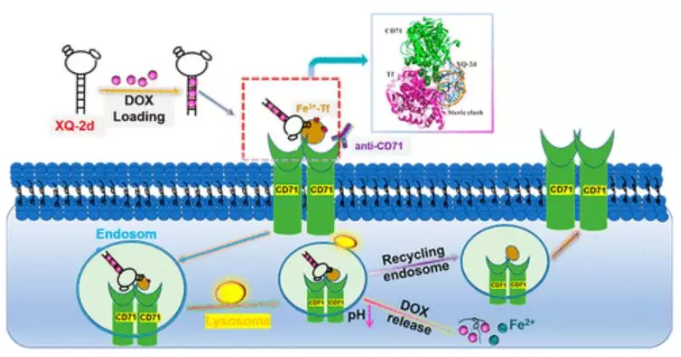
Xiaoqiu Wu, Honglin Liu, Dongmei Han, et al. Elucidation and Structural Modeling of CD71 as a Molecular Target for Cell-Specific Aptamer Binding, J. Am. Chem. Soc., 2019
https://doi.org/10.1021/jacs.9b03720
7. Nat. Commun.: 磷酸化脂質結合寡核苷酸選擇性錨定在高表達堿性磷酸酶的細胞膜上
將脂尾附著在寡核苷酸上已成為構建細胞膜錨定核酸探針的有力技術。然而,在實踐中,傳統的脂質結合寡核苷酸不能區分不同的細胞膜。有鑒于此,譚蔚泓院士等人報道了一種磷酸化脂質結合寡核苷酸(DNA- lipid-P)用于堿性磷酸酶(ALP)依賴性細胞膜粘附。
在沒有堿性磷酸酶(ALP)的情況下,疏水性較差的DNA-lipid-P與細胞膜的相互作用較弱。然而,在高表達的質膜相關ALP存在的情況下,DNA- lipid -P通過酶解去磷酸化轉化為脂質結合寡核苷酸(DNA- lipid)。作為這種轉化的結果,生成的DNA- lipid比DNA- lipid -P具有更強的疏水性,因此能夠原位插入細胞膜。所以,DNA- lipid -P能夠選擇性地錨定在ALP水平升高的細胞膜上。由于ALP水平升高是某些疾病甚至癌癥的重要指標,DNA- lipid -P有望在分子水平上用于細胞膜工程和疾病診斷。
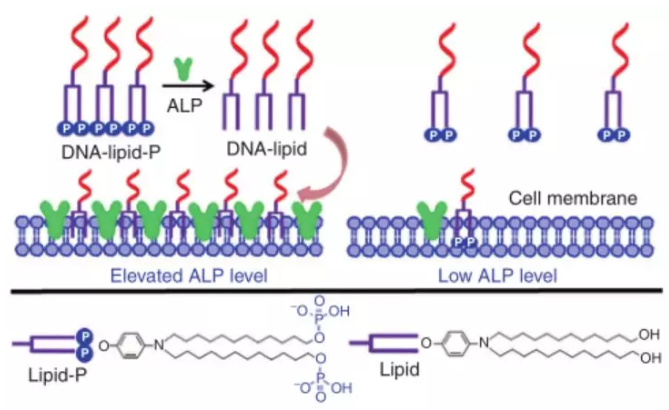
Cheng Jin, Jiaxuan He, Jianmei Zou, et al. Phosphorylated lipid-conjugated oligonucleotide selectively anchors on cell membranes with high alkaline phosphatase expression, Nat. Commun., 2019.
https://doi.org/10.1038/s41467-019-10639-6
Part 2. 近紅外成像
8. Angew:NIR-II染料對肽聚糖進行代謝標記用于腸道微生物群體內成像
由于缺乏簡便、實時的體內細菌成像策略,目前人們對于哺乳動物腸道菌群的了解還遠遠不足。廈門大學楊朝勇教授和湖南大學譚蔚泓院士合作設計一種基于NIR-II染料的、對腸道細菌進行活體成像的方法。
實驗使用D-丙炔丙氨酸(DPG)對小鼠進行灌胃并收集被DPG標記的腸道微生物群,然后將其通過點擊化學與含有疊氮的NIR-II染料進行反應,進而再通過灌胃的方法使得小鼠腸道菌群的肽聚糖被標記上NIR-II染料。在近紅外光的輻射下,細菌產生的熒光信號在小鼠腸道內具有較高的空間分辨率和較深的組織穿透性,并且這種化學方法也可用于對不同種類的細菌進行成像,從而擴大了其在微生物學中的適用性。此外,研究通過這一方法也發現腸道菌群的生物分布會受到宿主胃腸動力的顯著影響。這一研究所報道的基于NIR-II的代謝標記策略也為在體內觀察深層組織中的微生物群提供了首個方案,從而為破譯了解這些腸道“暗物質”的復雜生物學提供了一個新的有力工具。
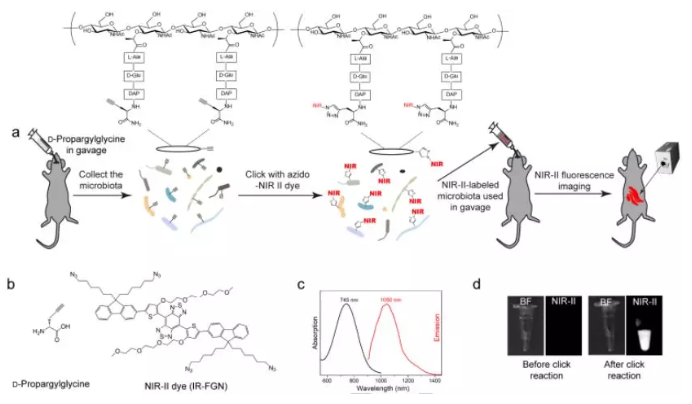
Wei Wang, Chaoyong Yang, Weihong Tan, et al. Metabolic Labeling of Peptidoglycan with NIR-II Dye Enables in vivo Imaging of Gut Microbiota. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201910555
https://doi.org/10.1002/anie.201910555
9. Angew:近紅外熒光可視化技術有望轉化為通用工具
作為一種方便識別、能檢測不同環境及生物分析物的首選工具,熒光可視化技術(FV)正迅速發展。目前,FV主要是基于在可見光波長下具有熒光響應的熒光探針而設計的。盡管目前已取得一些研究進展,但此類探針仍然存在可見光響應的固有問題,如強自體熒光、較大的背景噪音、較差的穿透性等,這是該技術從實驗室到臨床轉化最大的阻礙。
為了突破這些障礙,湖南大學譚蔚泓院士、劉艷嵐等人設計了一種簡單的NIR-FV策略,該策略通過啟動-輸入-傳導機制可對NIR熒光響應實現肉眼“透視”檢測。以光氣作為研究對象,發現該方法能高效、快速地將光氣誘導的“關-開”近紅外熒光響應轉換為無儀器、靈敏度高、特異性好、背景干擾和環境干擾小的裸眼讀數。通過進一步探索其他近紅外響應熒光團,這種策略有望成為一種通用工具,方便、經濟、但功能強大地識別和檢測許多有害分析物。
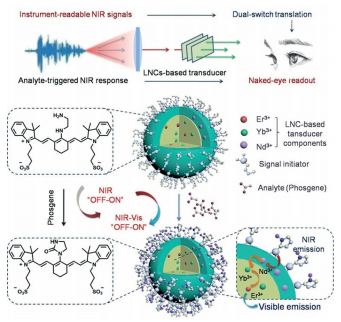
Dailiang Zhang, Linlin Wang, Xi Yuan, et al. Naked-Eye Readout of Analyte-Induced NIR Fluorescence Responses by an Initiation-Input-Transduction Nanoplatform. Angew. Chem. Int. Edit., 2019.
DOI: 10.1002/anie.201911113
https://doi.org/10.1002/anie.201911113
Part 3. 適體-藥物結合物
10. JACS:生物正交適體-前藥共軛膠束分子自組裝—癌癥化學動力學治療新策略
化學動力學療法(CDT)通過對失調的腫瘤自由基穩態的特異性調控,為選擇性和邏輯性癌癥干預提供了新的可能性。目前的CDT方法很大程度上依賴于經典的Fenton或Haber-Weiss化學反應將內源性過氧化氫(H2O2)轉化為劇毒的羥基自由基。然而,它們的抗癌效果卻受到極大限制,包括它們需要強酸性來進行高效的化學反應,同時腫瘤中H2O2不足以及增強抗氧化防御以對抗自由基引起的氧化損傷等。
有鑒于此,湖南大學譚蔚泓院士、劉艷嵐等人提出了一種新的概念,將生物正交化學和前藥相結合創建了一種新型的適配體藥物結合物(ApDC):適配體-前藥共軛物(ApPdC)膠束,用于改善和癌癥靶向的CDT。疏水性前藥堿基不僅可以促進適配體的自組裝,而且還可以通過生物正交化學作為自由基生成劑。深入的機理研究表明,與傳統的CDT系統不同,ApPdC膠束能夠通過級聯生物正交反應在癌細胞中原位激活和自循環產生有毒的C-中心自由基,而不依賴于H2O2或pH,同時由于GSH的耗竭而降低了癌癥的抗氧化作用,從而實現了協同CDT效應。預計這項工作能為癌癥靶向治療的設計和自由基相關分子機制的研究提供新見解。
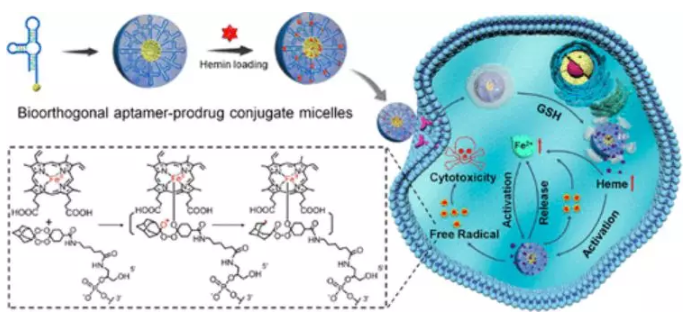
Wenjing Xuan, Yinghao Xia, Ting Li, et al. Molecular Self-Assembly of Bioorthogonal Aptamer-Prodrug Conjugate Micelles for Hydrogen Peroxide and pH-Independent Cancer Chemodynamic Therapy. J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.9b10755
11. Angew:6-letter DNA組裝的適體納米序列用于癌癥治療
作為DNA納米技術的一個分支,使用Watson-Crick配對來組裝得到的DNA和/或RNA(統稱XNA)分子,具有比線性雙螺旋更復雜的結構,能表現出超出簡單信息存儲的功能行為。在復雜的生物系統中創造天然DNA/RNA無法侵入的納米組裝體,在擴大DNA中核苷酸數量的同時可增加功能性DNA分子的信息密度。
有鑒于此,湖南大學譚蔚泓院士、佛羅里達州應用分子進化基金會研究所Steven A. Benner等人通過如下兩部分展示了6‐letter GACTZP DNA如何在納米組裝中發揮這一特性:(1)從6‐letter DNA文庫中進化而來的適體,選擇性地結合肝癌細胞;(2)攜帶藥物阿霉素的6‐letter自組裝GACTZP納米序列。攜帶有阿霉素的適體‐納米序列組裝體,由于適體結合的可選擇性可將阿霉素直接導向適體靶向細胞,此納米組裝體可選擇性殺死培養中的肝癌細胞。同時,該組裝體不會殺死未與適體結合的未轉化細胞。綜上所述,這種由擴展的遺傳字母表構建的結構與藥物結合的抗體具有異曲同工之妙,藥物可能也是通過這個機制起作用,而其中的抗體則由適體所取代。
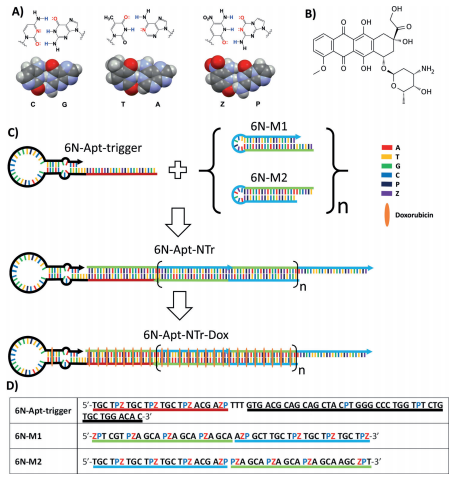
Liqin Zhang, Steven A. Benner, Weihong Tan, et al. An Aptamer‐Nanotrain Assembled from 6‐Letter DNA Delivers Doxorubicin Selectively to Liver Cancer Cells. Angew. Chem. Int. Edit., 2019.
https://doi.org/10.1002/anie.201909691
12. JACS:納米粒搭便車!兩步靶向實現腫瘤光熱協同免疫治療
實體瘤占人類癌癥的85%以上,對癌癥治療提出了巨大挑戰。缺氧、高壓、酸化和壞死的腫瘤內環境對腫瘤的生長和進展具有直接的影響。雖然腫瘤內納米藥物的積累結合免疫調節將顯著提高治療效果,但這種潛力受到壓縮環境和腫瘤體積明顯異質性的挑戰。
有鑒于此,湖南大學譚蔚泓院士、邱麗萍等人使用細胞衍生的凋亡小體(Abs)作為載體,并開發了兩步靶向平臺來實現納米藥物在腫瘤內的蓄積,旨在增強針對實體瘤的治療效果并應對腫瘤轉移和復發的挑戰。即將Toll樣受體9配體CpG結合到金銀納米棒AuNR表面(AuNR-CpG),在用AuNR-CpG給藥后,紫外線照射腫瘤細胞,收集AuNR-CpG/AB。在CpG免疫佐劑和原位光熱腫瘤消融腫瘤相關抗原共同刺激的基礎上,該平臺有望誘導一種有效且持久的腫瘤特異性免疫應答,有利于緩解免疫抑制,解決腫瘤治療的瓶頸:轉移和復發。此外,該系統無需涉及自體惡性細胞,為臨床實踐提供了一種簡便、通用、低風險的治療方案。
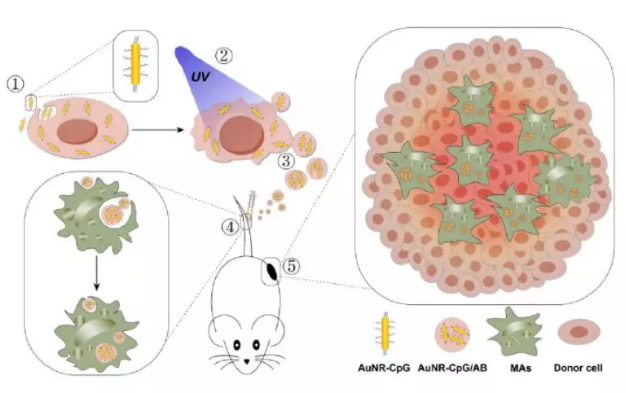
Liyan Zheng, XiaoXiao Hu, Hui Wu, et al. In vivo Monocyte/Macrophage-hitchhiked Intratumoral Accumula-tion of Nanomedicines for Enhanced Tumor Therapy. J. Am. Chem. Soc., 2019.
DOI: 10.1021/jacs.9b11046
https://doi.org/10.1021/jacs.9b11046
13. Angew:具有精確的藥物比例的適體-藥物偶聯物用于聯合靶向治療癌癥
聯合治療(藥物聯合治療(DCCT))是針對于腫瘤增殖相關的多種機制,能夠有效地提高治療效果,降低藥物劑量并有效解決腫瘤對單個藥物的耐藥性問題。然而,目前大多數的DCCT策略都不能精確地調整藥物比例并將其精確地遞送至腫瘤細胞內。
有鑒于此,湖南大學譚蔚泓院士、趙子龍和中科院化學所方曉紅團隊等人合作設計了一種二價適體-藥物偶聯物(cb- ApDCs)。cb- ApDCs不僅具有高的穩定性、可特異性識別、良好的細胞攝取和酯酶觸發釋放等優點,而且其中的藥物比例也可以被精確調整,從而在不需要復雜化學過程的情況下讓單個藥物具有更好的協同作用。
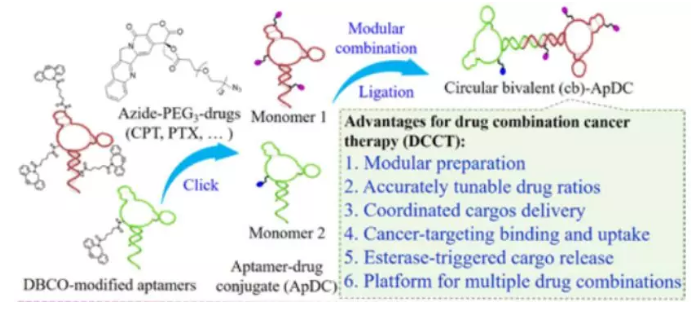
Fang Zhou, Peng Wang, Zilong Zhao, et al. Molecular Engineering-Based Aptamer-Drug Conjugates with Accurate Tunability of Drug Ratios for Drug Combination Cancer Targeted Therapy. Angew. Chem. Int. Edit., 2019.
DOI: 10.1002/anie.201903807
https://doi.org/10.1002/anie.201903807
Part 4. 人工細胞
14. JACS:模擬細胞適應性的人工信號反饋網絡
受精美的細胞適應性系統的啟發,湖南大學譚蔚泓院士、劉巧玲等人在此報告一個動態人工自適應系統的合理設計,該系統能夠感知并以獨特的方式響應環境壓力。利用DNA納米技術,構建了一個人工信號反饋網絡,并將其錨定在一個模型巨膜囊泡(GMV)原生質細胞的表面膜上。這樣一個系統需要同時感知傳入的刺激并發出反饋反應來消除刺激。
為了實現這一機制,基于DNA的人工信號系統(以下稱為DASsys)配備了一個DNA觸發誘導DNA聚合物的形成和解離裝置。因此,通過一系列刺激誘導的DNA鏈位移,DASsys可以有效地感知和響應傳入的刺激。然后,通過消除刺激,膜表面會回到初始狀態,實現周期性反饋機制的形成。總的來說,該策略為構建能夠維持細胞內微環境穩態的人工信號系統開辟了一條道路,并有望解決生物工程中新出現的重要挑戰。
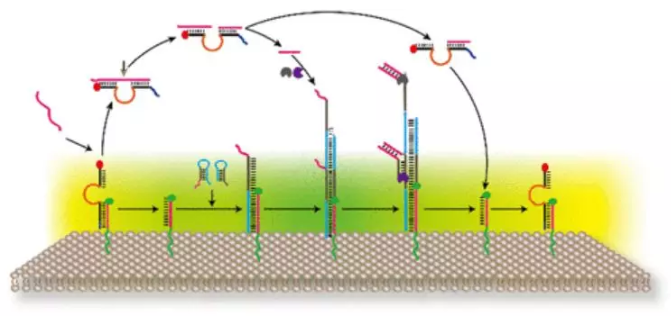
Hui Liu, Qiuxia Yang, Ruizi Peng, et al. Artificial Signal Feedback Network Mimicking Cellular Adaptivity, J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.8b13816
15. JACS: 仿生、大小可控、可自我降解的癌癥靶向DNA納米花
DNA納米花(DNA-NFs)作為潛在的納米載體在生物醫學領域的應用受到其生物利用度和治療效果的限制。有鑒于此,湖南大學譚蔚泓院士、張曉兵等人報道了在DNA鏈中加入含金屬的人工類似物來控制NFs的大小和功能,通過與人工三明治基底結合,設計出仿生、大小可控、可自我降解的癌癥靶向DNA納米花(Sgc8-NFs-Fc)。
更具體地說,二茂鐵基的引入不僅使Sgc8-NFs-Fc在1000-50nm范圍內具有尺寸可控性,而且通過Fenton反應使Sgc8-NFs-Fc在H2O2存在下具有自降解性。體外實驗證實,Sgc8-NFs-Fc/Dox可以選擇性地被蛋白酪氨酸激酶7(PTK7)陽性癌細胞吸收,隨后通過Fenton反應裂解,導致其迅速釋放藥物,并在核積累,增強其細胞毒性。體內實驗進一步證明了Sgc8-NFs-Fc具有良好的腫瘤靶向性,能顯著提高阿霉素在異種移植瘤模型中的治療效果。Sgc8-NFs-Fc納米載體以其可調的尺寸和在H2O2刺激下的按需釋藥動力學,在藥物遞送方面具有廣闊的應用前景。
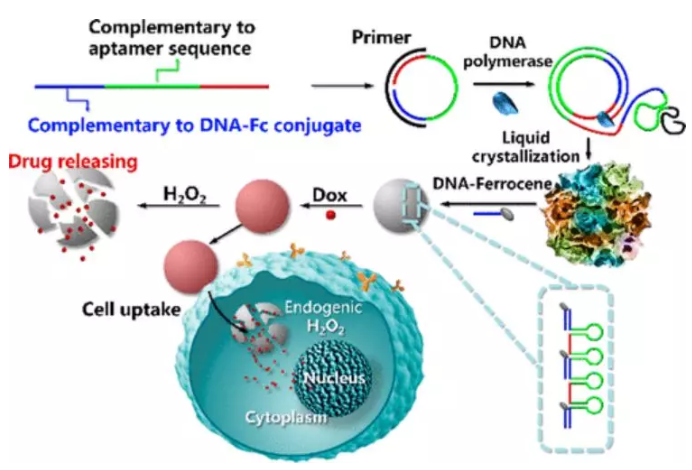
Lili Zhang, Razack Abdullah, Xiaoxiao Hu, et al. Engineering of Bioinspired, Size-Controllable, Self-Degradable Cancer-Targeting DNA Nanoflowers via the Incorporation of an Artificial Sandwich Base, J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.8b10795
Part 5. 其它
16. Science展望:水凝膠智能材料實現可編程的CRISPR響應
美國麻省理工學院James J. Collins等人在Science發表文章,報道了一種CRISPR (clustered regularlyinterspaced short palindromic repeats) 關聯核酸酶控制的DNA水凝膠,該水凝膠的功能可根據用戶自定義的目標核酸序列進行調整。這類刺激響應材料可用于小分子的可控釋放、電子設備的控制以及與微流體設備結合實現病毒的檢測。譚蔚泓院士等人應邀在Science對此進行點評和展望。
刺激響應水凝膠材料能夠對溫度、光線、電磁場或pH值變化響應,以用作藥物控制釋放、響應性涂料、形狀記憶材料以及分析傳感平臺,在法醫分析、醫學診斷和環境監測等多個領域備受關注。基于DNA的水凝膠具有穩定性、靈活性、精確的可編程性、刺激響應性等優點。但是,交聯聚合物必須通過刺激來調控驅動,通常是通過DNA置換反應、適配體靶向結合或酶催化。James J. Collins等人創造性地將CRISPR-Cas (CRISPR-associated)系統整合到DNA水凝膠中,提高了反應靈敏度。具體來說,CRISPR-Cas12a技術包含一個目標DNA效應物核酸酶Cas12a以及互補的向導RNA (gRNA)間隔序列。在該系統中,堿基配對成功能夠激活Cas12a核酸酶,進而切割目標雙鏈DNA(dsDNA)或任意單鏈DNA(ssDNA)。通過在水凝膠系統內部構建Cas12a-gRNA和目標dsDNA匹配對,可以獲得一個智能、通用、多功能、靈敏的水凝膠系統。

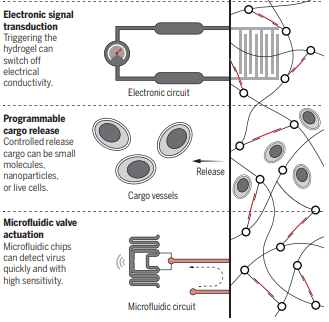
Da Han, Juan Li, Weihong Tan. CRISPR propels a smart hydrogel. Science.2019
DOI: 10.1126/science.aay4198
https://science.sciencemag.org/content/365/6455/754
17. Chem: 金屬交聯DNA膠束的球形定向合成及細胞內化增強
DNA膠束是由在末端帶有脂質殘基的兩親性DNA單體疏水自組裝而成,在生物檢測和生物醫學應用方面顯示出巨大的潛力。然而,使單體組裝的疏水作用力反過來限制了DNA膠束的進一步應用,因為這種相互作用力很容易被其他分子的疏水殘基打斷,并且總是受到臨界膠束濃度的限制。因此,尋找方便的膠束交聯方案以提高體系的穩定性成為人們研究的熱點。
有鑒于此,譚蔚泓院士等人介紹了一種簡便、通用的DNA膠束原位交聯方法--金屬離子球形定向還原法。通過在脂質-DNA單體中加入一系列特定的模板結構域,可以形成銅、銀和金交聯的DNA膠束。通過將表征結果與模擬算法相結合,首次實現了DNA膠束結構的精確分析。所制備的金屬交聯DNA膠束具有核結構和配體冠一步形成、尺寸可調、單分散性好、抗鹽誘導聚集穩定性好、DNA配體利用率高、合成條件溫和、耗時少、內化效果好等明顯優點。在球形定向合成的基礎上,通過整合適體-toehold策略,進一步制備了金屬交聯的DNA膠束耀斑,用于有效的細胞內成像。此外,將該策略擴展到基于膽固醇的雙鏈DNA膠束,有力地證明了該方法不僅是通用的,而且是靈活的。
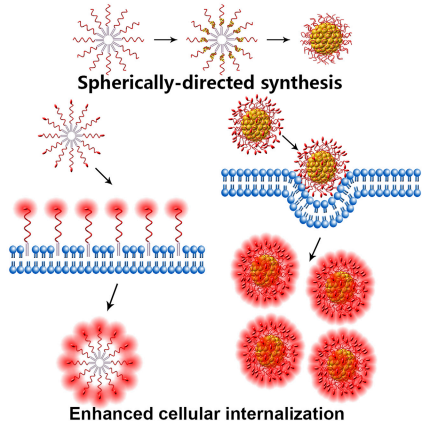
Yifan Lyu, Yian Guo, Ren Cai, et al. Spherically Directed Synthesis and Enhanced Cellular Internalization of Metal-Crosslinked DNA Micelles, Chem, 2019.
https://doi.org/10.1016/j.chempr.2019.02.004
18. JACS:奧斯特瓦爾德熟化介導合成均勻可控的MXF
MXF是一種包含兩種以上組分的金屬有機骨架(MOF),如具有精確結構的無機納米顆粒@MOF材料(NP@MOF),其在催化、能源和生物化學等領域具有重要的應用價值。然而,人們對于MXF的生長機制仍然不夠了解,這也大大阻礙了對納米級MXF配合物進行可控設計的研究。
有鑒于此,湖南大學譚蔚泓院士等人報告了一種利用奧斯特瓦爾德熟化介導的將MOF通過異相成核嫁接到單個多齒狀無機膠體納米晶上以制備MXF的方法。該過程依賴于在膠體納米晶表面的羧酸基團。實驗結果證明利用這一方法可以獲得均勻的MXF,其中的NPs尺寸范圍很廣,并且MOF層的厚度也是可控的。研究由此制備了UCNP@ZrMOF并證明其可以實現近紅外光激發誘導的單態氧生成。這一工作提出的嫁接策略為MXF的可控設計提供了新的思路,為開發先進功能材料大有幫助。
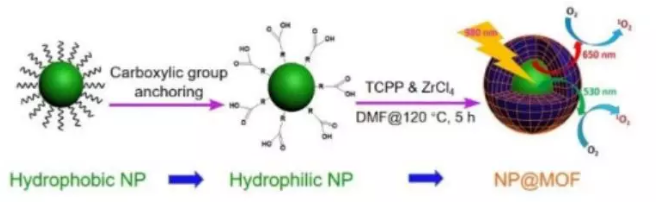
Yuan Liu, Yu Yang, Yujia Sun, et al. Ostwald ripening-mediated grafting of metal-organic frameworks on a single colloidal nanocrystal to form uniform and controllable MXF, J. Am. Chem. Soc., 2019.
DOI: 10.1021/jacs.9b01563
https://doi.org/10.1021/jacs.9b01563
19.JACS:納米粒子自組裝制備二維準納米片
二維(2D)納米材料由于其獨特的性質和廣闊的應用前景,正引起越來越多的研究興趣。有鑒于此,湖南大學譚蔚泓院士、陳卓等人報告了一種簡單的方法控制納米粒子(NPs)的組裝來制造獨立的2 D準納米片。生成的2D產品由幾層NPs組成,也就是說,它們的厚度只有幾十納米,但是橫向尺寸可以達到幾微米。因此,這種新結構被稱為2D “準納米片(QNS)”。
具體地說,幾種類型的構建塊可以通過一個通用的過程組裝成2D一元、二元、三元甚至四元QNS。整個組裝過程是在溶液中進行的,只需調節NPs周圍配體的濃度即可。與傳統的組裝技術相比,即使沒有任何基質或模板,這些QNS顯示出極高的穩定性。無論溶劑環境(如水、乙醇、甲醇和正己烷)如何,它們都可以在幾天內保持完好而不發生任何分解。總的來說,該方法有效地克服了傳統組裝技術的一些局限性,并且允許更多的自由控制NPs的組裝,這可能對未來具有豐富功能的2D器件的制造來說具有很大的潛力。
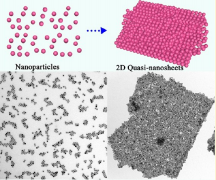
Ren Cai, Dan Yang, Keng-Te Lin, et al. Generalized Preparation of Two-Dimensional Quasi-nanosheets via Self-assembly of Nanoparticles, J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.8b12415
除此之外,譚蔚泓院士課題組2019年還發表了一系列重要成果,由于內容較多,在此不一一列出,感興趣的讀者可以前往譚蔚泓院士課題組網站瀏覽學習。
課題組網站:http://www.tanhnugroup.com
譚蔚泓院士簡介

譚蔚泓教授,現任湖南大學副校長、化學生物傳感與計量學國家重點實驗室(湖南大學)主任,湖南大學化學化工學院、生物學院教授,兼任美國佛羅里達大學杰出教授和冠名主任教授,上海交通大學分子醫學研究院院長。
2000年擔任佛羅里達大學納米生物研究中心副主任;2001年被聘為長江學者獎勵計劃特聘教授;2005年創立湖南大學生物醫學工程中心;2010年至2015年擔任湖南大學生物學院創院院長;2015年當選中國科學院院士;2016年當選為發展中國家科學院院士;2017年就任湖南大學副校長。
(注:文中人物簡介文字及圖片均來源于網絡)











