John A. Rogers院士的研究興趣包括納米/分子級制造基礎和應用,以及用于特殊電子和光子器件的材料和圖案化技術,重點是生物集成和仿生系統。具體的課題方向包括:1. 生物集成微系統(電子、光電、微流控、微機電);2. 特殊構造的電子器件(大面積、柔性、可拉伸);3. 光流控、液晶、表面等離子體光子學、超材料、光子晶體;4. 特殊納米制造技術;5. 光伏、固態照明、信息顯示;6. 微結構聲學和皮秒超聲學。

圖丨John A. Rogers院士
課題組網站顯示,2019年,John A. Rogers院士發表約50篇論文(其中絕大多數為通訊作者論文),通訊作者論文包括2篇Nature,6篇Nature子刊,6篇Science子刊,3篇PNAS。
由于相關論文數量較多,本文只總結了John A. Rogers院士團隊2019年的部分代表性研究成果,供大家交流學習。其他未涉及到的論文,建議大家前往課題組網站查看(提供免費下載)。另外:
1) 本文僅限于JohnA. Rogers作為通訊作者的論文(不包括序言、短篇評述等),以online時間為準。
2)由于學術水平有限,所選文章及其表述如有不當,敬請批評指正。
以下篇幅分為3個方面展開:
Part Ⅰ 可穿戴生物集成系統
Part Ⅱ 植入式生物集成系統
Part Ⅲ 特殊納米制造技術/特殊結構電子器件
Part Ⅰ 可穿戴生物集成系統
1. 首次實現將復雜的觸摸感融合到VR和AR中丨Nature
VR/AR的一個重要未來在于發展一種全面的、身臨其境的體驗,這種體驗不僅包括交互式圖像和聲音,還包括觸摸感。具有這類多感官能力的技術將產生深遠的影響,涉及領域從社交媒體和通信到游戲和娛樂,再到臨床醫學、康復和恢復。
皮膚是人體最大的器官,機械感受器分布在皮膚和真皮層內,構成我們與世界物理交互作用的基礎。具體來說,對皮膚上力的時空模式的響應會作為信號傳遞到大腦,這些信號定義了我們對周圍環境的機械感覺。然而,由感覺受體檢測到的刺激被編碼成電信號,該信號沿著神經通路移動到大腦的特定部位,然后被解碼成有用的信息。整個過程非常復雜。例如,觸摸感是包括壓力、疼痛和溫度在內的多種感覺的集合,且觸覺感受器更由機械、化學和熱能的組合所刺激。 然而,到目前為止,將觸摸感融合到VR和AR中一直是一個巨大的挑戰。
有鑒于此,美國西北大學黃永剛院士和John A·Rogers院士等人首次實現將復雜的觸摸感融合到VR和AR中。他們發展了一種無線,無電池的電子系統平臺和觸覺界面,能夠輕柔地層壓在皮膚的曲面上,以通過時空可編程的局部機械振動模式來傳遞信息。觸覺致動器通過無線供電和控制,以及能壓層貼合任何類型皮膚,使其具有低耗能和安全便捷性。研究團隊詳細描述了用作此類平臺基礎所使用的材料,設備結構,功率傳輸策略和通信方案。由此產生的技術創造了許多使用機會,如通過在社交媒體和個人參與、假肢控制和反饋、游戲和娛樂中的應用,皮膚向身體提供電子可編程通信和感官輸入通道。
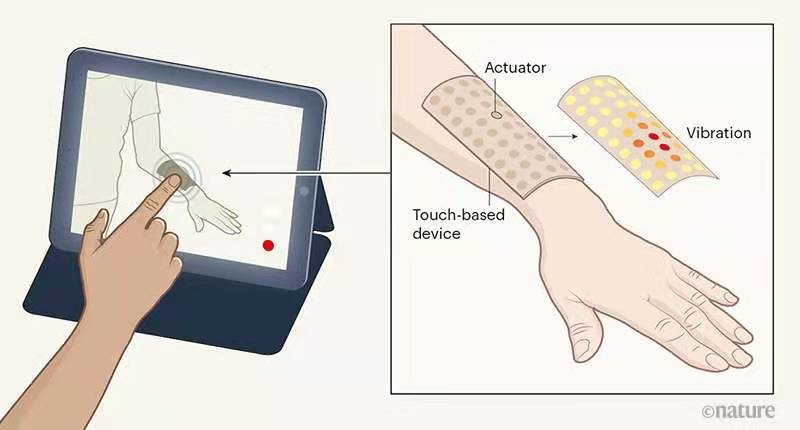
Yu, X., Xie, Z., Yu,Y. et al. Skin-integrated wireless haptic interfaces for virtual andaugmented reality. Nature 2019,575, 473–479.
https://www.nature.com/articles/s41586-019-1687-0
詳細解讀參考:
《Nature:黃永剛/Rogers為可穿戴智能器件帶來里程碑進展!》
2. 柔性可穿戴無線生物電子器件丨Nature Biomed.Eng.
裝有高帶寬三軸加速度計的安裝在皮膚上的柔性電子設備可以捕獲廣泛的生理相關信息,包括基礎身體過程的機械聲信號(例如用聽診器測量的信號)和核心身體運動的精確運動學。
在這里,美國西北大學黃永剛院士、John A. Rogers院士 、Zhaoqian Xie聯合Carle神經科學研究院Charles R. Davies等人設計了一種無線裝置,其被設計成能放置在胸骨上方的凹口上,用于連續測量機械聲信號,包括從皮膚在大約10-3 m s-2的加速度下的微弱振動到整個身體的大運動在大約10 m s-2的振動和高達800 Hz的頻率下。由于測量結果是由運動,身體朝向,吞咽,呼吸,心臟活動,聲帶振動和其他來源產生的一系列信號的復雜疊加,因此研究人員利用頻域分析和機器學習方法,從人類受試者的日常活動中獲取心率、呼吸頻率、能量強度和其他基本生命體征的實時記錄,以及說話時間和節奏、吞咽次數和模式和其他非常規生物標記。并且還在睡眠實驗室中使用了該設備,并使用多導睡眠監測儀對測量結果進行了驗證。
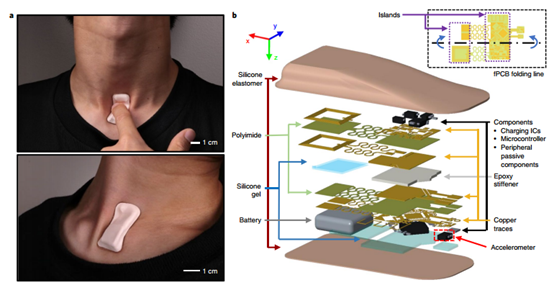
Lee, K., Ni, X., Lee,J.Y. et al. Mechano-acoustic sensing of physiological processesand body motionsvia a soft wireless device placed at the suprasternal notch. Nat Biomed Eng(2019)
DOI:10.1038/s41551-019-0480-6
https://doi.org/10.1038/s41551-019-0480-6
3. 可穿戴無線設備自動監測人體電磁輻射丨Science Adv.
暴露于來自太陽和人工照明系統的電磁輻射(EMR)是一個可改變的危險因素,可導致多種健康狀況,包括皮膚癌、皮膚老化、睡眠和情緒障礙以及視網膜損傷。個體化電磁輻射劑量測定技術可以引導人們的生活方式朝著確保健康暴露水平的行為發展。
有鑒于此,美國西北大學John A. Rogers院士團隊報道了一個毫米級、超低功率數字劑量計平臺,該平臺在一個或多個波長的自主模式下同時提供連續EMR劑量的測量,并可通過無線遠程通信與標準消費設備進行時間管理。單個小型紐扣電池可支持多年的壽命,這是由具有積累模式的檢測與光適應的光能,結合超低功率電路設計而實現的。實地研究表明,這種類型的單模式和多模式劑量測定平臺的重點是監測來自室內照明和顯示系統的短波藍光以及來自太陽的紫外/可見/紅外輻射。
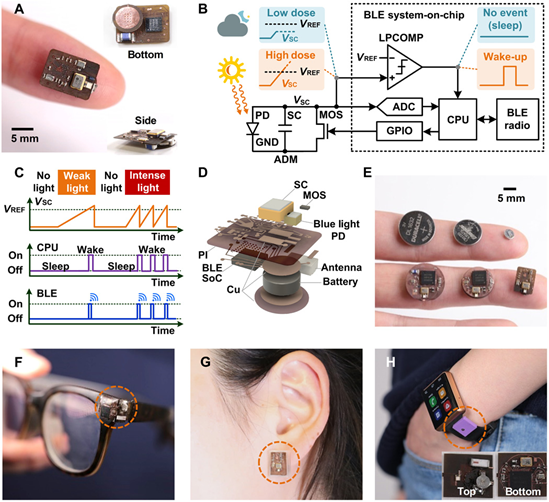
KwonK,Heo SY, Yoo I, Banks A, Chan M, Lee JY, et al. Miniaturized,light-adaptive,wireless dosimeters autonomously monitor exposure toelectromagnetic radiation.Science Advances. 2019;5(12):eaay2462.
DOI:10.1126/sciadv.aay2462
https://advances.sciencemag.org/content/5/12/eaay2462
4. 用于同時進行汗液的電化學/比色/容量分析的無源皮膚接口式微流控/電子系統丨Science Adv.
可穿戴汗液傳感器的核心是用于電化學檢測的電子器件或用于視覺讀出的比色分析裝置。前者的缺點主要是形狀因子不理想,后者的缺點在于只能進行半定量分析,適用的生物標記物也不多。有鑒于此,美國西北大學John A. Rogers團隊借鑒生物燃料電池,設計了一種無源無線式電子傳感平臺,將比色分析內嵌于計時微流控平臺。所得傳感器將電子和微流控功能的優點綜合在一個明顯更輕、更廉價、更小的平臺上。所得裝置能同時檢測出汗率,汗液流失,pH,乳酸鹽,葡萄糖和氯化物。作者從電子學、微流體學、集成方案三個方面系統分析,建立了核心設計要點,以及性能屬性。進一步地,作者進行了兩天的人體試驗,將汗液和血液中的葡萄糖、乳酸鹽濃度進行比較,結果表明該裝置有應用于無創半定量檢測生理狀態的潛力。
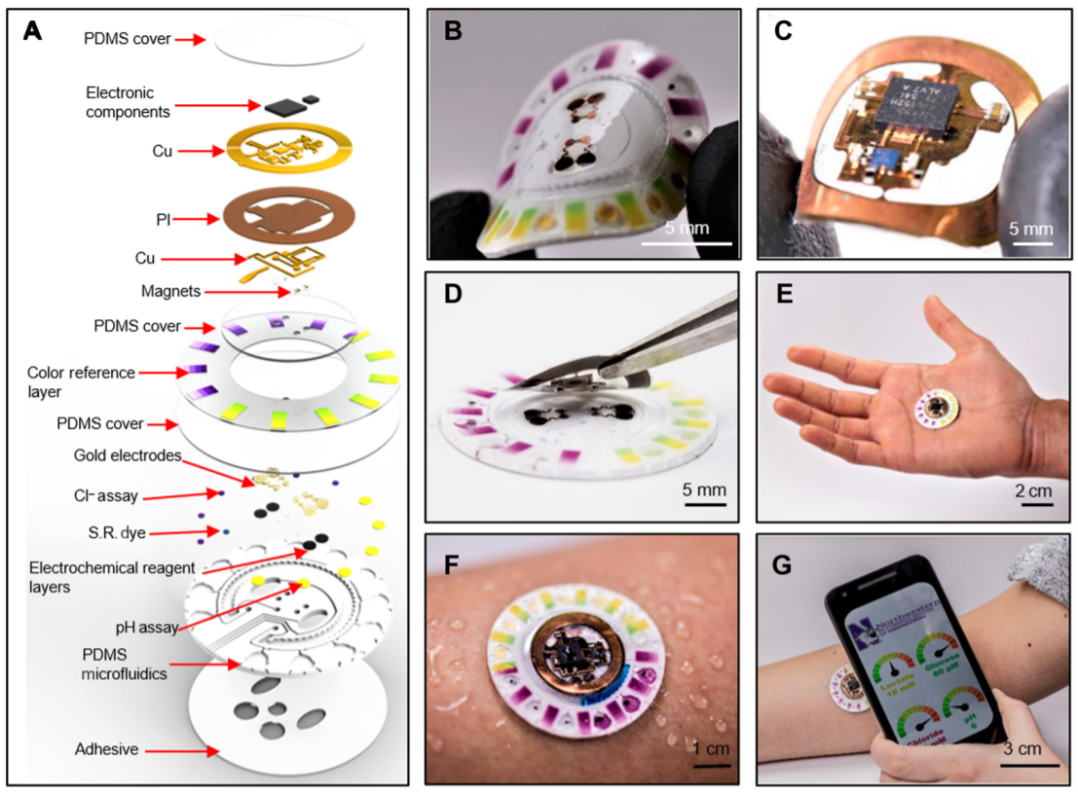
Bandodkar, Amay J., et al. "Battery-free, skin-interfacedmicrofluidic/electronic systems for simultaneous electrochemical, colorimetric,and volumetric analysis of sweat." Science advances 5.1 (2019): eaav3294.
https://advances.sciencemag.org/content/5/1/eaav3294
5. 用于水環境中汗液收集、標志物分析、溫度記錄的防水表皮微流控電子裝置丨Science Adv.
通過分析汗液的生化信息,研究人員能實現對生理狀態的無創式原位監測,發展出新的保健診斷形式和個性化的補水策略。收集汗液和傳感技術的進步帶來了強大的功能,但這些并不適用于極端情況下,比如液體環境或干燥環境,因為尚存以下難題:1. 消除來自周圍水的污染/干擾;2. 在粘滯力和/或劇烈運動下保持強穩粘附;3. 阻止所收集汗液的蒸發。有鑒于此,美國西北大學John A. Rogers團隊從材料和設計出發,研發了一種粘附于皮膚,具有收集、儲存和分析汗液功能,即使在水下環境也能工作的防水表皮微流控電子系統。應用測試表明,這類裝置能在高強度體育活動條件下(包括可控室內條件和開放海域游泳)原位定量測試局部汗液氯化物濃度,局部汗液流失和出汗率,以及皮膚溫度。
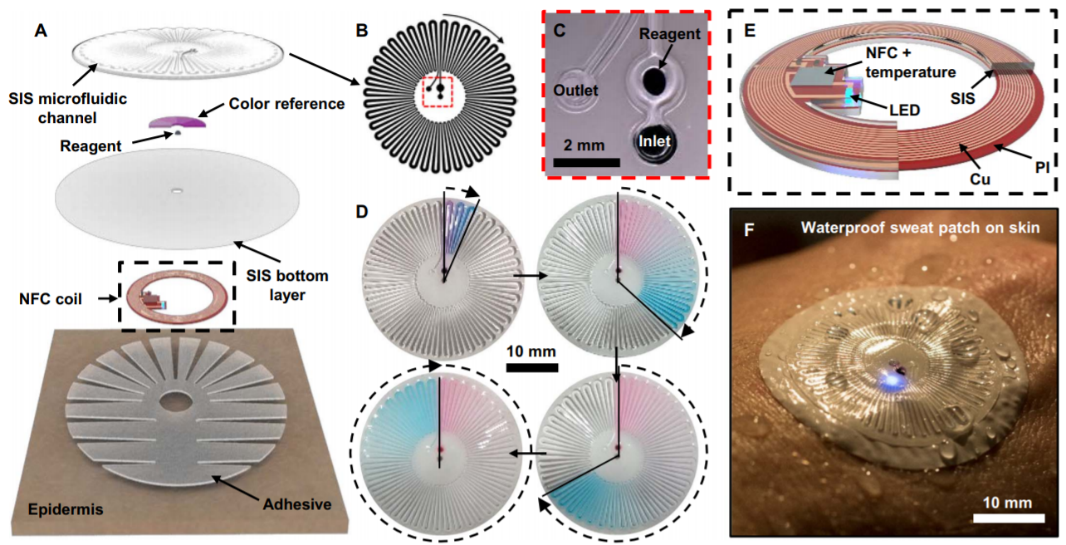
Reeder, Jonathan T., et al. "Waterproof, electronics-enabled,epidermal microfluidic devices for sweat collection, biomarker analysis, andthermography in aquatic settings." Science advances 5.1 (2019): eaau6356.
https://advances.sciencemag.org/content/5/1/eaau6356
6. 具有化學感知補水反饋的可歸零式皮膚界面微流控集汗裝置丨Nature Commun.
最近所報道的薄軟皮膚穿戴式微流體系統具有連續實時監測整體汗液流失、出汗率以及汗液生物標記物的強大功能。雖然該裝置能在沒有有源組件或電源的情況下工作,從而避免了后者額外的成本、復雜性、體積和重量,但人體補水活動(如下圖所示)可導致之前的測量結果不再適用,且異常生理活動(如過高汗液流失)的檢測需要用戶主動觀測比色結果。有鑒于此,美國西北大學John A. Rogers團隊通過多方面舉措解決了這些限制:1. 由管夾閥和抽吸泵組成的一體化完整系統,用于與補水活動相對應的汗液凈化(歸零機制);2.微結構光學用于汗液流失的可逆讀出;3.冒泡性泵片和化學刺激物質用于自動傳遞汗液過度流失的信號。人體試驗表明,這類系統能通過汗液觸發薄荷腦和辣椒素排出從而使人體皮膚產生感覺,提醒用戶防止脫水。
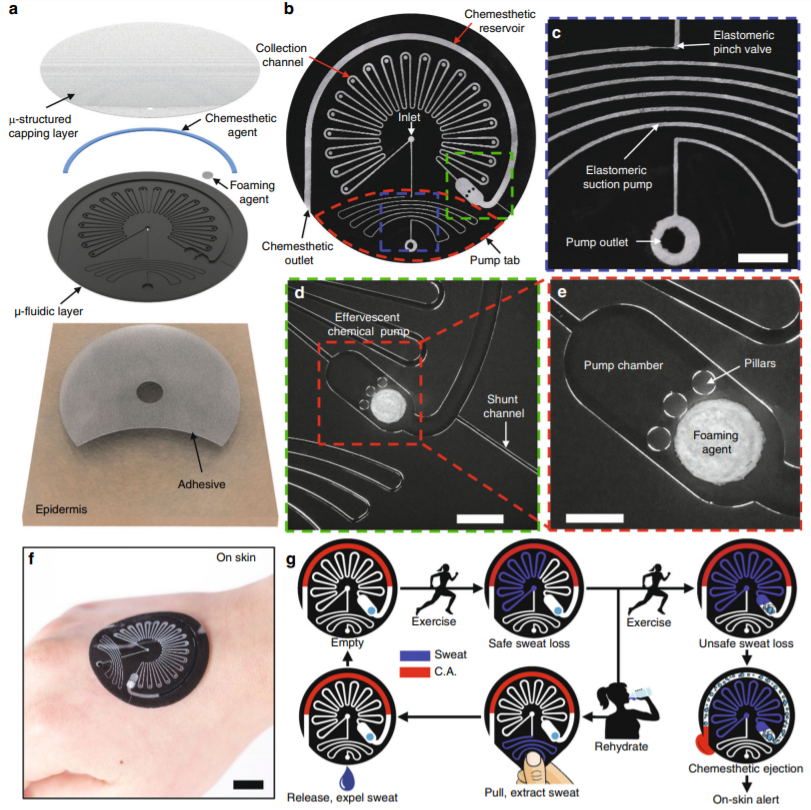
Reeder, J.T., Xue, Y., Franklin, D. et al. Resettable skin interfacedmicrofluidic sweat collection devices with chemesthetic hydration feedback. NatCommun 10, 5513 (2019) doi:10.1038/s41467-019-13431-8
https://www.nature.com/articles/s41467-019-13431-8
7. 可穿戴生物集成系統的全面回顧丨Chem. Rev.
可穿戴生物集成系統能測量許多生物物理、生物化學和環境信號,為整體健康狀態提供重要見解,并量化人體(運動)表現。材料科學、化學分析技術、器件設計、組裝方法的最新進展為新型可穿戴技術打下了基礎,使之能與人體時時刻刻變化的柔性曲面皮膚形成良好的無創接觸。
在此背景下,美國西北大學John A. Rogers課題組全面總結了生物集成技術這個新興領域的最新進展,將化學、材料科學、工程領域的進展與有望在保健領域廣泛使用并產生社會效益的傳感技術有機結合起來。作者首先介紹了與有源組件相關的化學與材料知識,特別是針對傳感器和下文出現的相關裝置平臺的基本設計要素;隨后突出闡述了最先進的生物傳感器,此部分根據傳感器捕獲生物物理、生物化學和環境信息的能力進行了分類;接下來總結了傳感器的供電方案和實現全集成式無線系統的策略;最后,概括了該領域尚存的主要挑戰,并總結了從材料化學角度取得進展的機會。
Ray, Tyler R., et al. "Bio-integrated wearable systems: acomprehensive review." Chemical reviews (2019).
https://pubs.acs.org/doi/10.1021/acs.chemrev.8b00573
Part Ⅱ 植入式生物集成系統
8. 用于光遺傳學調節末梢神經的無線閉環系統丨Nature
快速發展的生物電子醫學領域旨在設計出通過刺激末梢神經系統從而緩解臨床癥狀的裝置系統。這類技術很大程度上依賴于電流刺激來提供器官功能/疼痛的神經調節。一個典型的例子是骶神經電刺激——用于治療膀胱過動癥,尿失禁以及間質性膀胱炎(也稱膀胱疼痛綜合征)。傳統的連續刺激方法可能導致不舒適和疼痛感,特別是治療間歇性癥狀時(例如突發性尿急)。將電極直接物理連接到神經上可能會導致患者受傷和產生炎癥。此外,典型刺激手段瞄準了較大的神經束,而神經束由多重結構組成,因此這些刺激不具有器官特異性。
有鑒于此,華盛頓大學圣路易斯分校Robert W. Gereau IV和美國西北大學John A. Rogers等人設計了一種微型生物光電植入裝置,該裝置通過以下手段避免了上述問題:1. 利用微米尺度無機發光二極管來刺激視蛋白的光刺激界面;2. 允許連續測量器官功能的柔性高精度生物物理傳感器系統;3. 能使系統協調閉環運行,實時消除病理行為的控制模組和數據分析方法。在本文所報道的例子中,柔性應變儀可對小鼠膀胱功能進行實時監測;數據算法可以識別出病理行為,自動化閉環光遺傳學可對膀胱感覺傳入進行神經調節,使膀胱功能正常化。這種全光神經調節方案提供了長期穩定性和刺激特定類型細胞的潛力。
Mickle, A.D., Won, S.M., Noh, K.N. et al. A wireless closed-loop systemfor optogenetic peripheral neuromodulation. Nature 565, 361–365 (2019)doi:10.1038/s41586-018-0823-6
https://www.nature.com/articles/s41586-018-0823-6
9. 用于光譜表征生理狀態和神經活動的生物可吸收光子裝置丨Nature Biomed. Eng.
實時監測體內生理過程有助于給藥時刻表設定,外科手術過程規劃,以及康復管理。現有方法依賴于體外成像技術或植入傳感器,這些方法不能在臨床相關時間尺度上提供連續信息,并且/或需要昂貴且高風險的手術過程。有鑒于此,美國西北大學John A. Rogers團隊設計了一類基于人體可吸收可清理材料的注射式光子裝置,用于光譜表征目標組織和體液。作為范例,作者演示了該裝置可用來連續監測自由移動小鼠的大腦溫度,氧化作用和神經活動。作者認為,這類裝置在疾病病理學基礎、神經科學研究、手術治療以及恢復過程監測中會發揮作用。
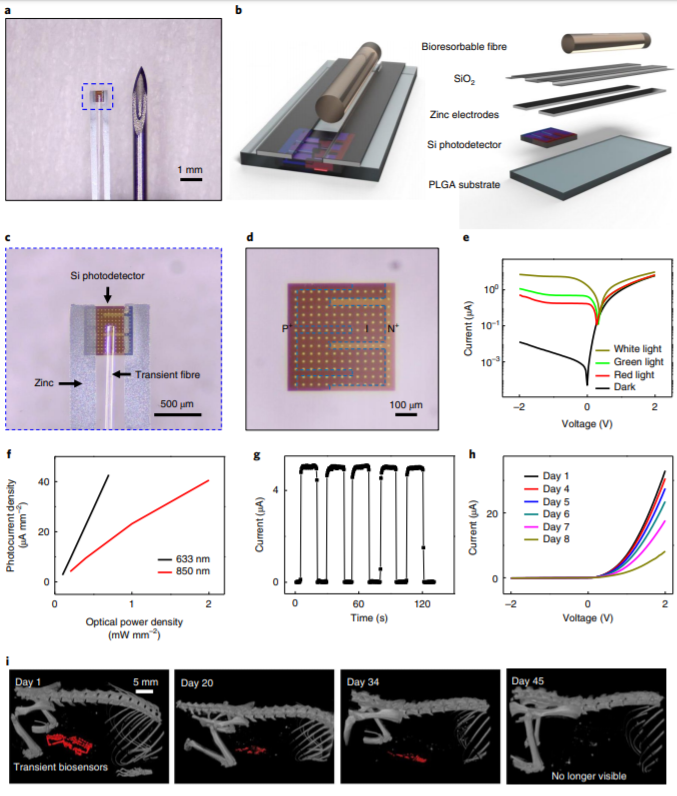
Bai, W., Shin, J., Fu, R. et al. Bioresorbable photonic devices for thespectroscopic characterization of physiological status and neural activity. NatBiomed Eng 3, 644–654 (2019) doi:10.1038/s41551-019-0435-y
https://www.nature.com/articles/s41551-019-0435-y
10. 用于體內光遺傳學/藥物學治療的輕質無源無線注射式微系統丨PNAS
利用光遺傳學的神經科學研究極大提高了人們對腦回路的認知。相比之下,基于光遺傳學和藥物學的神經化學信號探測則較為滯后,因為傳統的插管方法存在不便之處,且光流控裝置的大規模可靠制造、供電、控制是有難度的。有鑒于此,美國西北大學John A. Rogers、華盛頓大學西雅圖分校Michael R.Bruchas、亞利桑那大學Philipp Gutruf等團隊合作,設計了一種無源無線輕質的光流控裝置,該裝置注入速率可調,電源供應無限,不需手動操作,且與現有的近場通信(NFC)技術兼容。實踐證明該裝置不僅可以進行體內光遺傳學和藥物學實驗,而且相比現有的類似平臺,賦予了小型動物模型更大的移動自由度。

Zhang, Yi, et al. "Battery-free, lightweight, injectablemicrosystem for in vivo wireless pharmacology and optogenetics." Proceedingsof the National Academy of Sciences 116.43 (2019): 21427-21437.
https://www.pnas.org/content/116/43/21427
11. 光/藥調節末梢神經的無線無源全植入式光流控卡夫系統丨Science Adv.
對末梢神經系統的研究需要用到藥理學或光遺傳學技術,以此來實現對神經功能的可控操縱。用于實現這些目的的傳統硬件可能導致對神經組織的明顯損傷,在生命/非生命界面處產生刺激,并改變動物的自然行為。有鑒于此,美國西北大學John A. Rogers和華盛頓大學圣路易斯分校Robert W. Gereau IV等人將微米級無機發光二極管和具有電化學泵機制的超低功率微流控系統集成于同一個柔性無線無源式裝置,這種裝置可安裝于自由移動動物的目標末梢神經,用于程控的光/藥物遞送。生物兼容性設計使得該裝置對神經健康和功能的影響最小化,即使是在長時間體內使用的情況下。較小的體積和重量使得該裝置可完全植入于小鼠體內。作者認為,該裝置為研究末梢神經系統帶來了新的機會。
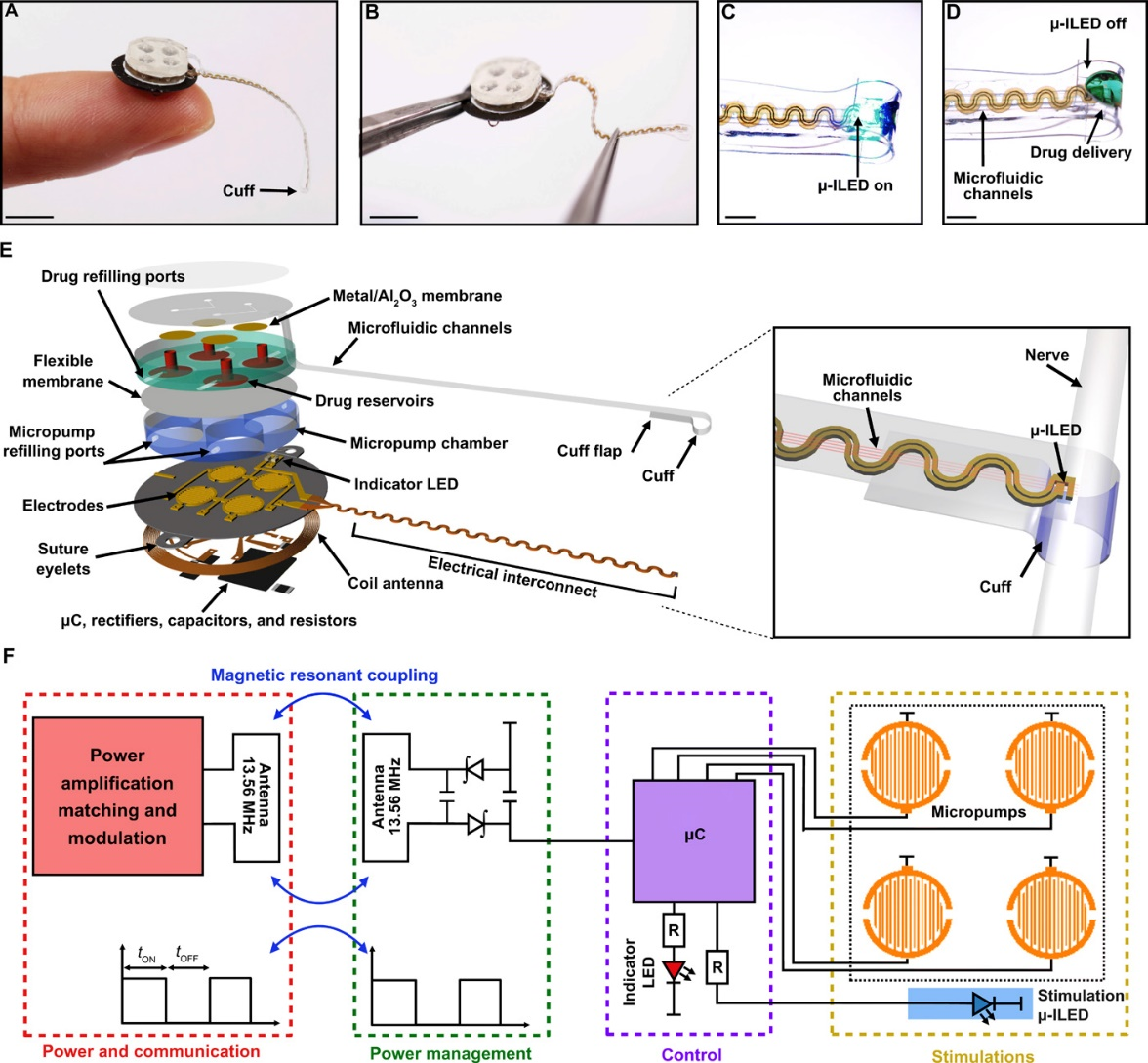
Zhang, Yi, et al. "Battery-free, fully implantable optofluidic cuffsystem for wireless optogenetic and pharmacological neuromodulation ofperipheral nerves." Science advances 5.7 (2019): eaaw5296.
https://advances.sciencemag.org/content/5/7/eaaw5296
12. 用于監測顱內壓力和溫度的生物可吸收光學傳感系統丨Science Adv.
連續測量顱內、眼內、血管內的壓力和溫度能為治療創傷性腦損傷、青光眼、心血管疾病分別提供重要的診斷信息。在這方面,光學傳感器與磁共振成像(MRI)之間的相容性較好,因此展現出應用潛力。現有的可植入光學組件采用的是永久性不可吸收的材料,因此在使用后必須經手術取出。若采用生物可吸收材料,則能避免手術帶來的成本和風險。
有鑒于此,德州大學阿靈頓分校Weidong Zhou和美國西北大學John A. Rogers團隊基于毫米級生物可吸收法布里-珀羅干涉儀(FP干涉儀)和二維光子晶體結構,實現了溫度和壓力的精確連續測量。力學和光學模擬揭示了基本的傳感機理。通過體外研究和組織病理學評估,作者得出了裝置的測量準確度,使用壽命,以及生物兼容性。體內實驗則建立了臨床相關的性能屬性。最后,作者認為,該研究所涉及的材料、裝置設計、制造方法能為各類可吸收光學傳感器提供廣泛的基礎功能。
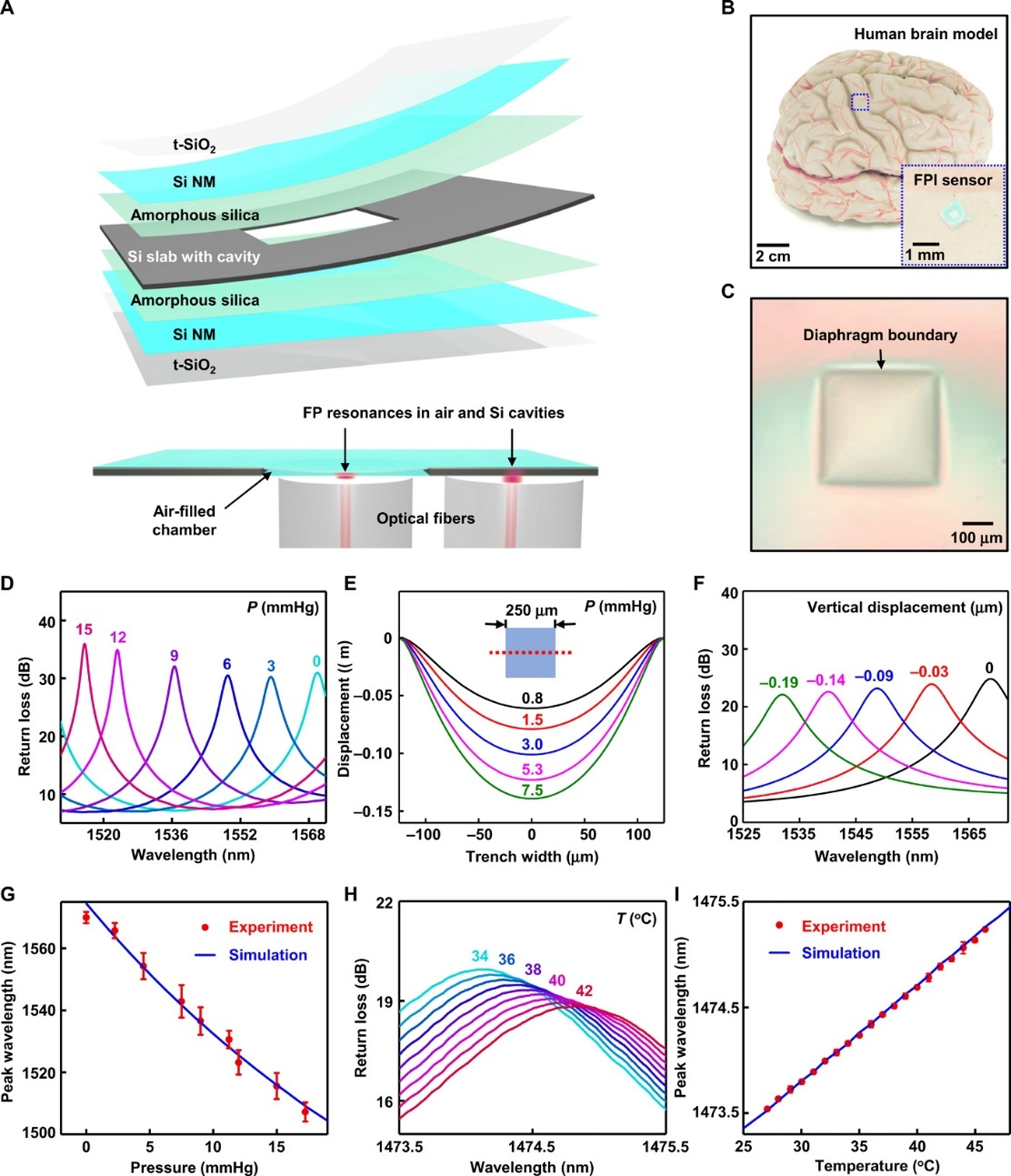
Shin, Jiho, et al. "Bioresorbable optical sensor systems formonitoring of intracranial pressure and temperature." Science advances 5.7(2019): eaaw1899.
https://advances.sciencemag.org/content/5/7/eaaw1899
13. 用于局部組織血氧測量的皮下植入式無線無源光電系統丨Science Adv.
監測動物模型/人體中的局部組織氧合有助于理解局部O2介導的生理過程并為相關疾病提供診治指導。現有的組織氧合評估技術存在一系列缺點,比如需要接線(需要接入O2電極,光纖等)、麻醉劑、特殊裝置等,因此經常會給測試對象的自然行為帶來干擾。有鑒于此,美國西北大學John A. Rogers團隊設計了一種全無線全植入式平臺,該平臺結合了(1)用于連續感測局部血紅蛋白動力學的微米級光電器件和(2)用于連續無線電源傳送和數據輸出的先進設計。這些特點使得該裝置能在動物清醒狀態下,不加束縛地對其特定組織區域進行血氧定量,例如小鼠大腦深處。作者認為,本文的結果為研究自然行為個體中各類O2介導的生理過程創造了大量機會,給生物醫學研究和臨床實踐帶來了啟示。
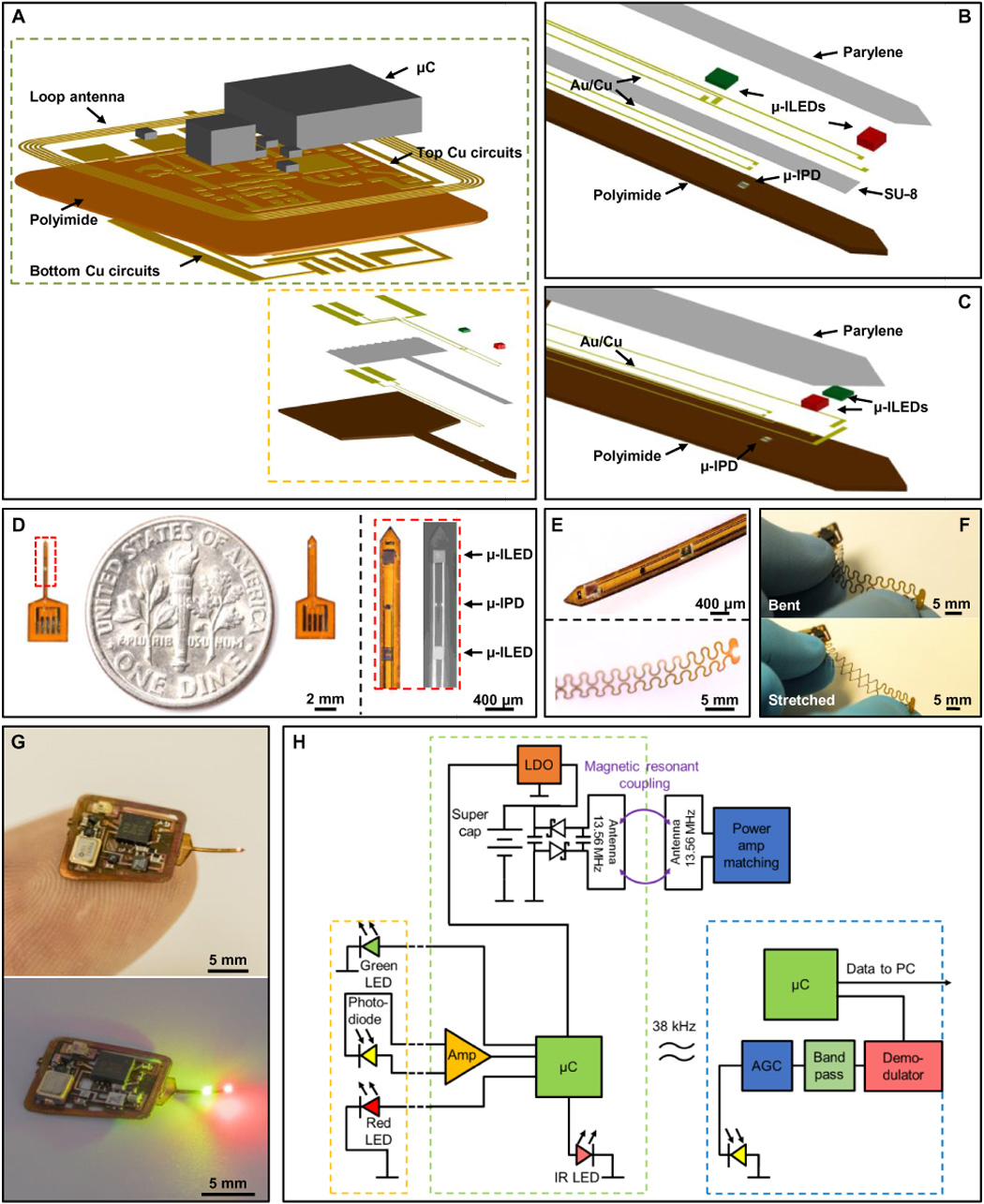
Zhang, Hao, et al. "Wireless, battery-free optoelectronic systemsas subdermal implants for local tissue oximetry." Science advances 5.3(2019): eaaw0873.
https://advances.sciencemag.org/content/5/3/eaaw0873
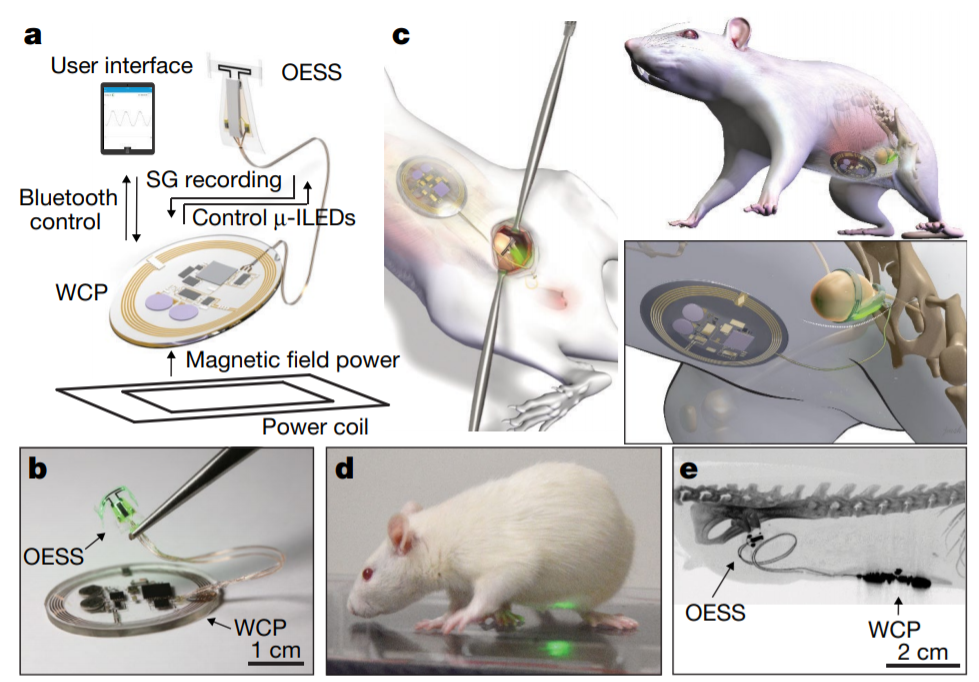
14. 小型動物無線起搏器用于生物醫學研究丨Nature Commun.
小型動物支持多種病理表型和基因型,它們是心血管疾病發病機理以及電療法,基因療法和光遺傳學策略探索的多功能,可負擔得起的模型。在這種情況下,起搏工具目前僅限于栓系,這限制動物行為和實驗設計。于此,美國喬治華盛頓大學Igor R. Efimov聯合美國西北大學Philipp Gutruf和John A. Rogers等人介紹了一種高度微型化的無線能量收集和數字通信電子產品,用于薄、微型起搏平臺,其重量僅為110 mg,可皮下植入,并能承受200,000多個多軸應變循環,而不會降低電學或光學性能。數日的體外和體內多模和多點起搏的研究表明,該平臺具有長期的穩定性和優良的生物相容性。通過動物控制和通過慢性起搏誘發心力衰竭來對心動周期進行光遺傳學刺激,可作為與基礎和應用心血管研究及生物醫學技術相關的操作模式的例子。

Gutruf, P., Yin, R.T., Lee, K.B. etal. Wireless, battery-free, fully implantable multimodaland multisite pacemakers for applications in small animal models. NatCommun 10, 5742 (2019)
doi:10.1038/s41467-019-13637-w
https://doi.org/10.1038/s41467-019-13637-w
Part Ⅲ 特殊納米制造技術/特殊結構電子器件
15. 用于振動能量收集,機器人傳感界面和生物醫學植入裝置的3D壓電高分子微系統丨Nature Electron.
壓電微系統在機械傳感、能源轉化和機器人等領域有重要作用。壓電微系統通常是平面結構,但將轉化為復雜的三維結構則可能提升并擴展其工作狀態。有鑒于此,美國西北大學John A. Rogers、黃永剛,清華大學Yihui Zhang等人采用一種可控的非線性屈曲過程,將光刻所得2D電極圖案以及壓電高分子薄膜轉化為復雜的3D壓電微系統。為證明此方法的普適性,作者給出了20個多不同的3D幾何結構。基于這些結構,作者實現了具有可調機械性質和均方根電壓(2-790mV)的能量捕捉裝置;應用于機器人假肢界面的具有更高響應性(例如,各向異性響應以及法向力下60mVN?1的靈敏度)的多功能傳感器;能在體內運行的生物一體化裝置。總之,這些3D幾何結構,特別是那些具有超低剛度或非對稱結構的,具有傳統2D設計難以實現甚至不能實現的獨特力學屬性和功能性。
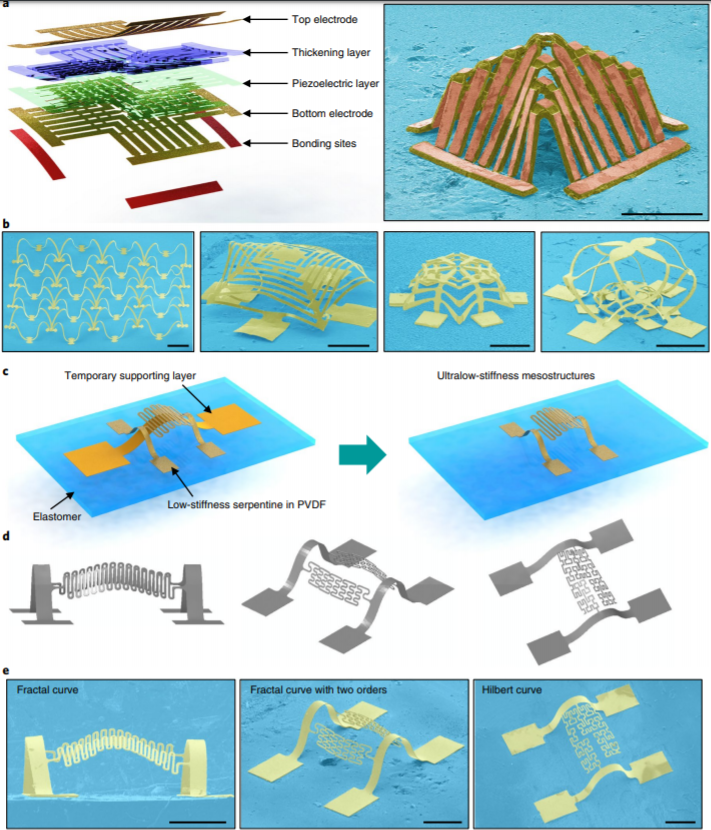
Han, M., Wang, H., Yang, Y. et al. Three-dimensional piezoelectricpolymer microsystems for vibrational energy harvesting, robotic interfaces andbiomedical implants. Nat Electron 2, 26–35 (2019) doi:10.1038/s41928-018-0189-7
https://www.nature.com/articles/s41928-018-0189-7
16. 用于假肢控制和認知監測的大面積MRI兼容式表皮電子界面丨Nature Biomed. Eng.
皮膚接口式醫療裝置在診斷疾病,監測生理健康以及建立與假肢、計算機系統、可穿戴機器人之間的可控界面等方面十分重要。類皮膚的表皮電子技術則為以上這些應用提供了支撐,其使用的柔性超薄材料能與皮膚形成舒適接觸面,且這個過程在力和熱方面都難以察覺。然而,目前已有方案中,這些裝置的整體大小都局限于幾個cm2以下。
有鑒于此,美國西北大學John A. Rogers團隊從材料、裝置結構、操作和安裝方法以及制造方法的角度進行改進,實現了比以往大幾個數量級的表皮電子界面。作為概念驗證,作者組裝了電生理學記錄裝置,該裝置能覆蓋整個頭皮區域,以及整周小臂。開放網絡設計中的絲狀傳導結構則使得無線電誘導的渦旋電流最小化,因此該裝置在結構和功能方面能與磁共振成像(MRI)更好地兼容。進一步地,作者將大面積表皮電子界面用于病人肱骨假肢的多功能控制,這些病人在長時間的腦電掃描,以及同步的腦電掃描-結構/功能性磁共振成像中進行過目標肌肉神經分布重建手術。
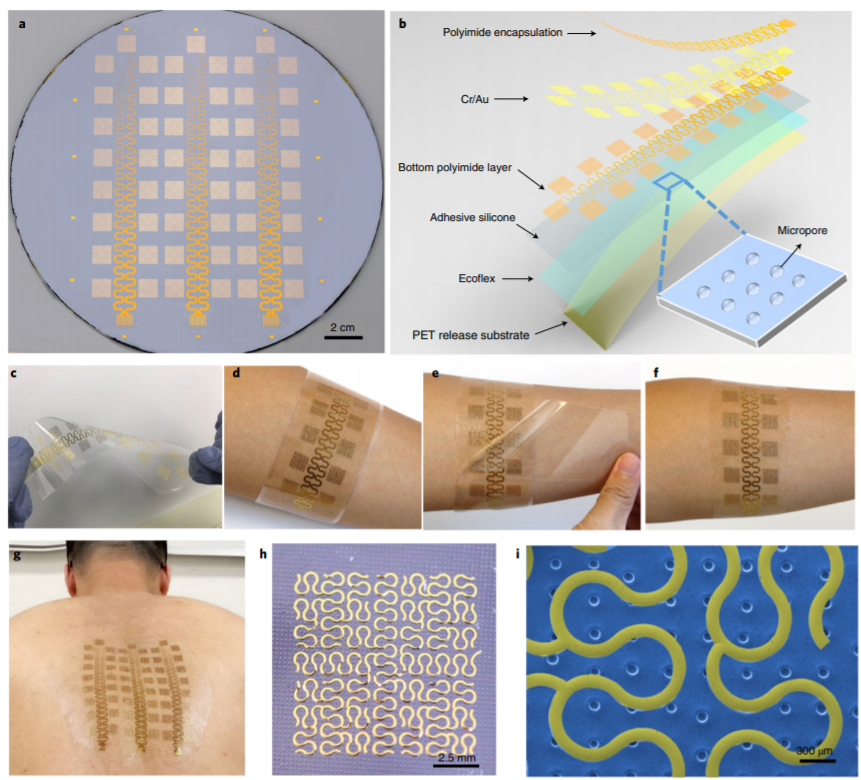
Tian, L., Zimmerman, B., Akhtar, A. et al. Large-area MRI-compatibleepidermal electronic interfaces for prosthetic control and cognitivemonitoring. Nat Biomed Eng 3, 194–205 (2019) doi:10.1038/s41551-019-0347-x
https://www.nature.com/articles/s41551-019-0347-x
17. 用于長期生物集成的大規模柔性電子/光電微系統丨PNAS
與人體軟組織界面接觸的新興柔性電子系統是生物電子醫藥的基礎。近日,美國西北大學John A. Rogers、Jan-Kai Chang等人將數萬個微型器件組裝成生物集成微系統——這些器件在與人腦接觸的薄層柔性高分子基底上相互連接而形成功能網絡。詳細的體外實驗表明,這些系統能提供復雜的電子和光電功能,在長達數十年的時間內穩定、安全地運作。該研究定義了在生物電子學領域具有廣泛應用的概念和技術方法。
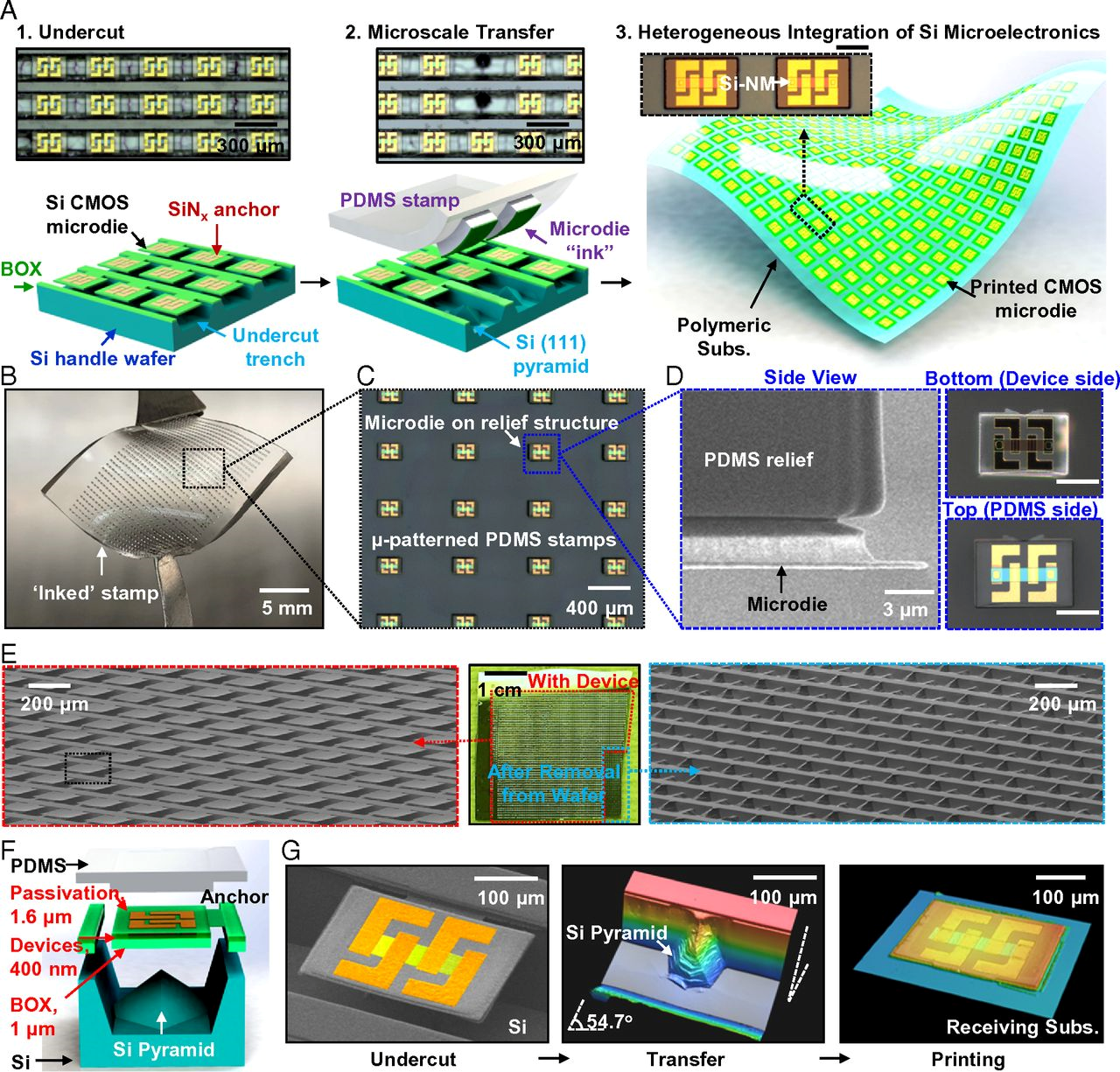
Song, Enming, et al. "Flexible electronic/optoelectronicmicrosystems with scalable designs for chronic biointegration."Proceedings of the National Academy of Sciences 116.31 (2019): 15398-15406.
https://www.pnas.org/content/116/31/15398
18. 屈曲和扭轉工藝實現基于先進材料的形變3D介觀結構丨PNAS
日漸普及的三維加工方法在各個應用領域產生了深遠影響,比如造船和微電子加工行業。其中,尺寸在微米和毫米級別的系統引起了研究人員特別的關注,但問題在于,目前幾乎沒有技術能兼顧這類三維介觀結構的產量、材料兼容性和可設計性。最近所報道的力學引導3D組裝法具有許多優點,但依舊存在一些局限,例如在形成手性結構和形變結構方面尚存不足。有鑒于此,美國西北大學John A. Rogers、黃永剛和清華大學Yihui Zhang等人在3D介觀結構制備中引入了一種可控的扭轉工藝。基于此,實驗實現了許多之前不可實現的3D結構,給出了基于不同材料、跨越不同長度尺度的~20個例子。
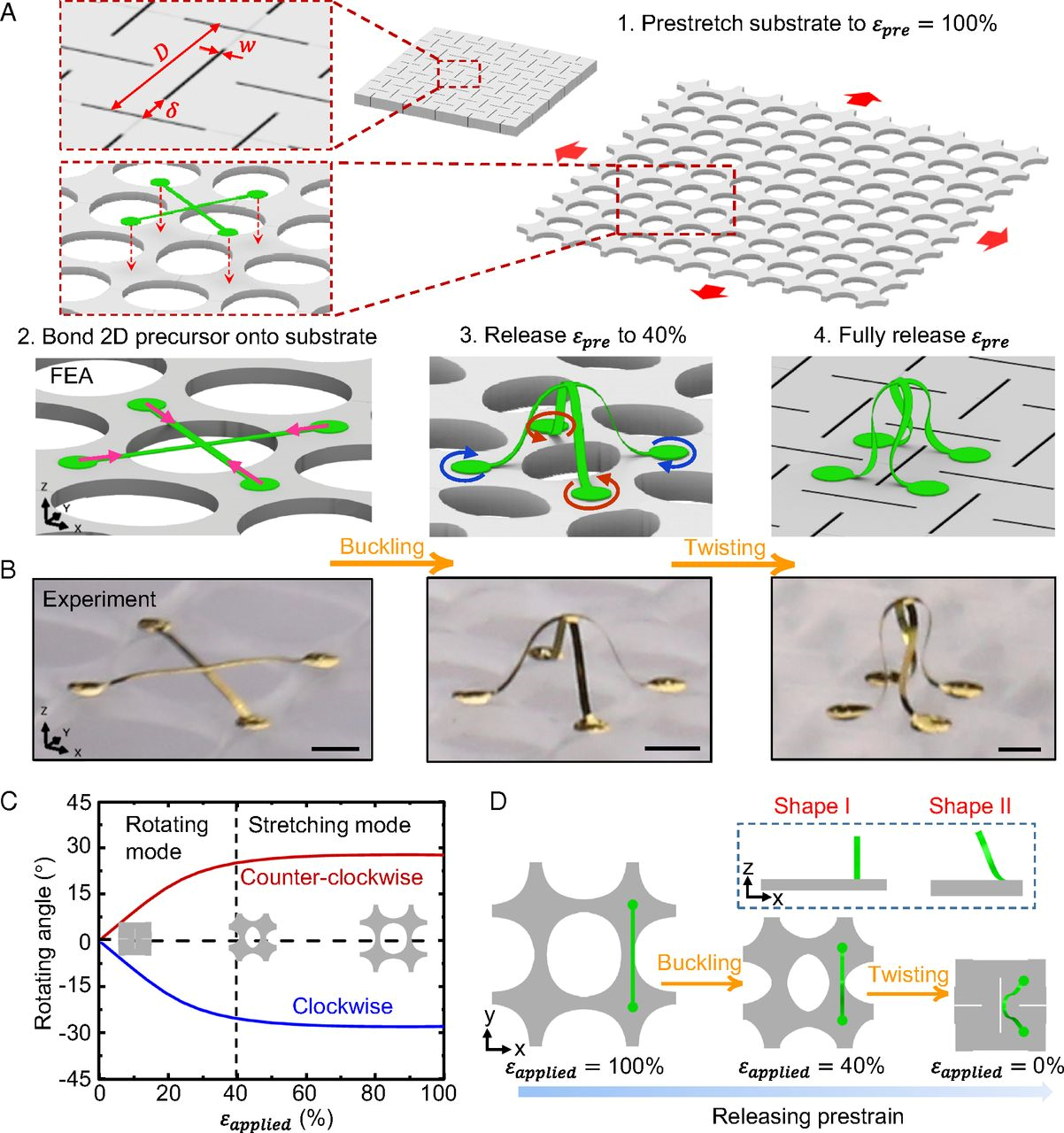
Zhao, Hangbo, et al. "Buckling and twisting of advanced materialsinto morphable 3D mesostructures." Proceedings of the National Academy ofSciences (2019): 201901193.
DOI: 10.1073/pnas.1901193116
https://www.pnas.org/content/116/27/13239
除以上外,John A. Rogers院士課題組2019年在納米/分子級制造基礎和應用,用于特殊電子和光子器件的材料和圖案化技術,生物集成和仿生系統等領域還發表了一系列重要成果,由于內容較多,在此不一一列出。感興趣的讀者可前往課題組網站學習。
John A. Rogers院士簡介

John A. Rogers 教授于1995年在麻省理工學院(MIT)獲得物理化學博士學位,曾在Bell實驗室擔任凝聚態物理研究部主任。從2003開始,Rogers教授在伊利諾伊大學香檳分校擔任材料科學與工程系講席教授。2016年起,擔任美國西北大學材料科學與工程、生物醫學工程和醫學學科Louis Simpson and Kimberly Querrey講席教授,并兼任生物集成電子中心創始主任。
John A. Rogers 教授是美國國家科學院、美國國家工程院、美國藝術與科學學院三院院士,同時是美國電氣和電子工程師協會(IEEE)、美國物理協會(APS)和材料研究協會(MRS)等多個權威科學協會會士。此外,他是復旦大學、浙江大學榮譽教授,瑞士聯邦理工學院榮譽博士。他曾獲麥克阿瑟天才獎(2009年) 、麻省理工學院的萊梅爾遜獎(2011年)、美國史密森尼物理科學創造力大獎(2013年)、蘇黎世聯邦理工學院頒發的蘇黎世化學工程獎章(2015年)以及美國機械工程師學會頒發的納戴獎章(2017年)。
(簡介來源:https://amn.xidian.edu.cn/info/1017/2405.htm)
截止目前,John A. Rogers院士發表論文650篇以上,獲批或申請中的專利超過100項;Web of Science被引次數超過64000次,H指數117;Google Scholar被引次數超過122000次,H指數171。
課題組網站:
http://rogersgroup.northwestern.edu/

圖丨John A. Rogers院士課題組合影
(注:文中人物照片來源于美國西北大學網站)











