
第一作者:李世美
通訊作者:孟憲偉、譚龍飛
第一單位:中國科學院理化技術研究所
核心內容:
1. 綜述了納米金屬有機框架(NMOFs)的合成方法,研究討論了其生物相容性及熒光、MR、CT成像性能。
2. 系統討論了NMOFs在腫瘤治療中的應用,包括光療、放療、微波療法及聲動力治療。
納米金屬有機框架
納米金屬有機框架(NMOFs)具有生物相容性好、比表面積大、結構可調、功能多樣等優點,在生物醫學應用領域越來越受到高度重視。
綜述簡介
有鑒于此,中國科學院理化技術研究所孟憲偉課題組系統介紹了納米金屬有機框架在腫瘤治療相關研究中的最新進展。概括了NMOFs的合成方法、生物相容性及成像性能;系統分析并總結了NMOFs在包括光療、放療、微波療法及聲動力治療在內的腫瘤治療中的應用,并對其發展前景和挑戰進行總結。
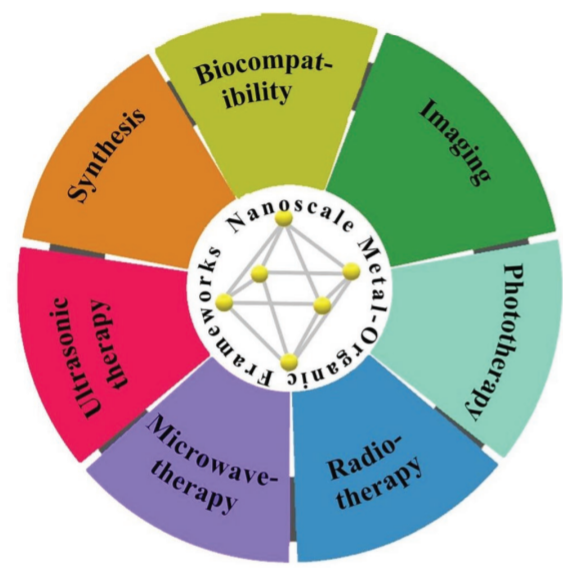
圖1. 納米金屬有機框架應用。
要點1:NMOFs的合成、生物相容性及成像
1. 合成
MOFs由金屬中心和有機配體組裝而成,不同的金屬離子和配體、反應溶劑、時間及溫度都使得MOFs獲得個性化特征。金屬離子與配體之間的親和力影響納米結構的成核、形成及最終形態;在成核過程中,體系的溫度和反應物的溶解度對反應位點的產生有重要影響,通常,較好的溶解度會促使體系產生更多的位點及更小的納米尺度基元,從而促進大量小納米顆粒的形成。文章綜述了包括溶劑熱法、微波輔助法、超聲合成法和電化學法在內的四種合成方法,并分別就各影響因素進行討論。
2. 生物相容性
NMOFs中金屬離子與有機配體的可選擇性、及其固有的可降解性為其良好的生物相容性奠定了基礎。材料的生物相容性與其理化性質密切相關,在選擇生物安全性高的金屬離子及有機配體的前提下,綜述了NMOFs的尺寸、表面性質及形貌對其在生物體內的運轉、分布、內吞及代謝等方面的重大影響。同時,概述了影響尺寸及表面性質的因素,以及對二者進行調控和優化的方法,以確保合成生物相容性高的NMOFs來應用于腫瘤的診斷與治療。
3. 成像
體內成像為實時檢測和跟蹤病變的發生、發展提供了一個可視化系統,在癌癥的診斷與治療中至關重要。NMOFs作為一種金屬離子與有機配體可調、表面活性位點豐富的周期性多孔納米材料,在生物成像中顯現了重大的優勢。通過選擇功能性的金屬離子或配體、通過化學配位或多孔性負載成像試劑,賦予了NMOFs熒光、MR及CT成像的功能。
要點2:NMOFs在腫瘤治療中的應用
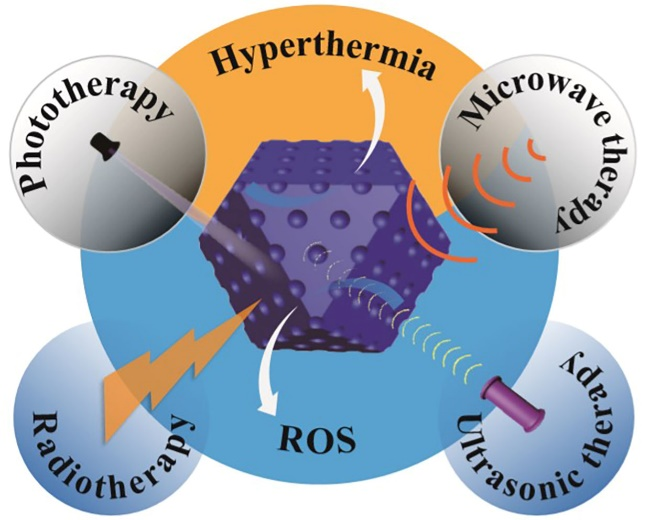
圖2. NMOFs在四種腫瘤治療中產熱或產活性氧的示意圖。
1. 光療
光療包括光動力及光熱治療。光動力療法中,卟啉及其衍生物作為光敏劑與金屬離子配位形成卟啉基NMOFs,NMOFs的周期性多孔結構有效地避免了光敏劑的自聚集和自猝滅,并提高了細胞毒性ROS的擴散效率。同時,良好的生物相容性及EPR被動靶向特性也使得NMOFs在光動力療法中凸顯出優勢;光熱療法中,利用MOFs的多孔結構可將多種光熱試劑負載于孔內。此外,還可通過將光熱試劑(如IR825、ICG等)作為配體,實現NMOFs基光熱系統的有效光熱治療。

圖3. NMOFs在光熱及光動力治療中的應用。
2.放療
放療是利用電離輻射與腫瘤組織之間的相互作用來破壞癌細胞中的DNA雙鏈,達到腫瘤殺傷效果。然而,腫瘤組織對電離輻射能的特異性吸收不足,腫瘤微環境(如乏氧)對輻射產生的抵抗皆限制了放療效果。NMOFs,由于具有較大的比表面積和周期性多孔結構,能有效負載放療增敏劑,且利用重原子序數的元素對二次光子和電子經歷非彈性散射,可顯著提高放療效率。同時,通過NMOFs對腫瘤微環境的調節,可有效減弱放療抵抗,實現協同增效。放動力治療作為放療的補充,可通過選用卟啉及其衍生物作為配體,與重原子序數的離子(如Hf)配位來構建NMOFs基放療增敏劑,實現腫瘤的放療-放動力治療。
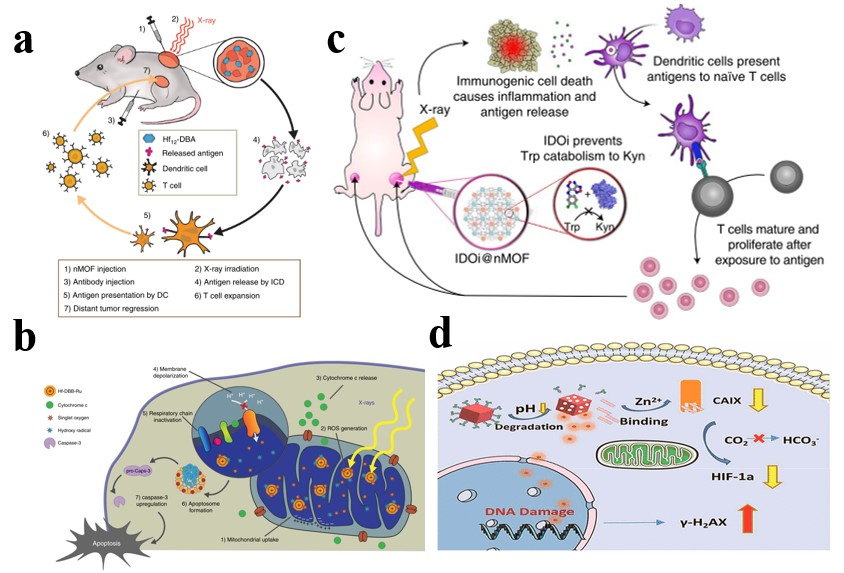
圖4. NMOFs在放療中的應用。
3. 微波治療
微波具有熱轉換效率高、組織穿透深度深、不受氣體和骨骼干擾等優勢,是臨床上常用的一種輻照源。腫瘤微波治療主要包括微波熱療和微波動力療法。微波熱療是通過將電磁場中極性分子產生的動能轉化為熱能,使腫瘤組織溫度迅速升高,進而引起腫瘤細胞的壞死消融。微波動力是利用微波刺激增敏劑產生ROS,與腫瘤細胞發生氧化反應,誘導細胞凋亡或壞死。NMOFs由于具有納米框架的限域效應,使得孔隙中聚集的離子在微波輻射下發生高頻碰撞,從而將微波電磁能轉化為熱能。同時,NMOFs的多孔性及表面多活性位點可負載多種微波增敏劑(如離子液體等),從而實現腫瘤的微波熱療與微波動力治療。

圖5. NMOFs在微波治療中的應用。
4. 聲動力治療
超聲作為一種生物相容性好、對組織穿透深度深的機械波,已被廣泛應用于腫瘤的臨床治療。高強度聚焦超聲(HIFU)和聲動力治療(SDT)作為新型的超聲治療技術已被逐漸用于腫瘤治療研究。SDT是依賴于超聲輻射下聲敏劑存在的一種無創療法。NMOFs的多孔性及表面存在的大量活性位點,使得其可偶聯或裝載聲敏分子,構建出生物相容性良好的超聲敏感性系統。同時,具有聲敏性的卟啉及其衍生物可與金屬離子配位形成NMOFs基聲敏劑,直接用于聲動力治療中。
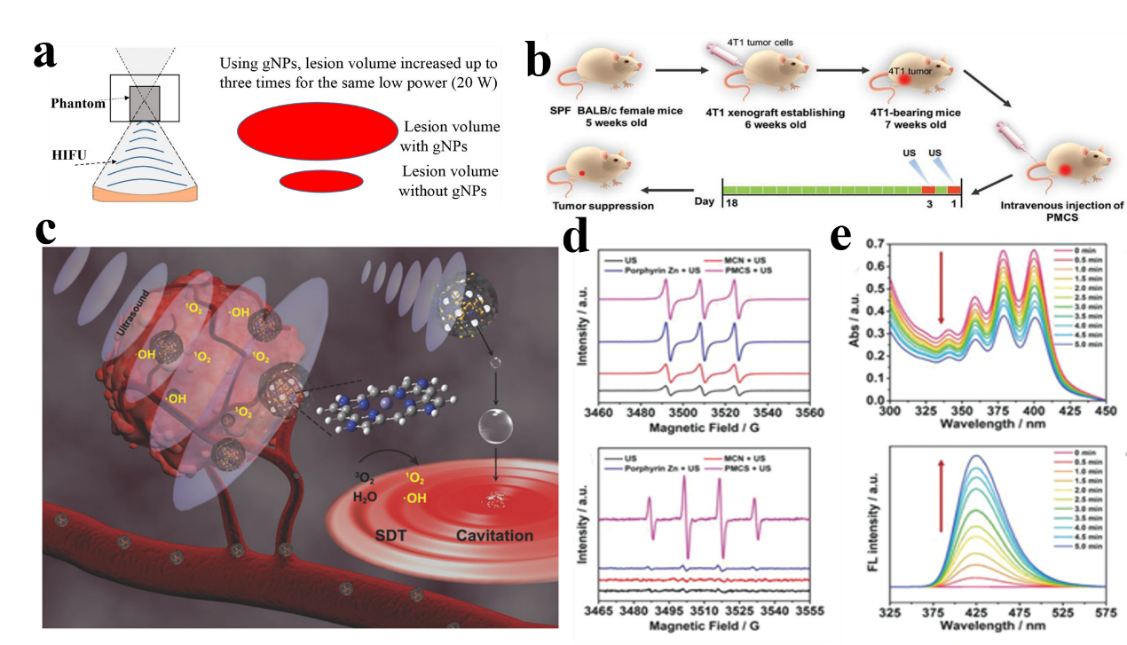
圖6. NMOFs在聲動力治療中的應用。
總結與展望
1. NMOFs在腫瘤治療中的相關研究
(1)NMOFs的合成條件多樣化;
(2)NMOFs的生物相容性受尺寸、表面性質及形貌等影響;
(3)NMOFs既可作為納米藥物載體,又可作為熒光、MR、CT成像試劑;
(4)NMOFs在光療、放療、微波療法及聲動力治療中,既是增敏劑良好的遞送載體,又可通過各功能性金屬或配體組裝成獨立的增敏系統。
2. NMOFs在臨床轉化前面臨的問題
(1)對NMOFs進行可控制備,以獲得合適尺寸、結構,且生物相容性好的NMOFs;
(2)NMOFs與細胞表面的相互作用,以及NMOFs的結構與治療效率之間的關系;
(3)NMOFs在各療法中的作用機制有待闡明;
(4)NMOFs需要進行更嚴格、更完善的臨床前研究,包括急性毒性及分子水平上引起的亞慢性和慢性毒性評估。
NMOFs在生物醫學領域的研究已啟航,在臨床轉化中機遇與挑戰并存!
參考文獻
Li, S., Tan, L., Meng, X., NanoscaleMetal‐Organic Frameworks: Synthesis, Biocompatibility, Imaging Applications,and Thermal and Dynamic Therapy of Tumors. Adv. Funct. Mater.2020, 1908924.
https://doi.org/10.1002/adfm.201908924











