本周納米醫學周刊第3期,奇物論編輯部精選了18篇納米醫學和成像傳感相關的文獻資料,并進行了匯總和整理,供感興趣的老師和同學參考。其中包括刺激響應性納米粒子、熒光探針與檢測、納米酶和催化醫學以及其他相關的納米醫學等等,其中不乏亮點之作,也歡迎大家多提寶貴意見,幫助我們將每周周刊辦的更好。
一、刺激響應性納米粒子
1.Nature Nanotech:養虎為患!癌細胞培養無藥納米粒長大卻殺死自身
韓國基礎科學研究所Bartosz A.Grzybowski和Kristiana Kandere-Grzybowska等人報道了一種“無藥”策略,通過控制溶酶體中的攜帶兩種電荷惰性金納米顆的聚集狀態來殺死癌細胞。
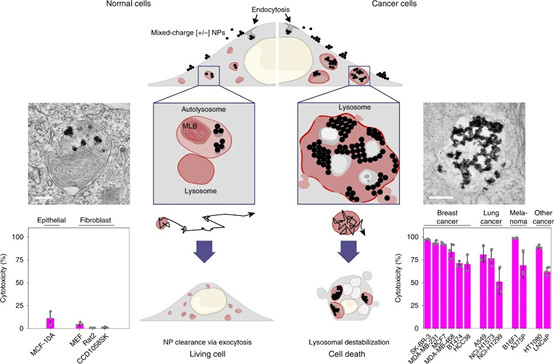
Borkowska,M., et al. Targetedcrystallization of mixed-charge nanoparticles in lysosomesinduces selectivedeath of cancer cells. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-020-0643-3
2.Nano Lett.:納米前藥低毒高效治療類風濕性關節炎
考慮到物理封裝的有效載荷具有藥物突釋和/或低載藥量,啟動創新的前藥策略以優化模塊化納米藥物的設計是至關重要的。在此,國家納米科學中心梁興杰、南開大學郭術濤等人設計了模塊化的pH敏感型地塞米松丙酮基縮酮連接前藥(AKP-dexs),并將其制成納米粒子。
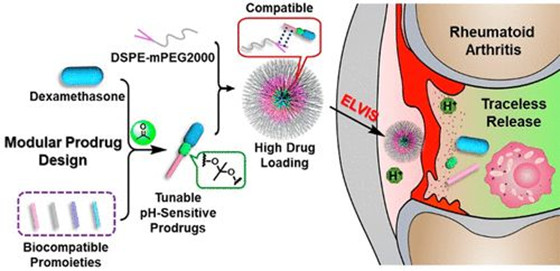
Yang Xu, et al. ModularAcid-Activatable Acetone-Based Ketal-Linked Nanomedicine by DexamethasoneProdrugs for Enhanced Anti-Rheumatoid Arthritis with Low Side Effects, NanoLett., 2020.
DOI: 10.1021/acs.nanolett.9b05340
https://doi.org/10.1021/acs.nanolett.9b05340
3.Angew:糖衣炮彈!葡萄糖包裹聚合物納米載體跨血腦屏障遞送藥物
目前反義寡核苷酸(ASO)治療中樞神經系統(CNS)疾病的方法是通過侵入性給藥,給患者帶來很大負擔。為了減輕這一負擔,東京大學Kazunori Kataoka(片岡一則)院士和KanjiroMiyata等人報道了通過使用血糖控制作為外部觸發,跨越血腦屏障,向大腦系統性輸送ASO。
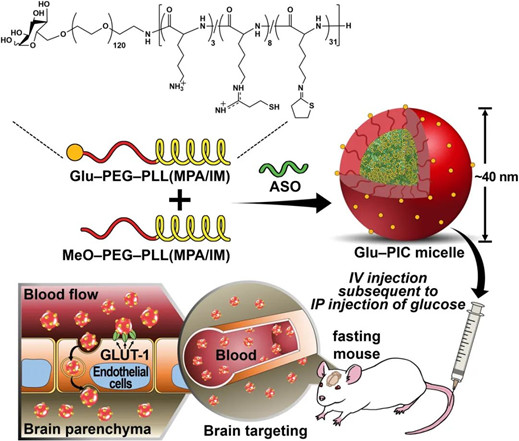
Min, H.S., et al. (2020), SystemicBrain Delivery of Antisense Oligonucleotides across the Blood–Brain Barrierwith a Glucose‐Coated Polymeric Nanocarrier. Angew. Chem. Int. Ed..
DOI:10.1002/anie.201914751
https://doi.org/10.1002/anie.201914751
4.Biomaterials:卵黃-殼納米囊泡同時實現藥物釋放和T1 MRI激活
開發具有時空可控的藥物釋放機制和可激活成像能力的納米藥物在技術上仍然具有挑戰性。在此,美國國立衛生研究院陳小元、南方醫科大學沈折玉、吉林大學中日聯誼醫院Jianshi Du等人開發了一種蛋黃-殼型GSH響應性納米囊泡(NVs),可以達到此目的,這項研究有助于在精密納米醫學中復雜的納米藥物的設計。
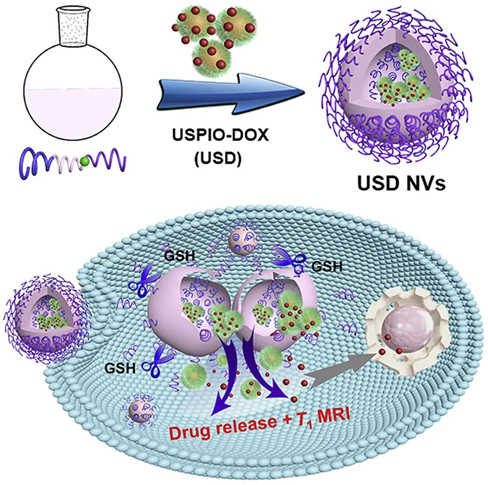
Dahai Liu, et al. Yolk-shellnanovesicles endow glutathione-responsive concurrent drug release and T1 MRIactivation for cancer theranostics, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119979
5. AM:金屬-有機框架納米顆粒在細胞外pH調控下誘導細胞焦亡
離子穩態對細胞生存至關重要,而特定離子濃度的升高被用來啟動不同形式的程序性細胞死亡。然而,由于細胞對離子輸入的嚴格調控,以可控的方式研究某些離子對細胞的影響一直受到阻礙。德國慕尼黑大學Hanna Engelke、西班牙BCMaterials的Stefan Wuttke等人的研究表明脂質包裹的鐵基金屬-有機框架納米顆粒能夠將大量的鐵離子遞送和釋放到細胞內。
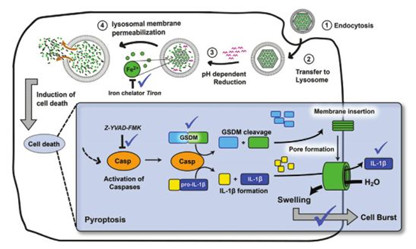
Evelyn Ploetz, et al. Metal–OrganicFramework Nanoparticles Induce Pyroptosis in Cells Controlled by the ExtracellularpH, Adv. Mater., 2020.
DOI: 10.1002/adma.201907267
https://doi.org/10.1002/adma.201907267
6.Biomaterials:近紅外光觸發分解的納米平臺用于增強對腫瘤的穿透和化療
納米藥物的穿透性較差往往會導致納米藥物在腫瘤深部組織的積累很少,從而大大降低了化療效率。西南交通大學趙靜雅老師、郭星教授和周紹兵教授合作開發了一種Arg-Gly-Asp-Phe-Lys肽(cRGD)修飾的,近紅外(NIR)光引發分解的脂質體納米平臺 (PAM/Pt@IcLipo)用于增強藥物對腫瘤的穿透和化療效果。
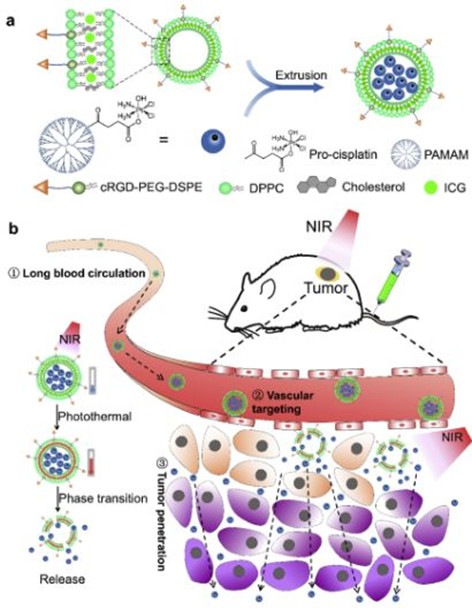
Xiang Xiong. Et al. A NIR light triggereddisintegratable nanoplatform for enhanced penetration and chemotherapy in deeptumor tissues. Biomaterials. 2020
https://www.sciencedirect.com/science/article/pii/S0142961220300867
二、光學治療
毒性較低且在特定腫瘤組織上有效的抗癌劑已成為對抗癌癥的新范例。最近,人們致力于通過化學反應將臨床批準的藥物轉變為特定腫瘤微環境中的抗癌藥物。有鑒于此,中國科學院上海硅酸鹽研究所的施劍林院士和陳雨等人構筑了中空的普魯士藍(HMPB)基納米藥物DSF@PVP/Cu-HMPB,實現了DSF的原位化學反應激活和高熱增強的化學療法。
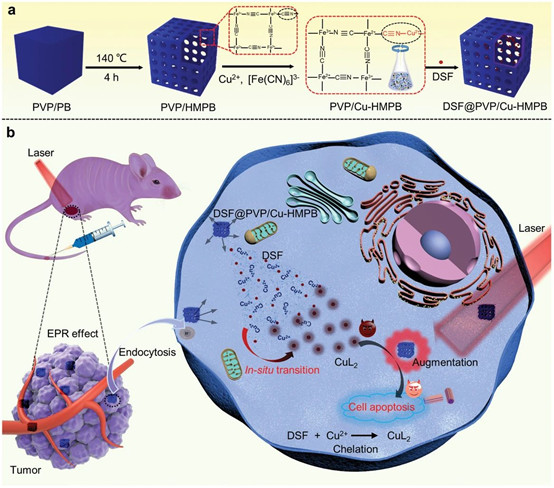
Wencheng Wu et al. Copper-EnrichedPrussian Blue Nanomedicine for In Situ Disulfiram Toxification and PhotothermalAntitumor Amplification. Adv. Mater. 2020, 2000542.
DOI: 10.1002/adma.202000542
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202000542
8.Biomaterials:用于siRNA介導的低溫光熱療法的聚多巴胺涂層核酸納米凝膠
光熱療法(PTT)通常需要將腫瘤病變的溫度維持在50°C以上,這有可能誘發局部炎癥和腫瘤轉移。為了避免這些副作用,在PTT治療期間在相對較低的溫度(42–45℃)下獲得有效的抗腫瘤功效至關重要。有鑒于此,上海交通大學張川和上海交通大學附屬第六人民醫院李躍華等研究人員,設計了一種聚多巴胺(PDA)涂層的核酸納米凝膠,作為siRNA介導的低溫PTT的治療復合物。
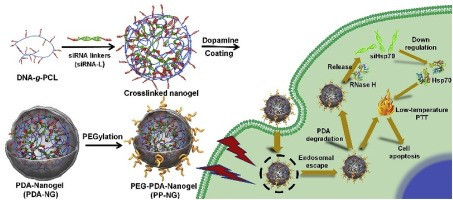
Fei Ding, et al. Polydopamine-coatednucleic acid nanogel for siRNA-Mediated low-temperature photothermal therapy.Biomaterials, 2020.
DOI:10.1016/j.biomaterials.2020.119976
https://www.sciencedirect.com/science/article/pii/S0142961220302222
9.Small:用于光療和化療的低暗毒性和強近紅外激發的銥(III)配合物衍生聚合物膠束
銥(III)配合物是光動力療法的有力候選者。但其水溶性差、暗毒性大、近紅外區(NIR區)吸收可忽略不計,阻礙了其臨床應用。有鑒于此,東南大學茍少華、房雷和香港城市大學Chenjie Xu等研究人員,開發了基于銥(III)配合物的聚合物膠束體系。
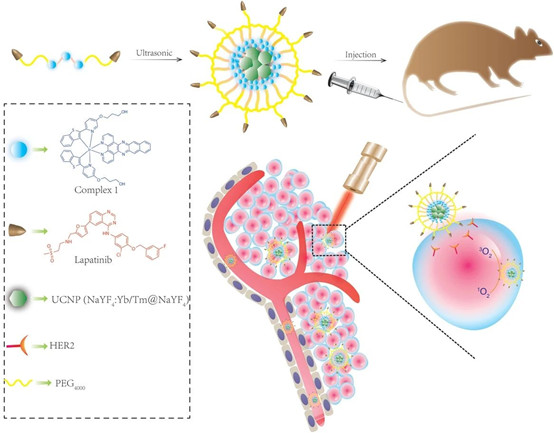
Jian Zhao, et al. Iridium(III)Complex–Derived Polymeric Micelles with Low Dark Toxicity and Strong NIRExcitation for Phototherapy and Chemotherapy. Small, 2020.
DOI:10.1002/smll.202000363
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.202000363
三、熒光探針與檢測
10.AM:多重NIR-II探針用于淋巴結侵入的癌癥檢測和成像引導手術
腫瘤淋巴結(LN)轉移是腫瘤分期和治療決策的主要預后因素。然而,同時可視化轉移和進行成像引導的淋巴結手術是具有挑戰性的。于此,美國國立衛生研究院陳小元、南方科技大學梁永曄、武漢理工大學張明曦和吉林大學朱守俊等人報道了使用非重疊NIR-II探針的多重近紅外-II(NIR-II)體內成像系統,其具有顯著抑制的光子散射和零自發熒光,從而可以可視化轉移性腫瘤和腫瘤轉移性近端LNs切除。
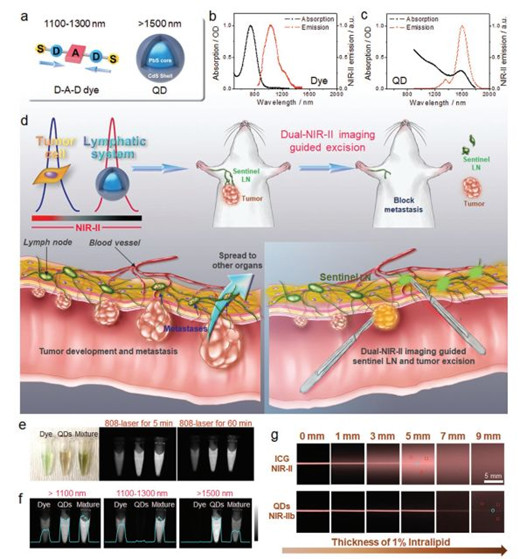
Tian, R., et al. Multiplexed NIR‐IIProbes for Lymph Node‐Invaded Cancer Detection and Imaging‐Guided Surgery. Adv.Mater. 2020, 32, 1907365.
https://doi.org/10.1002/adma.201907365
11.Nanoscale:具有增強NIR-II發光性能的Ln3+摻雜納米顆粒用于小鼠血管成像
在NIR-II (1000-1700 nm)區工作的探針具有比傳統I區(700-950 nm)探針更高的分辨率和更小的自熒光。復旦大學馮瑋教授和李富友教授合作設計并合成了具有核/殼/殼結構的稀土離子摻雜的探針,其會被808nm光激發并在NIR-II區發出明亮的光。
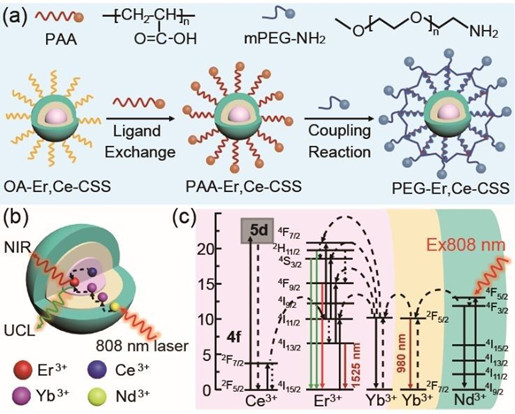
Cong Cao. et al. Ln3+-dopednanoparticles with enhanced NIR-II luminescence for lighting up blood vesselsin mice. Nanoscale. 2020
https://pubs.rsc.org/en/content/articlelanding/2020/nr/d0nr01098g#!divAbstract
12.Small:通過對發光金納米粒子的表面處理,實現單線態氧生成的雙向調控
已經觀察到超小發光金納米顆粒(AuNPs)產生單線態氧(1O2),但調節納米貴金屬產生1O2的能力仍然具有挑戰性。有鑒于此,華南理工大學劉錦斌等研究人員,超小AuNPs(d≈1.8nm)的產氧能力與表面因素(包括Au(I)種類的數量和表面電荷)密切相關。
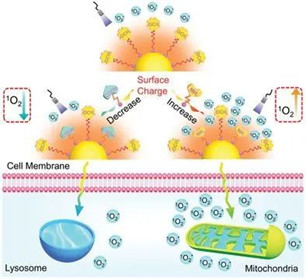
Lulu Liu, et al. BidirectionalRegulation of Singlet Oxygen Generation from Luminescent Gold Nanoparticlesthrough Surface Manipulation. Small, 2020.
DOI:10.1002/smll.202000011
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.202000011
四、納米酶與催化醫學
13. AFM:過氧化物酶樣納米酶誘導一種新形式的細胞死亡并抑制體內腫瘤生長
具有固有酶性質的納米材料,被稱為納米酶,已經引起了人們的極大興趣,盡管關于它們在細胞或體內的生物學特性的信息有限。有鑒于此,北京理工大學梁敏敏、中國科學院生物物理研究所閻錫蘊院士和哈佛大學附屬麻省總醫院Hak Soo Choi等研究人員,發現具有過氧化物酶樣活性的納米材料通過依賴于ATP檸檬酸裂解酶(ACLY)的大鼠肉瘤病毒癌基因(RAS)信號機制觸發了一種新的細胞死亡形式。
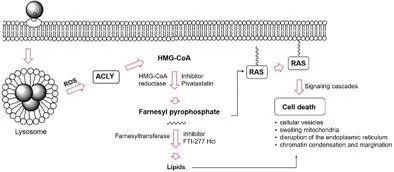
Peixia Wang, et al. Peroxidase‐LikeNanozymes Induce a Novel Form of Cell Death and Inhibit Tumor Growth In Vivo.Advanced Functional Materials, 2020.
DOI:10.1002/adfm.202000647
https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202000647
14. Chem. Sci:級聯納米診療系統用于腫瘤特異性生物催化和協同治療
基于葡萄糖氧化酶(GOD)的協同癌癥治療因其良好的生物相容性和生物可降解在癌癥治療領域引起了人們的廣泛關注。然而,這一新興的治療系統在目前仍然需要一種可實時預測和調節GOD體內生物催化行為的策略,以最大程度地降低其對正常組織的副作用。華東理工大學郭志前教授開發了一種結合了GOD催化的氧化應激和雙通道熒光傳感的腫瘤特異性級聯納米診療系統(BNG),該系統可顯著提高協同治療的療效并實時反饋相關信息。
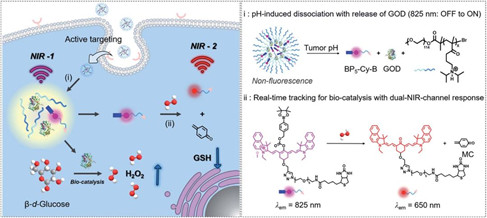
Ruofei Wang. et al. In vivo real-timetracking of tumor-specific biocatalysis in cascade nanotheranostics enablesynergistic cancer treatment. Chemical Science. 2020
DOI: 10.1039/d0sc00290a
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc00290a#!divAbstract
五、其他納米醫學(免疫治療、炎癥治療)
15.Nano Lett:納米殼遞送STING激動劑至腫瘤細胞內增強抗癌化學免疫治療
許多有效的抗癌治療方法的成功歸功于誘導癌細胞免疫原性細胞死亡(ICD),ICD可導致內源性危險信號與腫瘤抗原一起釋放,從而有效地啟動抗癌免疫。在此,中國臺灣陽明大學Che-Ming Jack Hu等人描述了一種通過使用空心聚合物納米殼將干擾素基因刺激因子(STING)激動劑輸送到腫瘤細胞中來人工誘導ICD的策略。
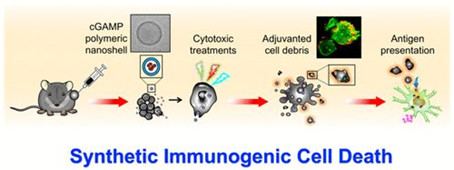
Saborni Chattopadhyay, et al. SyntheticImmunogenic Cell Death Mediated by Intracellular Delivery of STING Agonist NanoshellsEnhances Anticancer Chemo-immunotherapy, Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.9b04094
https://doi.org/10.1021/acs.nanolett.9b04094
16.Biomaterials:仿生CO納米發生器用于I型糖尿病治療
糖尿病是一個日益嚴重的健康問題,并伴有嚴重影響患者生活質量和生存的炎癥性并發癥。一氧化碳(CO)因其抗炎、抗凋亡等特性,已成為治療自身免疫性疾病的潛在治療分子。在此,武漢大學張先正、曾旋、Rong Lei等人構建了一種基于介孔二氧化硅的仿生CO納米生成器(mMMn),用于I型糖尿病治療。
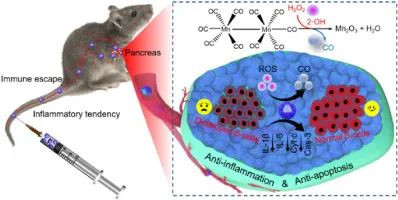
Cheng Zhang, et al. Biomimetic carbonmonoxide nanogenerator ameliorates streptozotocin induced type 1 diabetes inmice. Biomaterials, 2020.
DOI:10.1016/j.biomaterials.2020.119986
https://doi.org/10.1016/j.biomaterials.2020.119986
17.Biomaterials:負載姜黃素的納米顆粒靶向免疫調節血腦屏障上的炎性單核細胞延緩了實驗性自身免疫性腦脊髓炎
由于多種自身抗原引起的復雜發病機理,很難進行多發性硬化癥(MS)的早期診斷和治療。單核細胞在MS的過程中起重要作用,尤其是當大多數擴增的炎性單核細胞通過BBB促進神經元損傷并募集更多的免疫細胞滲入中樞神經系統(CNS)時。有鑒于此,華中科技大學Zhihong Zhang等研究人員,將單核細胞作為治療MS的有效免疫靶點,采用高密度脂蛋白模擬肽-磷脂支架(HPPS)作為載體來提高姜黃素的生物利用度。
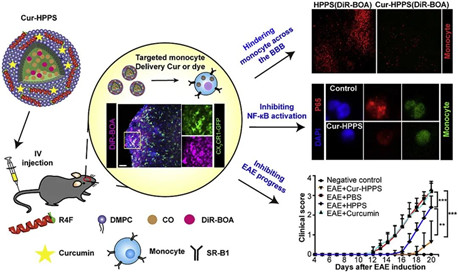
Lisen Lu, et al. Targetedimmunomodulation of inflammatory monocytes across the blood-brain barrier bycurcumin-loaded nanoparticles delays the progression of experimental autoimmuneencephalomyelitis. Biomaterials, 2020.
DOI:10.1016/j.biomaterials.2020.119987
https://www.sciencedirect.com/science/article/pii/S0142961220302337
18.ACS. Appl. Inter. Mater:基于MOF/Ag的復合納米材料用于快速協同滅菌
金屬有機骨架(MOFs)作為一種優良的藥物載體,為對抗致病性細菌感染提供了許多新的策略。目前雖然可以很容易地將各種抗菌金屬離子引入MOFs進行化學治療,但這種單一模式的殺菌方法往往所需使用的劑量大,抗菌效率有限,滅菌速度也很慢。四川大學邱邐教授、程沖研究員和趙長生教授合作報道了一種MOF/Ag衍生的納米復合材料,該材料具有高效的金屬離子釋放能力和優異的光熱轉換效應,可以實現協同殺菌。
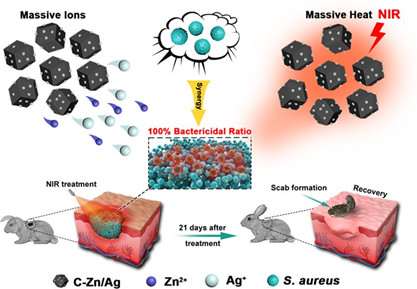
Ye Yang. et al. Metal?OrganicFramework/Ag-Based Hybrid Nanoagents for Rapid and Synergistic BacterialEradication. ACS Applied Materials Interfaces. 2020
DOI: 10.1021/acsami.0c01666
http://pubs.acs.org/doi/10.1021/acsami.0c01666












