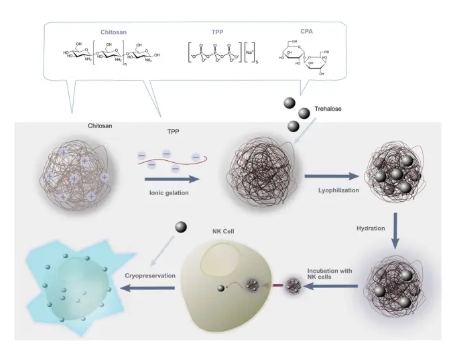
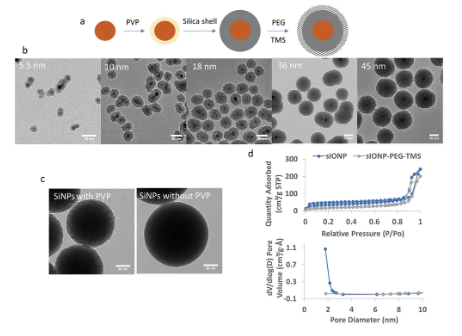
養(yǎng)細(xì)胞是一門技術(shù)活,在操作過程中,可能稍有不慎,它就染菌了。而通過低溫保存一些需要活力好的細(xì)胞,更是技術(shù)難題。如在細(xì)胞復(fù)蘇過程中,動作稍微慢一點,細(xì)胞內(nèi)就會形成大冰晶而殺死細(xì)胞,存活下來的細(xì)胞可能細(xì)胞狀態(tài)還不好,一邊是千辛萬苦把材料制備完之后,迫不及待地看效果,而另一邊細(xì)胞長得慢吞吞的,嚴(yán)重影響了實驗進(jìn)度。而且,對于回輸性細(xì)胞和器官移植試驗,細(xì)胞的活力程度決定了試驗的成敗。于此,低溫保護(hù)劑在保護(hù)細(xì)胞和移植器官中起了非常重要的作用,而開發(fā)優(yōu)良的低溫保護(hù)劑具有非常廣闊的商業(yè)前景,下面來看看4篇頂刊報道的低溫保存技術(shù)如何對細(xì)胞/器官進(jìn)行保護(hù)!1. Adv. Sci.: 納米粒介導(dǎo)NK細(xì)胞內(nèi)保護(hù)可避免冷凍傷并保留有效的抗腫瘤功能自然殺傷(NK)細(xì)胞在臨床過繼轉(zhuǎn)移環(huán)境中介導(dǎo)有效抗腫瘤免疫的能力在很大程度上依賴于它們在冷凍保存后保留細(xì)胞毒性功能的能力。為了避免與在存在二甲基亞砜(DMSO)的情況下將NK細(xì)胞注入患者體內(nèi)相關(guān)的潛在全身毒性,人們對具有改進(jìn)安全性的替代冷凍保護(hù)劑(CPA)的興趣不斷增長。盡管開發(fā)了各種糖,氨基酸,多元醇和多兩性電解質(zhì)作為冷凍保護(hù)劑,但是它們促進(jìn)保護(hù)免受細(xì)胞內(nèi)冷凍損害的能力仍然受到限制,因為它們大多在細(xì)胞外發(fā)揮作用。盡管存在將冷凍保護(hù)劑在細(xì)胞內(nèi)穿梭的方法,但對于NK細(xì)胞,目前尚未被充分研究于開發(fā)新型冷凍保存方法。于此,美國普渡大學(xué)Sandro Matosevic等人提出了用于將非DMSO CPAs于細(xì)胞內(nèi)遞送至NK細(xì)胞的安全且有效的平臺的第一個實例。1)基于生物相容性殼聚糖的納米顆粒經(jīng)過工程設(shè)計,可介導(dǎo)NK細(xì)胞的高效無DMSO冷凍保存。2)以這種方式冷凍保存的NK細(xì)胞保留了針對腫瘤靶標(biāo)的有效細(xì)胞毒性,脫粒作用和細(xì)胞因子產(chǎn)生功能。這不僅代表了將納米顆粒遞送至NK細(xì)胞的第一個例子,而且說明了“現(xiàn)成”制造更安全的同種異體過繼免疫療法的臨床潛力。Yao, X., et al., Matosevic, S., Nanoparticle‐Mediated Intracellular Protection of Natural Killer Cells Avoids Cryoinjury and Retains Potent Antitumor Functions. Adv. Sci. 2020, 1902938.DOI: 10.1002/advs.201902938https://doi.org/10.1002/advs.2019029382. Adv. Sci.:可大規(guī)模制備的介孔硅納米鐵用于器官復(fù)溫低溫保存技術(shù)可以長期保存生物系統(tǒng)。然而,對低溫保存器官面臨的一個主要挑戰(zhàn)仍然是大體積(>3ml)的復(fù)溫,因為在升溫過程中,機械應(yīng)力和結(jié)冰會對器官造成嚴(yán)重?fù)p害。納米溫?zé)峒夹g(shù)是一種很有前景的解決方案,通過將灌注在器官血管系統(tǒng)的磁性納米顆粒(IONPs)進(jìn)行感應(yīng)加熱,可快速、均勻地對器官進(jìn)行復(fù)溫。這就需要IONPs能夠大規(guī)模生產(chǎn),可快速加熱,無毒,在冷凍保護(hù)劑(CPA)中保持穩(wěn)定,并且在納米加溫后容易被洗掉。先前已證明在VS55(一種常見的CPA)中使用介孔二氧化硅涂層的氧化鐵納米粒子(msIONP)對細(xì)胞和血管進(jìn)行納米加熱。然而,msIONPs的生產(chǎn)是一個漫長的、多步驟的過程,并且每批只能提供毫克級別的鐵。于此,美國明尼蘇達(dá)大學(xué)John C. Bischof等人提出了一種新的微孔二氧化硅涂層的氧化鐵納米粒子(sIONP),它可以在短短1 d內(nèi)生產(chǎn),而每批中的鐵含量可達(dá)1.4 g。還驗證了sIONP在VS55中具有較高的發(fā)熱性,生物相容性和穩(wěn)定性,并且通過先進(jìn)的成像和ICP-OES證明了sIONP能對大鼠腎臟進(jìn)行灌注和洗脫。Gao, Z., Ring, H. L., Sharma, A., Namsrai, B., Tran, N., Finger, E. B., Garwood, M., Haynes, C. L., Bischof, J. C., Preparation of Scalable Silica‐Coated Iron Oxide Nanoparticles for Nanowarming. Adv. Sci. 2020, 1901624.https://doi.org/10.1002/advs.2019016243. Nano Letters: 冷響應(yīng)納米膠囊用于細(xì)胞內(nèi)海藻糖遞送和低溫保存

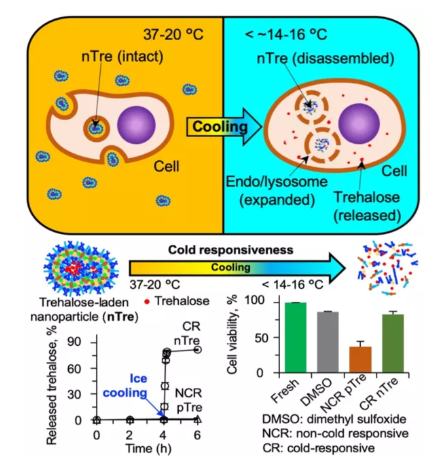
傳統(tǒng)的細(xì)胞低溫冷凍保存方法通常需要使用滲透性的、有毒的有機溶劑(例如二甲基亞砜、甘油等)作為低溫保護(hù)劑,復(fù)溫后的細(xì)胞必須經(jīng)過繁瑣的洗滌過程去除細(xì)胞內(nèi)外的有機溶劑才能實際應(yīng)用。而海藻糖是一種天然的二糖,廣泛存在自然界多種微生物中,相對于傳統(tǒng)的低溫保護(hù)劑而言,具有無毒高效的低溫保護(hù)效果。已有研究表明,海藻糖必須同時存在于細(xì)胞膜內(nèi)外兩側(cè)時,其保護(hù)效果才最佳。然而,哺乳動物細(xì)胞自身不能合成海藻糖,且其細(xì)胞膜上沒有海藻糖轉(zhuǎn)運蛋白,這就導(dǎo)致海藻糖無法高效、無損地進(jìn)入細(xì)胞內(nèi)部,嚴(yán)重限制了海藻糖在細(xì)胞低溫冷凍保存中的應(yīng)用。面對這一挑戰(zhàn),美國馬里蘭大學(xué)何曉明和中國科學(xué)技術(shù)大學(xué)趙剛等人,創(chuàng)造性地設(shè)計了一種冷響應(yīng)的納米膠囊,用于海藻糖的納米尺度封裝、細(xì)胞內(nèi)遞送和溫度控制釋放。且使用該方法成功實現(xiàn)了兩種典型細(xì)胞的低溫冷凍保存,其保存效果與傳統(tǒng)的二甲基亞砜相當(dāng),卻完全避免了伴隨傳統(tǒng)低溫保護(hù)劑的復(fù)溫后的繁瑣的、損傷性的細(xì)胞洗滌過程。該方法為細(xì)胞、組織乃至器官的深低溫冷凍保存提供了新思路。Zhang Y, Wang H, Stewart S, et al. Cold-Responsive Nanoparticle Enables Intracellular Delivery and Rapid Release of Trehalose for Organic Solvent-Free Cryopreservation [J]. Nano letters, 2019.https://pubs.acs.org/doi/abs/10.1021/acs.nanolett.9b041094. Small:冷響應(yīng)納米膠囊實現(xiàn)胰島細(xì)胞的高效保存

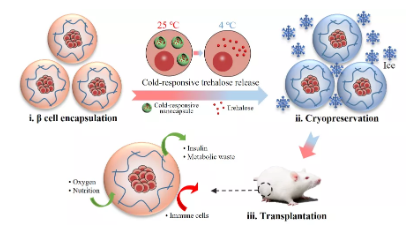
細(xì)胞低溫保存指的是將活細(xì)胞置于低溫環(huán)境(通常為-196℃液氮環(huán)境),暫停細(xì)胞的生命活動,以實現(xiàn)其長期儲存的一種技術(shù)。在傳統(tǒng)的細(xì)胞冷凍保存中,通常要使用滲透性的低溫保護(hù)劑(pCPA)來減少冰晶損傷,但pCPA具有一定的細(xì)胞毒性,并且添加去除過程復(fù)雜,費時費力。海藻糖是一種廣泛存在于許多耐寒生物中的天然的低溫保護(hù)劑,不僅價格低廉而且對細(xì)胞沒有毒性。但哺乳動物的細(xì)胞無法自身合成海藻糖,也很難通過擴散作用將海藻糖攝入到細(xì)胞內(nèi)部以達(dá)到冷凍保護(hù)的作用。因此,研究者們嘗試了多種方法來將海藻糖導(dǎo)入到細(xì)胞內(nèi)部,例如超聲,納米膠囊,顯微注射,基因表達(dá)等。但胞內(nèi)遞送海藻糖的效率、安全性和無損性等多個方面仍存在一定的局限性。中國科學(xué)技術(shù)大學(xué)趙剛和東南大學(xué)趙遠(yuǎn)錦等人針對這一問題,使用了一種借助冷響應(yīng)納米膠囊向細(xì)胞內(nèi)高效安全地遞送海藻糖的新方法,同時結(jié)合海藻酸鹽水凝膠對封裝細(xì)胞的保護(hù)作用,以及趙剛課題組創(chuàng)立的低溫保存細(xì)胞的電磁場空間復(fù)溫技術(shù),實現(xiàn)了胰島β細(xì)胞的單一低溫保護(hù)劑條件下(僅使用了海藻糖,未使用其它滲透性保護(hù)劑)的高效低溫保存(細(xì)胞存活率達(dá)到80%以上)。1)經(jīng)該方法低溫保存并復(fù)蘇后的胰島β細(xì)胞水凝膠構(gòu)建物,移植后可以很好地控制糖尿病大鼠的血糖水平。2)研究人員結(jié)合工程學(xué)和材料學(xué)方法,實現(xiàn)了胰島β細(xì)胞構(gòu)建物的安全高效低溫保存,為使用細(xì)胞療法治療糖尿病提供了一種新思路。同時,該技術(shù)在其它基于細(xì)胞低溫保存的生物醫(yī)學(xué)領(lǐng)域中也具有潛在的應(yīng)用價值。Cheng Y, Yu Y, Zhang Y, et al. Cold‐Responsive Nanocapsules Enable the Sole‐Cryoprotectant‐Trehalose Cryopreservation of β Cell–Laden Hydrogels for Diabetes Treatment[J]. Small, 2019.https://doi.org/10.1002/smll.201904290