臨床狀況
目前期望納米藥物能解決純化療藥物的高毒副作用,但是,迄今為止,市場上還沒有發現納米藥物表現出實質性的消除副作用。脂質體阿霉素(doxorubicin,Doxil)是1995年美國食品和藥物管理局(FDA)批準的第一種癌癥納米藥物,它也表現出與原始阿霉素(Dox)類似的明顯的心臟毒性,盡管它已經商業化,但其長期的生物安全性問題尚未解決。
納米藥物遞送效率低
當前大多數的納米藥物都通過靜脈內給藥,以通過EPR效應來促進腫瘤蓄積,但是,這種方法存在一些缺點,例如藥物生物利用度低,研究表明,只有0.6%注射量到達腫瘤部位,經過改進之后(加上靶向),也只有0.9%,遞送效率很不令人滿意,以至于大多數有毒化學藥物在血液循環中分布在正常組織中,導致嚴重的不良反應。
禁食能敏化腫瘤且保護正常細胞
有兩項早期研究表明,禁食可顯著延緩腫瘤生長,使一系列惡性細胞類型對化療藥物敏感,同時保護正常細胞。目前,禁食結合化療進行癌癥治療已進入臨床試驗,這為提高納米醫學的治療特異性和療效提供了可能性,但是,禁食會使得患者很難忍受。因此,在減輕納米藥物副作用的同時,通過非飲食方法增加饑餓將是首選方法。
成果簡介:
有鑒于此,中科院上海硅酸鹽研究所施劍林院士和陳雨研究員等人結合臨床狀況,提出老藥新用,即參考FDA批準的Doxil,通過在脂質體中共加載Dox和2-脫氧-d-葡萄糖(2DG)構建了復合脂質體納米系統,這使得癌癥和正常細胞之間的差異應激致敏能夠用于腫瘤特異性化療。

設計思路(畫重點)
2DG是一種葡萄糖類似物,已在臨床試驗(I / II期)中廣泛用作抗糖酵解劑。由于癌細胞非常依賴糖酵解來提供能量(“Warburg效應”),因此2DG通過阻止糖酵解ATP的產生,觸發隨后的差異性應激敏化過程,可以使其處于短期嚴重饑餓狀態。
簡單來講就是,將Dox和2DG封裝在一個單一的納米系統中,
一方面,對于腫瘤,2DG饑餓腫瘤從而降低腫瘤耐藥性,同步遞送的Dox會因為饑餓腫瘤后,然后進一步放大其毒性。
另一方面,對于正常細胞,因為2DG會使得正常細胞同樣處于饑餓狀態,而這恰恰可以讓正常細胞接觸到該納米系統時,開啟了自我保護狀態,從而大大降低了化療藥物對正常組織的傷害。
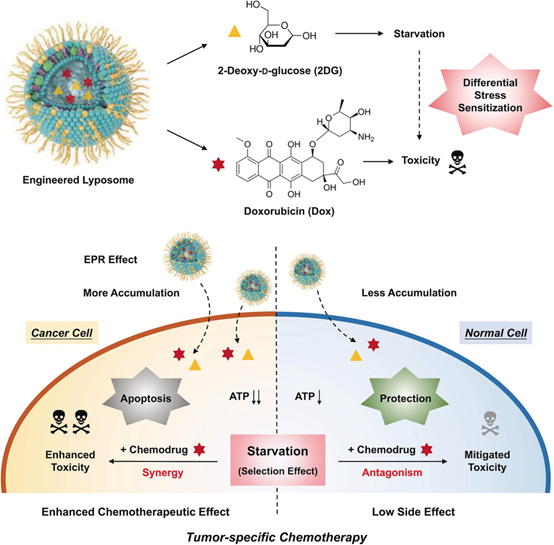
圖1. 示意圖
糖酵解抑制和差異應激致敏
1924年諾貝爾獎獲得者Otto Warburg首次證明了改變的葡萄糖代謝是癌癥的標志之一。正常分化細胞主要依賴線粒體氧化磷酸化(OXPHOS)產生ATP,而大多數癌細胞依賴于有氧糖酵解來提供能量,因此,腫瘤中糖酵解產生的ATP速率比OXPHOS快約100倍。
2DG是合成的葡萄糖類似物,其中C-2-羥基被氫取代。在癌細胞中,2DG被己糖激酶(糖酵解的第1步中的酶)磷酸化以形成2-脫氧-d-葡萄糖-6-磷酸(2DG-6-P),其不能進一步代謝但積累并抑制糖酵解的第1步和第2步(如圖2所示)。因此,ATP的產生受到很大抑制,癌細胞嚴重缺乏能量。
因此,在該研究中,復合納米系統中的2DG能夠引發癌細胞的急性饑餓和隨后在癌癥和正常細胞之間的差異應激致敏。體外和細胞試驗驗證了該策略具有“1+1>2”的抗腫瘤作用
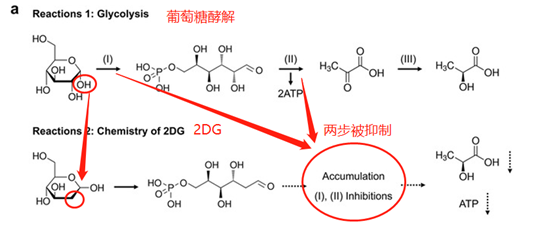
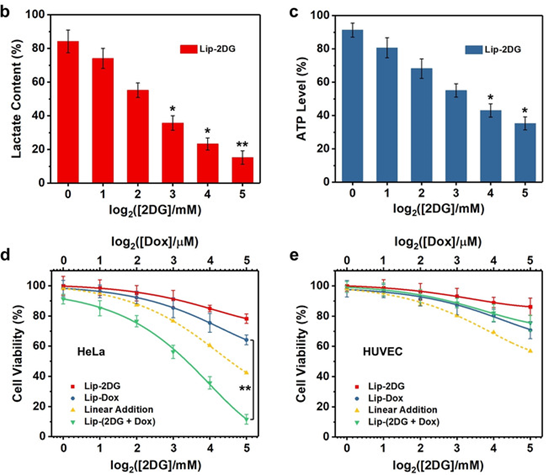
圖2. 糖酵解抑制和差異應激致敏
線粒體對化療的敏感性
為了進一步研究Lip-(2DG + Dox)的差異應激敏化作用的機制,研究人員進一步研究了糖酵解后指導癌細胞死亡的細胞途徑。研究人員假設Lip-(2DG + Dox)組的超加性細胞毒性可能與糖酵解抑制后線粒體促凋亡途徑的激活有關。線粒體跨膜電位(ΔΨm)是線粒體的一個顯著特征,反映了它們的超極化或去極化。
因動態過程無法使用斯特方程計算ΔΨm,研究人員使用了5,5',6,6'-四氯-1,1',3,3'-四乙基苯并咪唑并咔啉氰化碘(JC-1)(一種J聚集形成的離域親脂性陽離子)作為電位探針來半定量ΔΨm。細胞實驗結果表明:糖酵解抑制作用可能導致線粒體超極化(圖3 c中的途徑1)。常規化學療法可以觸發線粒體去極化,從而促進細胞凋亡(途徑2)。而對于結合組,由2DG觸發的前者超極化(即敏化狀態)有利于由Dox激活的后者超極化(激活狀態),最終導致更明顯的線粒體通透性轉變(途徑3)。
ΔΨm高的線粒體超極化可延長電子轉移反應中間體在能夠單電子還原O2的位點的半衰期,從而使電子逸出以產生超氧陰離子(O2.?),從而通過增強癌細胞中的應激敏感性來增強Dox的化療功效。研究人員使用DHE檢測O2.?進行驗證,結果表明2DG和具有Dox的氧化還原循環導致的線粒體超極化是兩條平行的O2.?生成途徑,并且可能與其他有利于最終線粒體失能的途徑協同作用。
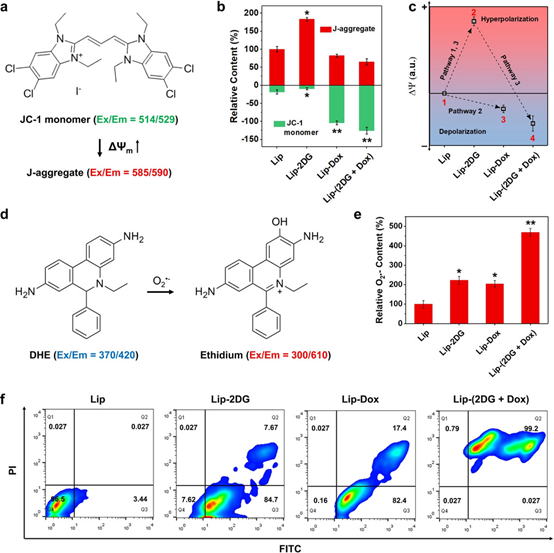
圖3. 線粒體對化療的敏感性
體內差異化療效果
在體內試驗中,同樣證明了體內饑餓和化療之間的協同作用,有利于體內額外的抗腫瘤作用。而且還證明了這種治療方法的高度生物安全性。
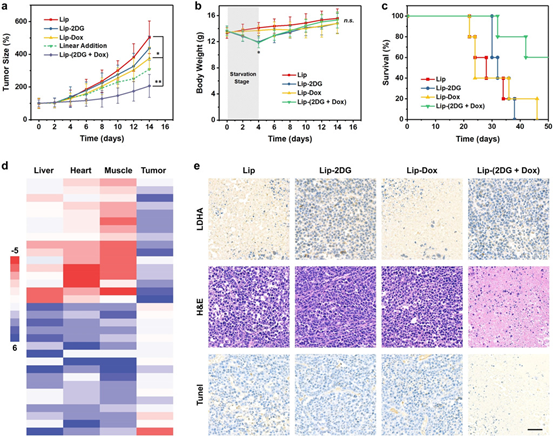
圖4.體內試驗
小結:
總而言之,這種經過工程改造的納米系統已經實現了顯著改善的治療效果,減輕了的副作用以及體內明顯的轉移抑制,除了廣泛研究的Doxil的批準的生物安全性外,還具有很高的轉化潛力。通過在正常細胞中選擇性地提供保護,而不是通過化學藥物對惡性細胞的常規毒性增強,這種差異應激敏化策略提供了一種增強癌癥治療的有前景的方法,這可能對未來的納米藥物設計非常有益。
參考文獻:
Yang,B., Chen, Y. and Shi, J. (2020), Tumor‐Specific Chemotherapy byNanomedicine‐Enabled Differential Stress Sensitization.Angew. Chem. Int. Ed..
DOI:10.1002/anie.202002306
https://doi.org/10.1002/anie.202002306











