大家好,新的一期頂刊趨勢又來了,在往期的頂刊趨勢,我們針對生物(納米)材料的增強(qiáng)氧化應(yīng)激、光學(xué)治療、納米轉(zhuǎn)變、癌癥疫苗、口服藥物、骨再生等等相關(guān)領(lǐng)域進(jìn)行歸納。
今天奇物論編輯部為大家?guī)淼氖墙陉P(guān)于一氧化氮在生物醫(yī)學(xué)領(lǐng)域應(yīng)用的相關(guān)研究,供大家學(xué)習(xí)和交流。如有想推薦的領(lǐng)域,可在后臺(tái)對編輯部提供建議,我們會(huì)對推薦的內(nèi)容進(jìn)行酌情安排。
(注:由于學(xué)識(shí)有限,如有漏選或錯(cuò)選,懇請批評指出)
前言:
1998年,諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)授予三名美國科學(xué)家Robert F. Furchgott、Louis J. Ignarro和Ferid Murad,表彰他們在“一氧化氮作為心血管系統(tǒng)的信號(hào)分子”上的發(fā)現(xiàn),這引起了生命科學(xué)領(lǐng)域?qū)O的生物效應(yīng)及其作用機(jī)制的高度關(guān)注。

NO是人體內(nèi)活躍的具有多種生物學(xué)活性的小分子物質(zhì),研究證實(shí),NO是心血管系統(tǒng)中至關(guān)重要的信號(hào)分子,也參與神經(jīng)細(xì)胞間的信號(hào)轉(zhuǎn)導(dǎo)、免疫系統(tǒng)的炎癥反應(yīng)、組織再生等等。
除此之外,研究還表明其在多種腫瘤組織內(nèi)表達(dá)。高濃度的NO可以介導(dǎo)腫瘤細(xì)胞的凋亡和抑制腫瘤生長;相對低濃度的NO可促使腫瘤生長和腫瘤細(xì)胞增殖,并可以使腫瘤細(xì)胞增強(qiáng)對放療和某些化療藥物的耐受性。NO對腫瘤生長的雙向調(diào)節(jié)作用為腫瘤的研究提供了一個(gè)新的方向。
在此,奇物論編輯部總結(jié)了近期有關(guān)NO在生物醫(yī)學(xué)領(lǐng)域應(yīng)用的部分研究成果,供大家學(xué)習(xí)交流。
1. Adv. Mater.:腫瘤光穿透差?試試無線充電
傳統(tǒng)的光療法面臨著光穿透不足,難以到達(dá)深部病灶的問題,這大大降低了癌癥治療的可行性。于此,武漢大學(xué)張先正教授等人開發(fā)了一種可植入的一氧化氮(NO)釋放裝置,以實(shí)現(xiàn)對癌癥的長期、遠(yuǎn)距離、遠(yuǎn)程可控氣體治療。1)該裝置由一個(gè)無線供電的發(fā)光二極管(wLED)和用聚二甲基硅氧烷(PDMS)包裹的S-亞硝基谷胱甘肽組成,從而獲得NO釋放wLED(NO-wLED)。2)研究發(fā)現(xiàn),無線充電可以觸發(fā)NO-wLED釋放NO,產(chǎn)生的NO濃度達(dá)到0.43×10-6 m min-1,這可以實(shí)現(xiàn)對癌細(xì)胞的殺傷作用。3)體內(nèi)抗癌實(shí)驗(yàn)表明,當(dāng)植入的NO-wLED通過無線充電輻照時(shí),原位癌的生長表現(xiàn)出明顯的抑制作用。此外,手術(shù)后NO-wLED產(chǎn)生的NO可以預(yù)防癌癥的復(fù)發(fā)。 通過體內(nèi)照明,該策略克服了傳統(tǒng)光療法穿透力差、波長依賴性大的缺點(diǎn),這也為通過無線充電遠(yuǎn)程控制的體內(nèi)氣體療法提供了一種有前景的方法。
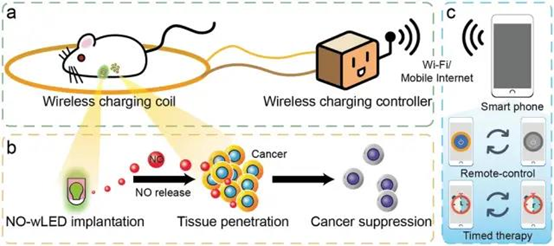
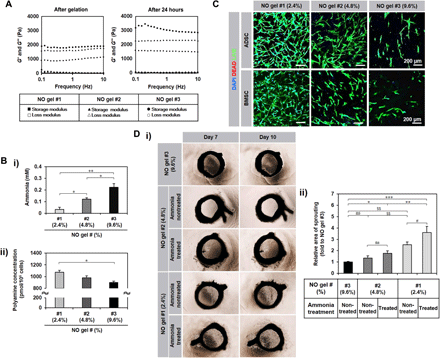
Li,B., et al., Nitric Oxide Release Device for Remote‐ControlledCancer Therapy by Wireless Charging. Adv. Mater. 2020, 2000376.https://doi.org/10.1002/adma.2020003762. ScienceAdvances:一氧化氮水凝膠揭示血管生成機(jī)制內(nèi)皮細(xì)胞(ECs)中一氧化氮(NO)的產(chǎn)生會(huì)促進(jìn)血管生成。盡管人類間充質(zhì)干細(xì)胞(hMSCs)的促血管生成作用已被廣泛研究,但NO在這一作用中的機(jī)制仍不清楚。于此,韓國延世大學(xué)醫(yī)學(xué)院Hak-Joon Sung等人使用一種明膠水凝膠,通過谷氨酰胺轉(zhuǎn)胺酶反應(yīng)交聯(lián)后釋放NO(NO-gel)。1)在NO凝膠中監(jiān)測骨髓來源的hMSCs(BMSCs)與脂肪來源的hMSCs(ADSCs)的來源特異性行為。NO抑制導(dǎo)致其血管生成活性顯著降低。2)與ADSCs的內(nèi)皮細(xì)胞分化相比,NO-gel誘導(dǎo)的BMSCs周細(xì)胞樣特征,(BMSCs對比ADSCs)特征表現(xiàn)為管穩(wěn)定對比管形成、3D共定位對比2D共形成的EC管網(wǎng)絡(luò)、凝膠塞中周細(xì)胞樣傷口愈合對比EC樣血管生成、周細(xì)胞對比EC標(biāo)志物生成。這些結(jié)果為NO在調(diào)節(jié)hMSC來源特異性血管生成機(jī)制中的作用及其治療應(yīng)用提供了以前未知的見解。
KangM-L, et al. Hydrogel cross-linking–programmed release of nitricoxide regulates source-dependent angiogenic behaviors of human mesenchymal stemcell. Science Advances. 2020;6(9):eaay5413.DOI:10.1126/sciadv.aay5413https://advances.sciencemag.org/content/6/9/eaay54133. ACS Nano:表面電荷可變的超分子納米載體用于NO-光動(dòng)力協(xié)同清除生物膜生物膜會(huì)導(dǎo)致許多頑固性的臨床感染,從而對公共健康產(chǎn)生嚴(yán)重威脅。浙江大學(xué)金橋和計(jì)劍等人開發(fā)了一種表面電荷可變的超分子納米載體,該載體具有pH響應(yīng)性穿透酸性生物膜的能力,因此能夠利用一氧化氮(NO)-光動(dòng)力協(xié)同消除耐甲氧西林金黃色葡萄球菌(MRSA)的生物膜,并且在激光照射下對健康組織不會(huì)造成嚴(yán)重?fù)p傷。1)實(shí)驗(yàn)將對谷胱甘肽(GSH)敏感的α-環(huán)糊精(α-CD)與一氧化氮(NO)藥物前體和Ce6藥物前體進(jìn)行共軛以得到α-CD-NO和 α-CD-Ce6,隨后將它們與對pH敏感的聚乙二醇(PEG)嵌段多肽共聚物(PEG-(KLAKLAK)2-DA)進(jìn)行集成,得到超分子納米載體α-CD-Ce6-NO-DA。2)該超分子納米載體的表面電荷會(huì)從生理pH值下的負(fù)電荷轉(zhuǎn)變?yōu)樗嵝陨锬H值下正電荷,從而有效滲透生物膜。而當(dāng)納米載體一旦滲透到生物膜中,生物膜中過表達(dá)的谷胱甘肽會(huì)引發(fā)NO的快速釋放,進(jìn)而殺滅細(xì)菌和降低生物膜的谷胱甘肽的水平,因此也能提高光動(dòng)力治療(PDT)的效率。3)另一方面,NO也可以與活性氧(ROS)反應(yīng)生成活性氮(RNS)來進(jìn)一步增強(qiáng)PDT效果。因此這一研究也為開發(fā)協(xié)同性策略對抗生物膜感染提供了一個(gè)新的策略。
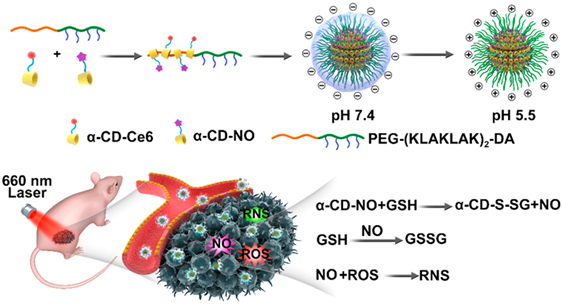
DengfengHu, et al. Surface Charge Switchable SupramolecularNanocarriers for Nitric Oxide Synergistic Photodynamic Eradication ofBiofilms. ACS Nano. 2020DOI:10.1021/acsnano.9b05493https://pubs.acs.org/doi/10.1021/acsnano.9b054934. ACSNano:包覆亞硝基化前藥的納米顆粒用于增強(qiáng)放射治療放療仍然是目前治療非小細(xì)胞肺癌(NSCLC)等癌癥的主要方式之一。為了提高給定的輻射劑量下的治療效果,人們往往在放療期間使用放療增敏劑。吉林大學(xué)中日聯(lián)誼醫(yī)院馬慶杰教授、佐治亞大學(xué)謝晉教授和AnilKumar教授等人制備了一種納米粒子試劑,它可以選擇性地使癌細(xì)胞對放療更加敏感。實(shí)驗(yàn)首先對將maytansinoidDM1進(jìn)行亞硝基化,然后將產(chǎn)生的前藥DM1- NO負(fù)載到PLGA-b-PEG納米顆粒上。1)DM1的毒性可被納米顆粒的包封和亞硝基化抑制,并通過EPR作用被遞送到腫瘤中。在放療照射下,腫瘤內(nèi)的氧化應(yīng)激水平會(huì)升高,導(dǎo)致S-N鍵發(fā)生斷裂,進(jìn)而釋放DM1和一氧化氮(NO)。2)釋放的DM1會(huì)抑制微管聚合,使得細(xì)胞對于輻射更加敏感。而NO也會(huì)在輻射下形成高毒性的自由基,進(jìn)一步抑制腫瘤的生成。體內(nèi)外實(shí)驗(yàn)結(jié)果表明,該納米粒子可通過兩種成分的協(xié)同作用顯著地提高和增強(qiáng)放療效果。
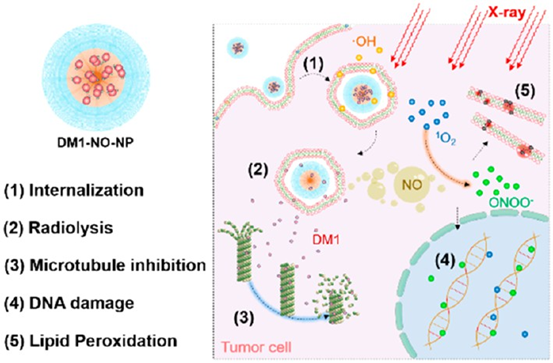
Shi Gao, et al. Nanoparticles EncapsulatingNitrosylated Maytansine To Enhance Radiation Therapy. ACS Nano. 2020DOI:10.1021/acsnano.9b05976http://pubs.acs.org/doi/doi/10.1021/acsnano.9b059765. ACS Nano:近紅外光觸發(fā)一氧化氮增強(qiáng)光動(dòng)力療法和低溫光熱療法去除生物膜光熱治療(PTT)涉及多種治療方式的組合,是最近出現(xiàn)的對抗生物膜的有效替代方法。然而,與PTT相關(guān)的局部高溫可能會(huì)破壞周圍的健康組織。有鑒于此,重慶大學(xué)的蔡開勇、劉鵬等研究人員,提出了一種由l-精氨酸(l-Arg)、吲哚菁綠(ICG)和介孔聚多巴胺(MPDA)組成的一體化光治療納米平臺(tái),即AI-MPDA,以消除已經(jīng)形成的生物膜。1)制備過程包括用l-精氨酸對MPDA進(jìn)行表面修飾,并通過π-π堆積進(jìn)一步吸附ICG。在近紅外(NIR)照射下,MPDA不僅產(chǎn)生熱量,而且產(chǎn)生活性氧,導(dǎo)致左旋精氨酸的級(jí)聯(lián)催化釋放一氧化氮。2)在NIR輻射下,生物膜的消除歸因于一氧化氮增強(qiáng)的光動(dòng)力療法和低溫PTT(45℃)。值得注意的是,近紅外觸發(fā)的一體化策略導(dǎo)致了細(xì)菌膜的嚴(yán)重破壞。光熱治療MPDA也顯示出良好的細(xì)胞相容性。3)經(jīng)近紅外輻射的MPDA納米粒子不僅能防止細(xì)菌定植,還能實(shí)現(xiàn)感染傷口的快速恢復(fù)。更重要的是,一體化光療平臺(tái)在膿腫形成模型中顯示了約100%的有效生物膜消除效率。總的來說,這個(gè)低溫光療平臺(tái)為臨床應(yīng)用中對抗已經(jīng)形成的生物膜提供了一個(gè)可靠的工具。
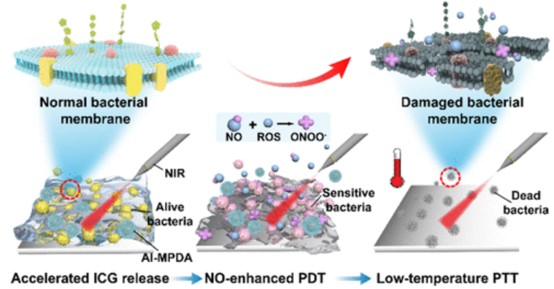
Zhang Yuan, et al. Near-Infrared Light-Triggered Nitric-Oxide-Enhanced PhotodynamicTherapy and Low-Temperature Photothermal Therapy for Biofilm Elimination. ACSNano, 2020.DOI:10.1021/acsnano.9b09871https://pubs.acs.org/doi/abs/10.1021/acsnano.9b098716. Small:工程化2D介孔二氧化硅@MXene集成3D打印支架用于骨肉瘤聯(lián)合治療和NO增強(qiáng)骨再生隨著惡性骨腫瘤手術(shù)治療中復(fù)發(fā)和骨缺損問題的日益突出,迫切需要研制多功能的治療平臺(tái),以實(shí)現(xiàn)高效的腫瘤治療和骨再生。在此,中國科學(xué)院上海硅酸鹽研究所陳雨、上海交通大學(xué)Changqing Zhang、Youshui Gao等人報(bào)道了將包裹S-亞硝基硫醇(R-SNO)的2DNb2C MXene接枝介孔二氧化硅,與3D打印的生物活性玻璃(BG)支架(MBS)集成,構(gòu)建多功能生物材料系統(tǒng)。1)近紅外(NIR)觸發(fā)MXene在NIR-II生物窗口中的光子熱療與精確控制的一氧化氮(NO)釋放相配合,用于骨腫瘤的多靶點(diǎn)消融,以加強(qiáng)局部骨肉瘤的治療。2)從BG支架中降解的原位形成的磷和鈣成分促進(jìn)了骨再生生物活性,并通過按需釋放NO而增加了充足的血液供應(yīng)。可調(diào)節(jié)的NO生成在序貫輔助腫瘤消融、聯(lián)合促進(jìn)偶聯(lián)血管形成和骨再生中起著至關(guān)重要的作用。3)這項(xiàng)研究證實(shí)了通過植入MBS來實(shí)現(xiàn)一種聯(lián)合的骨肉瘤消融和完全的骨再生。多功能支架的設(shè)計(jì)具有NO釋放可控、光熱轉(zhuǎn)化效率高、促進(jìn)骨再生等特點(diǎn),為骨腫瘤的多樣化治療提供了一個(gè)頗具吸引力的生物材料平臺(tái)。

QianhaoYang, et al. Engineering 2D Mesoporous Silica@MXene‐Integrated3D‐Printing Scaffolds for Combinatory OsteosarcomaTherapy and NO‐Augmented Bone Regeneration, Small,2020.DOI:10.1002/smll.201906814https://doi.org/10.1002/smll.2019068147. Biomaterials:兩步序貫給藥,增強(qiáng)納米粒子穿透!豐富的促結(jié)締組織增生性間質(zhì),通常存在于胰腺導(dǎo)管腺癌(PDAC)中,作為天然的保護(hù)性物理屏障,導(dǎo)致藥物輸送和滲透不足。為了解決這個(gè)問題,浙江大學(xué)金橋、Weifeng Liu等人在此報(bào)告一種兩步序貫給藥策略,用于增強(qiáng)胰腺癌治療。1)在這一序貫策略中,首先將一氧化氮(NO)供體S-亞硝基-N-乙酰青霉胺(SNAP)負(fù)載膠束(Lip-SNAP)輸送到腫瘤組織中的胰腺星狀細(xì)胞(PSCs),通過抑制TGF-β1的表達(dá)及其下游促纖維化信號(hào)轉(zhuǎn)導(dǎo)來抑制致密間質(zhì)的產(chǎn)生。因此,可以通過抑制纖維連接蛋白、α-SMA和膠原的表達(dá)來抑制PSC介導(dǎo)的促結(jié)締組織增生反應(yīng)。2)隨后給予吉西他濱(GEM)負(fù)載脂質(zhì)體(Lip-GEM),由于NO治療導(dǎo)致間質(zhì)破壞,Lip-GEM的瘤內(nèi)穿透性得到增強(qiáng),從而顯著提高了藥物的輸送效率。3)研究了Lip-SNAP和Lip-GEM兩步序貫給藥對荷瘤小鼠皮下和原位腫瘤生長的抑制作用,結(jié)果表明GEM具有顯著的治療效果。這種NO誘導(dǎo)的間質(zhì)耗竭為克服促結(jié)締組織增生性間質(zhì)對其他治療藥物的阻塞提供了一種策略。

Xiaohui Chen, et al. Nitric oxide-induced stromal depletion for improvednanoparticle penetration in pancreatic cancertreatment, Biomaterials, 2020.https://doi.org/10.1016/j.biomaterials.2020.119999