水凝膠(Hydrogel),簡單來說就是以水為分散介質的凝膠。一般是具有網狀交聯結構的水溶性高分子中引入一部分疏水基團和親水殘基,親水殘基與水分子結合,將水分子連接在網狀內部,而疏水殘基遇水膨脹的交聯聚合物。主要特點為柔軟,能保持一定的形狀,能吸收大量的水。
1894年,“水凝膠”一詞首次出現在文獻中,經過一百多年的發展,水凝膠的熱度不僅沒有被時間淹沒,反而隨著被越來越多的研究而更受關注,到如今水凝膠早已經進入“智能時代”,人們對它們的了解和應用更進一步。
在此,納米人聯合奇物論編輯部精選2篇Nature,1篇Science和17篇NS子刊,帶領大家感受水凝膠到底有多神奇!
1. Science:可編程的CRISPR響應智能材料
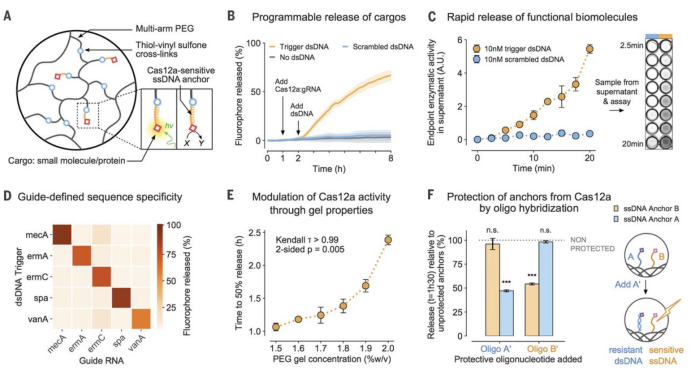
生物信號激活的刺激響應材料在生物技術應用中發揮著越來越重要的作用。有鑒于此,美國麻省理工學院James J. Collins等人利用CRISPR相關核酸酶的可編程性來驅動含有DNA的水凝膠,將其作為結構元件。RNA可以特異性識別外源DNA,激活Cas12a 在凝膠中切割DNA,從而將生物信息轉化為材料性質的變化。作者報道了四類應用: (i)多臂聚乙二醇水凝膠釋放負載DNA的化合物;(ii)可降解的聚丙烯酰胺-DNA水凝膠封裝納米顆粒和活細胞;(3)導電炭黑-DNA水凝膠作為可降解電氣保險絲;(iv) 聚丙烯酰胺-DNA水凝膠作為流體閥,用于遠程信號的電子讀出裝置。這些材料可以應用在組織工程、生物電子學和體外診斷等領域。
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helenade Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J.Collins. Programmable CRISPR-responsive smart materials. Science. 2019DOI:10.1126/science.aaw5122https://science.sciencemag.org/content/365/6455/780
2. Nature:干式雙面膠帶用于粘接濕組織和植入設備
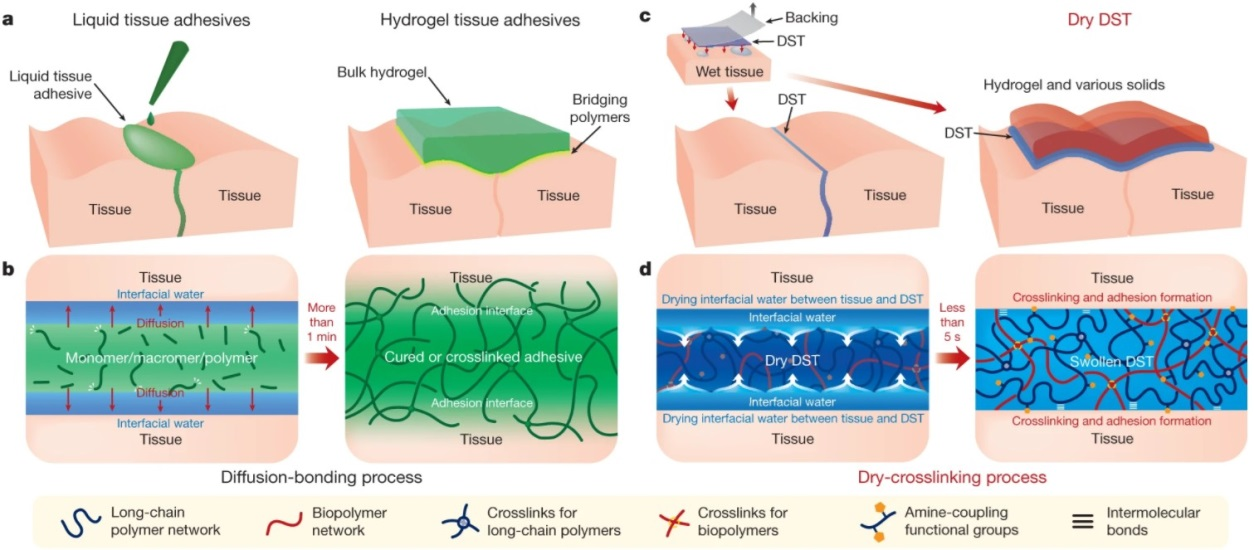
通過分子間的作用力,如氫鍵、靜電相互作用和范德華相互作用,兩個干燥的表面可以瞬間附著在一起。然而,當涉及到身體組織等濕表面時,這種瞬間粘附是具有挑戰性的,因為水將兩個表面的分子分開,阻止了相互作用。雖然與縫合或吻合術相比,組織粘接劑具有潛在的優勢,但現有的液體或水凝膠組織粘接劑存在著粘接力弱、生物相容性差、與組織機械匹配差、粘接形成緩慢等缺陷。近日,美國麻省理工學院趙選賀研究小組,開發出一種替代的組織粘合劑,其形式為干式雙面膠帶(DST),由生物聚合物(明膠或殼聚糖)和接枝有N-氫琥珀酰亞胺酯的交聯聚丙烯酸組成。這種DST的粘附機制取決于從組織表面去除界面水,從而導致與表面的快速臨時交聯。隨后與組織表面上的胺基進行共價交聯進一步改善了DST的粘附穩定性和強度。體外小鼠、體內大鼠和體外豬模型表明,DST可以在五秒鐘內在各種濕動態組織和工程固體之間實現強力粘附。DST可用作組織粘合劑和密封劑,以及將可穿戴和可植入設備粘附到濕組織上。
Hyunwoo Yuk, Claudia E. Varela, Christoph S. Nabzdyk, et al.Dry double-sided tape for adhesion of wet tissues and devices. Nature, 2019.DOI: https://doi.org/10.1038/s41586-019-1710-5https://www.nature.com/articles/s41586-019-1710-5
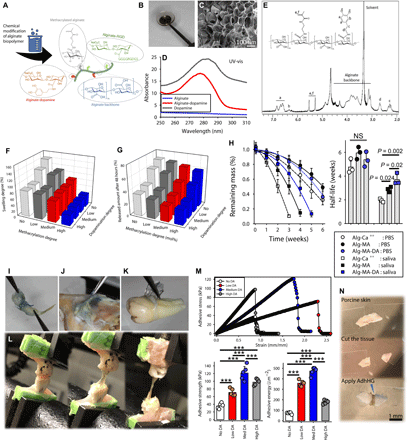
3. Nat.Commun.:發揮納米顆粒形狀在增強水凝膠粘合性和機械性能方面的作用
控制納米結構形狀和尺寸的能力為設計宏觀性能取決于納米顆粒的性質的材料提供了機會。盡管顆粒形態已被認為是至關重要的參數,但迄今為止,對潛在的形狀依賴性特性的研究受到了限制。近日,伯明翰大學Rachel K. O’Reilly,AndrewP. Dove,Maria C. Arno等證明了納米顆粒的形狀是確定納米復合水凝膠性能的關鍵因素。1)使用海藻酸鈣水凝膠,作者發現使用具有血小板形狀的聚(L-丙交酯)基納米顆粒作為粘合劑比使用由球形或圓柱形膠束組成的納米顆粒粘合劑的粘合性要顯著增強。2)此外,與它們的球形和圓柱形對應物相比,含有血小板形莊的凝膠納米復合材料在應變作用下顯示出增強的抗斷裂性。該工作為納米顆粒的形狀在調節機械性能方面起著重要作用的凝膠納米復合材料領域的方向變化打開了大門。

Maria C. Arno, et al. Exploiting the role of nanoparticleshape in enhancing hydrogel adhesive and mechanical properties. Nat.Commun. 2020,DOI: 10.1038/s41467-020-15206-yhttps://www.nature.com/articles/s41467-020-15206-y
4. ScienceTranslational Medicine:載細胞工程水凝膠促進大鼠顱面骨組織再生
載有細胞的水凝膠廣泛用于組織工程和再生醫學。但是,這些水凝膠中有許多并未針對在暴露于血液和唾液的口腔環境中進行優化。為了解決這些挑戰,加州大學洛杉磯分校Alireza Moshaverinia和Tara Aghaloo等人設計了一種具有可調機械性能的海藻酸鈉基粘合劑、光交聯和骨導電水凝膠生物材料(AdhHG)。1) 工程水凝膠作為可注射間充質干細胞(MSC)載體應用于顱面骨組織工程。小鼠皮下植入證實了水凝膠的生物降解性、生物相容性和骨傳導性。2) 在成熟的大鼠種植體周圍炎模型中,應用包裹牙齦間充質干細胞(GMSCs)的粘合水凝膠,可使種植體周圍的骨完全再生,并伴有種植體周圍的骨丟失。總而言之,研究人員已經開發出一種獨特的生物啟發性粘附水凝膠,具有可調的機械性能和生物降解性,能夠有效地傳遞患者來源的牙科MSCs。水凝膠是光交聯的,并且由于存在MSC聚集體和羥基磷灰石微粒,可促進顱面組織工程應用中的骨再生。
Hasani-Sadrabadi MM, et al. An engineered cell-ladenadhesive hydrogel promotes craniofacial bone tissue regeneration in rats.Science Translational Medicine. 2020;12(534):eaay6853.
https://doi.org/10.1126/scitranslmed.aay6853
5. Science Advances:一氧化氮水凝膠揭示血管生成機制
內皮細胞(ECs)中一氧化氮(NO)的產生會促進血管生成。盡管人類間充質干細胞(hMSCs)的促血管生成作用已被廣泛研究,但NO在這一作用中的機制仍不清楚。于此,韓國延世大學醫學院Hak-Joon Sung等人使用一種明膠水凝膠,通過谷氨酰胺轉胺酶反應交聯后釋放NO(NO-gel)。1)在NO凝膠中監測骨髓來源的hMSCs(BMSCs)與脂肪來源的hMSCs(ADSCs)的來源特異性行為。NO抑制導致其血管生成活性顯著降低。 2)與ADSCs的內皮細胞分化相比,NO-gel誘導的BMSCs周細胞樣特征,(BMSCs對比ADSCs)特征表現為管穩定對比管形成、3D共定位對比2D共形成的EC管網絡、凝膠塞中周細胞樣傷口愈合對比EC樣血管生成、周細胞對比EC標志物生成。這些結果為NO在調節hMSC來源特異性血管生成機制中的作用及其治療應用提供了以前未知的見解。
Kang M-L, et al. Hydrogel cross-linking–programmed release of nitric oxide regulates source-dependentangiogenic behaviors of human mesenchymal stem cell. Science Advances.2020;6(9):eaay5413.DOI: 10.1126/sciadv.aay5413https://advances.sciencemag.org/content/6/9/eaay5413
6. 趙選賀&臧劍鋒等Nat. Commun.:納米晶排排隊,水凝膠實現抗疲勞粘連
在許多動物的骨骼上,軟結締組織(肌腱、韌帶和軟骨)的粘附可以在數百萬次機械載荷循環中保持高韌性(∽800Jm?2)。但合成水凝膠與工程材料之間尚未實現這種抗疲勞粘連,但對于各種應用(如人造軟骨和肌腱、堅固的防污涂層和水凝膠機器人)來說,是非常需要這種抗疲勞粘連的。有鑒于此,受肌腱/韌帶/軟骨和骨骼之間納米結構界面的啟發,麻省理工學院趙選賀和華中科技大學臧劍鋒等人將合成水凝膠的有序納米晶結構域結合到工程材料上,由此產生抗疲勞的粘合,界面疲勞閾值為800Jm?2,這是因為與無定形聚合物鏈相比,界面處的疲勞裂紋擴展需要更高的能量來破壞有序的納米結構。1)通過標準的90°剝離測試表明,水凝膠和基底之間產生顯著的抗疲勞粘連,界面疲勞閾值為800 J m-2。2)研究人員通過表面掠入射小角X射線散射試驗和全原子分子動力學(MD)模擬,表明在界面上和整體水凝膠內部引入納米晶域可協同確保水凝膠-固體界面具有極高的抗疲勞性。3)該方法可以在具有復雜幾何形狀的多種工程材料上制備抗疲勞水凝膠涂層。而且進一步證明,抗疲勞水凝膠涂層對天然軟骨表現出低摩擦和低磨損。
Liu, J., et al. Fatigue-resistant adhesion of hydrogels. NatCommun 11, 1071 (2020).
https://doi.org/10.1038/s41467-020-14871-3
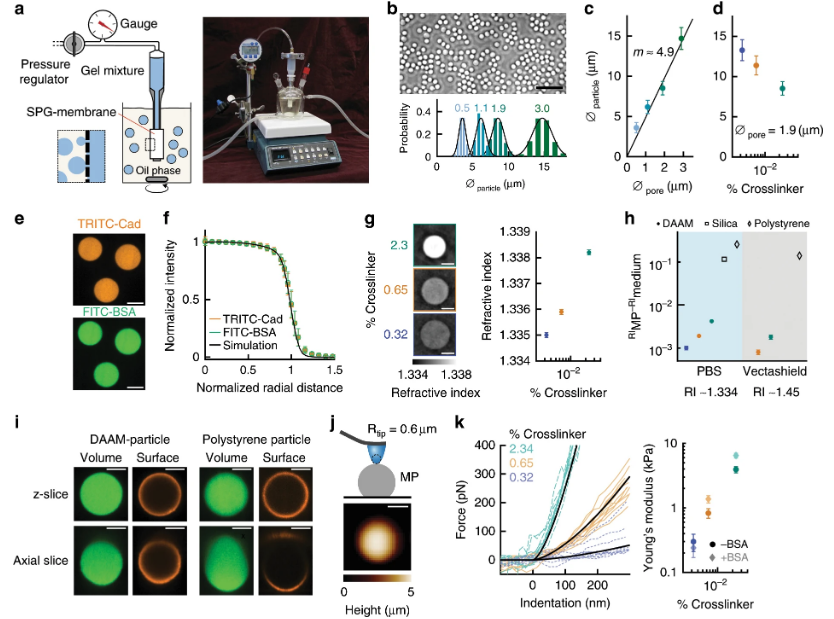
7. Nat.Commun.:微粒牽引力顯微鏡揭示亞細胞力的作用模式
力的施加是細胞行為的一個組成部分。牽引力顯微鏡(TFM)已經成為研究這種力的工具,提供了亞細胞分辨率的空間力測量。然而,傳統的TFM的應用受到典型平面幾何的限制。于此,斯坦福大學Julie A. Theriot等人開發了一種基于粒子的力傳感策略來研究細胞間的相互作用。研究人員建立了一個簡單的批量合成方法,用于合成均勻、可變形和可調節的水凝膠粒子。這種粒子的三維形狀可以用常規共焦顯微鏡以超分辨率(<50nm)的精度來分辨。研究人員引入了一種暫無參考的計算方法,該方法可以直接從粒子形狀推斷出具有高靈敏度的牽引力。通過揭示在吞噬細胞的吞噬和細胞毒性T細胞免疫突觸的力動態的亞細胞力模式,說明了這種方法具有很大的應用潛力。該策略可以很容易地適用于研究廣泛應用中的細胞力。
Vorselen, D., Wang, Y., de Jesus, M.M. etal. Microparticle traction force microscopy reveals subcellular forceexertion patterns in immune cell–targetinteractions. Nat Commun 11, 20(2020)doi:10.1038/s41467-019-13804-zhttps://doi.org/10.1038/s41467-019-13804-z
8. NatureNanotech.:揭示細胞外囊泡穿過細胞外基質的機制
細胞釋放細胞外囊泡(EVs)進行遠距離通訊,這需要EVs穿過細胞外基質(ECM)。然而,鑒于EVs的尺寸通常大于ECM的網格尺寸,因此不清楚它們如何穿過致密的ECM。于此,伊利諾伊大學芝加哥分校Jae-Won Shin等人表明,與合成納米粒子相比,EVs很容易通過納米多孔ECM進行轉運。1) 通過使用工程水凝膠,研究人員證明基質的機械性能會在限制條件下調節異常的EVs轉運。基質應力松弛允許EVs克服限制,并且更高的交聯密度會促進通過聚合物網的波動轉運運動,這導致自由擴散和快速傳輸。2) 此外,通過水通道蛋白-1的水滲透介導EV的可變形性,這會進一步輔助水凝膠和脫細胞基質中的EV轉運。3) 該研究可以告知治療性EV如何被潛在地修飾,以更好地促進它們通過組織ECM的遞送。綜上所述,該結果描述了EV在沒有基質降解的情況下在聚合物基質中轉運的能力,盡管EV大于基質的平均網格尺寸。基質應力松弛使EV容易逃逸由聚合物網絡形成的籠子。該研究結果為受限環境中EV運輸的性質提供了證據,并證明了對基質力學和水滲透的依賴性,為ECM中發生的EV轉運行為開辟了新的研究途徑。
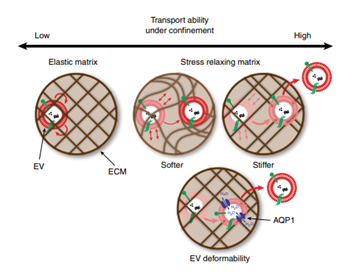
Lenzini, S., Bargi, R., Chung, G. et al. Matrixmechanics and water permeation regulate extracellular vesicletransport. Nat. Nanotechnol. (2020).https://doi.org/10.1038/s41565-020-0636-2
9. Science Advances:光降解水凝膠作為胃腸道應用的動態觸發器
能夠被選擇性刺激降解的可觸發材料將改變我們精確控制生物醫學設備活動和性能的能力,同時減少對侵入性干預的需求。于此,麻省理工學院Giovanni Traverso等人描述了模塊化和可調光觸發水凝膠系統的開發,該系統能夠與可植入設備連接。研究人員將這些材料應用于胃腸道(GI)的兩種應用:減肥球囊和食道支架。展示了該材料在體外、離體和體內的生物相容性和按需觸發。此外,研究人員通過在一個帶有可食LED的大型動物豬模型中表明了該系統的性能。可光觸發的水凝膠具有在胃腸道和其他解剖區域廣泛應用的潛力。通過演示體內可光降解水凝膠的首次使用,該團隊為生物醫學工程師和臨床醫生提供了以前無法獲得的、安全的、可動態遞送的精確工具,以設計可動態驅動的可植入設備。
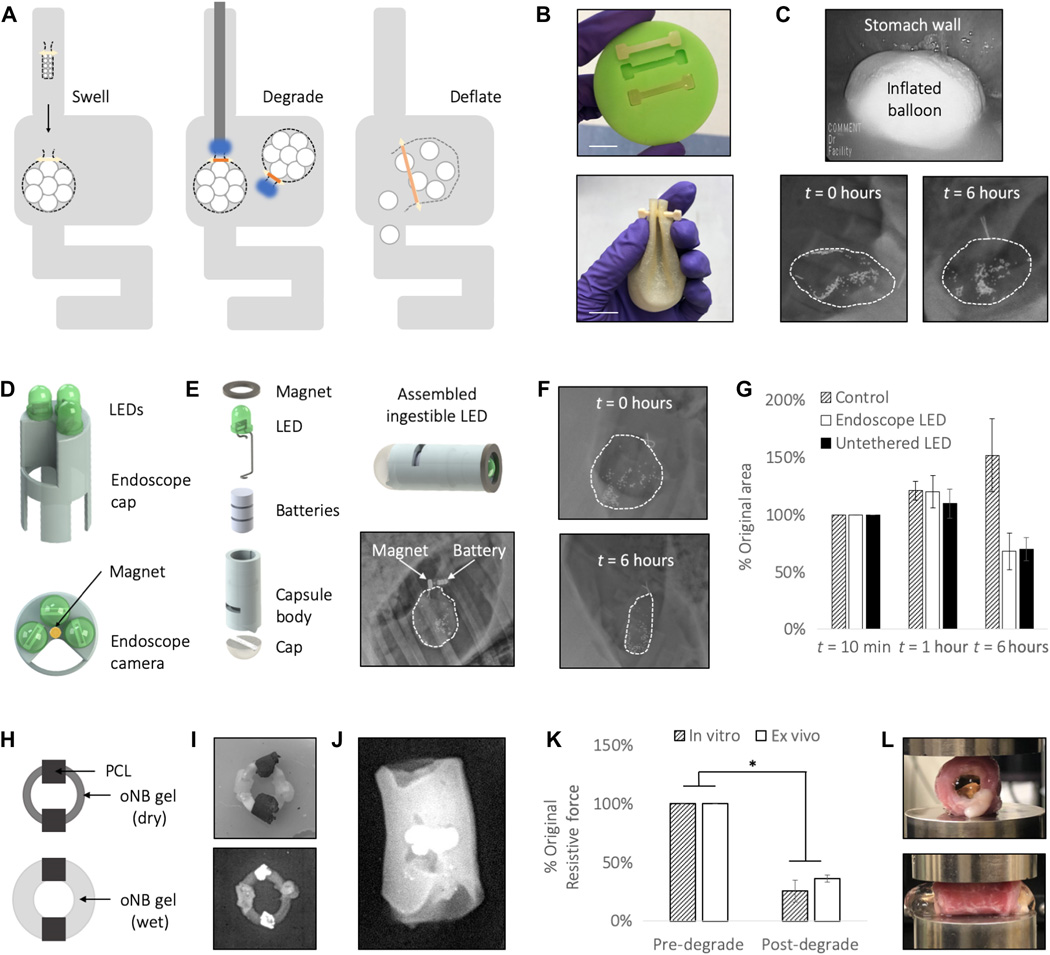
Raman R, Hua T, Gwynne D, Collins J, Tamang S, Zhou J, etal. Light-degradable hydrogels as dynamic triggers for gastrointestinalapplications. Science Advances. 2020;6(3):eaay0065.
https://advances.sciencemag.org/content/6/3/eaay0065
10. 江雷/聞利平Nat. Commun.:仿生水凝膠多孔納米膜,高效率收集藍色能源!
海水和淡水之間的離子梯度所產生的滲透能,被認為是一種極具前景的可再生能源。然而,由于目前所使用離子交換膜界面遷移效率低,最終導致能源效率極為低下。有鑒于此,中科院理化所江雷院士和聞利平研究員等人受到鰻魚等自然界的啟發,并結合納米流體的優勢,首次報道了一種基于水凝膠的多孔納米流體膜,可以高效率收集這種藍色能源。這項工作證明了聚電解質凝膠作為高性能界面材料在非均相滲透發電領域的巨大前景。1)首次使用三維水凝膠界面膜來實現滲透能的高效轉化。通過澆鑄法,將功能性聚電解質水凝膠膜和支撐性多孔芳香納米纖維膜組合在一起,最終得到有機非均相復合膜。2)體系中固有的結構和電學、化學性質,確保穩定的離子二極管效應,極大地促進了陽離子從納米纖維層到水凝膠層的傳輸;水凝膠膜提供了廣闊的帶電3D網絡用于離子擴散,可大大提高界面傳輸效率,這為鹽度梯度發電提供了可能。3)當將天然海水和河水混合時,功率輸出可以達到約5.06 W m?2的極高值,其性能優于目前報道的最好的膜。
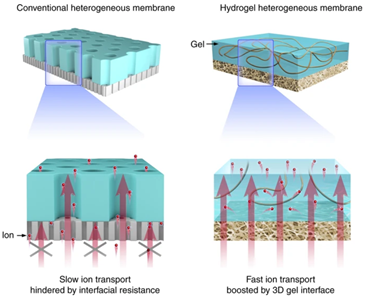
Zhen Zhang et al. Improved osmotic energy conversion inheterogeneous membrane boosted by three-dimensional hydrogel interface. NatureCommunications 2020.https://www.nature.com/articles/s41467-020-14674-6
11. Nat.Commun.:構建環狀工程心臟組織
心臟的功能是通過協調不同的心臟細胞亞型(如心室、心房、傳導組織心肌細胞)來實現的。人多能干細胞來源的心肌細胞(hPSC-CMs)為心臟研究提供了獨特的機會。使用這些細胞的傳統研究集中在單個細胞和利用混合細胞群。而來自以色列理工學院Lior Gepstein課題組的目標是開發與臨床相關的由腔室特異性hPSC-CM組成的工程心臟組織(Engineered Heart tissues,EHTs)。于此,該研究團隊表明,這種EHTs的形成可以通過引導hPSCs分化為心室或心房心肌細胞,然后將這些心肌細胞包埋在膠原水凝膠中,形成腔室特異性的環狀EHTs。通過免疫染色、基因表達、動作電位和傳導速度的光學評估、藥理學和機械力測量,腔室特異性EHTs顯示出明顯的心房和心室表型。研究人員還建立了一個基于心房EHTs的心律失常模型,并通過應用相關的藥物干預來證實其有效性。因此,該腔室特異性EHT模型可用于心臟病的建模、病理生理學研究和藥物試驗。
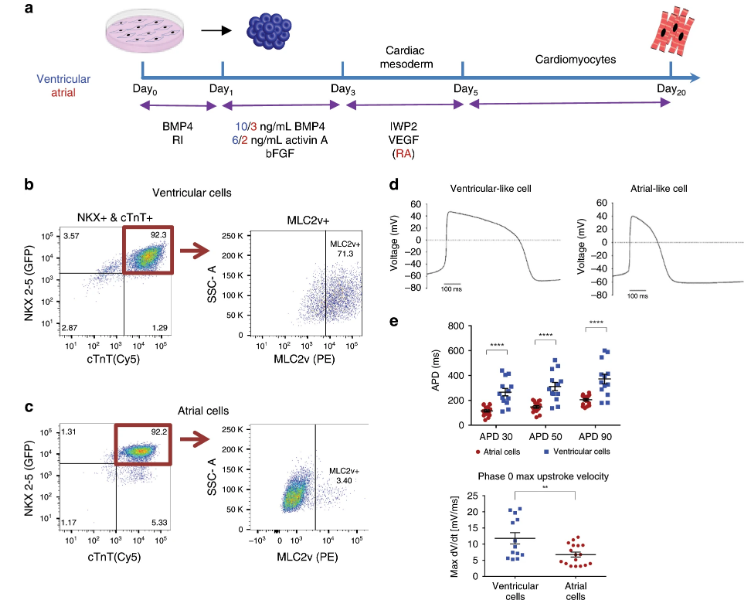
Goldfracht, I., Protze, S., Shiti, A. etal. Generating ring-shaped engineered heart tissues from ventricular andatrial human pluripotent stem cell-derived cardiomyocytes. NatCommun 11, 75 (2020)
doi:10.1038/s41467-019-13868-xhttps://doi.org/10.1038/s41467-019-13868-x
12. Science子刊:機器人熱出汗了,怎么辦?
在炎熱的夏天,無論汗味有多糟糕,我們都應該感謝身體具有出汗的能力,否則,我們的身體將難以跟上高溫的步伐。通過排汗和蒸發冷卻降低體溫的能力可使得我們能在劇烈運動期間具有更大的耐力。但是,如果機器人出汗了,怎么辦呢?近日,美國康奈爾大學Robert F. Shepherd等人,為機器人出汗找到了解決方案。我們知道,機器過熱會對機器自身產生很多危害,因為在工程系統中,存儲的能量到有用功的轉換永遠不會完全有效,并且熱量會散發到系統中。過多熱量產生的不利影響很多,包括熱膨脹,溫度梯度引起的應力或電路中電子遷移率的變化。Robert F. Shepherd研究團隊從汗流浹背的人類身上汲取靈感,創建了一個自出汗的柔軟機器人抓手系統,實現自身冷卻降溫。研究人員使用定制的多材料立體光刻(SLA)3D打印技術造出用于裝液體的內部容器,并在其表面上添加小孔。當溫度升高時,手指狀抓手的外層會膨脹,導致孔擴張并排出液體,實現快速降溫。
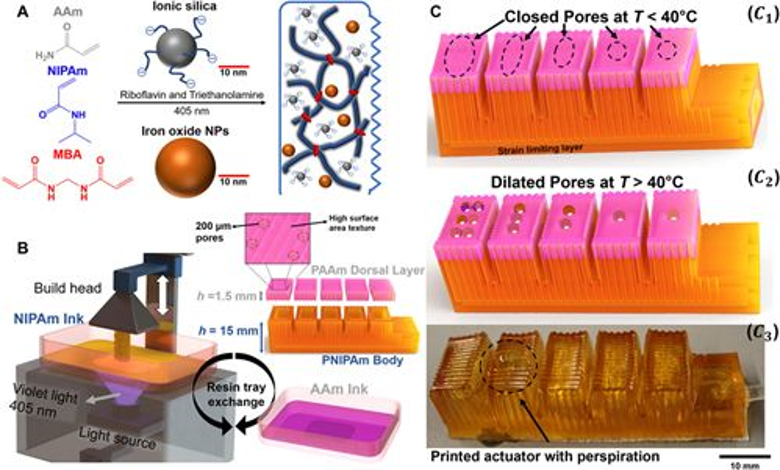
MishraAK, Wallin TJ, Pan W, Xu P, Wang K, Giannelis EP, etal. Autonomic perspirationin 3D-printed hydrogel actuators. Science Robotics.2020;5(38):eaaz3918.https://robotics.sciencemag.org/content/5/38/eaaz3918
13. ScienceTranslational Medicine:雙重作用水凝膠治療傷口感染和炎癥
傷口感染會增加全身并發癥(如敗血癥)的風險,并且由于抗菌素耐藥性的增加而難以治療。 于此,瑞典隆德大學Manoj Puthia等人開發了一種含有凝血酶衍生肽TCP-25的水凝膠,可殺死細菌并減少炎癥。該水凝膠在體外對金黃色葡萄球菌、銅綠假單胞菌和臨床細菌分離株均有效,對小鼠皮下感染和豬部分創面感染模型均有治療作用。該肽的生物活性切割片段類似于在人類傷口液中發現的那些片段。結果表明,這種具有抗炎和抗菌雙重作用的多肽功能水凝膠是一種很有前景的創面愈合方法。
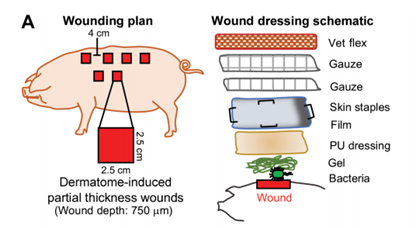
Puthia M, Butrym M, Petrlova J, Str?mdahl A-C, Andersson M?,Kjellstr?m S, et al. A dual-action peptide-containing hydrogel targets woundinfection and inflammation. Science Translational Medicine.2020;12(524):eaax6601.https://stm.sciencemag.org/content/12/524/eaax6601
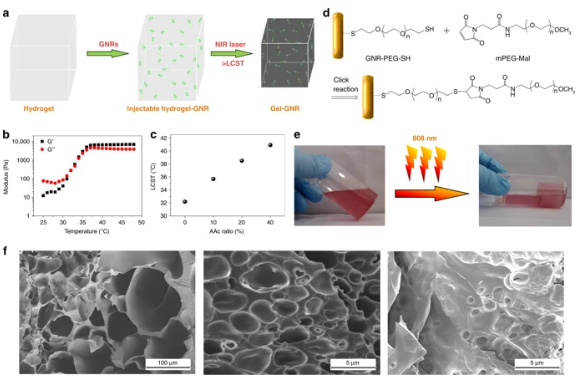
14. Nat.Commun.:血管外凝膠收縮引起的內應力使腫瘤饑餓治療具有抑制轉移和復發的作用
盡管目前的饑餓療法有效,但它們往往伴隨著一些固有的缺點,如持續性差、易發生腫瘤轉移和復發。在此,同濟大學徐輝雄、Zhang Kun等聯合中科院上海硅酸鹽研究所陳雨等建立了血管外凝膠收縮引起內應力策略,用于擠壓和收縮血管,阻斷血液和營養供應,降低血管密度,誘導缺氧和凋亡,最終實現惡性腫瘤的饑餓治療。他們設計了一種由金納米棒(GNRs)和熱敏性水凝膠混合物組成的生物相容性復合水凝膠,其中GNRs可以增強水凝膠混合物的結構性能,并使凝膠收縮引起的內應力具有魯棒性。系統實驗表明,這種饑餓療法可以抑制PANC-1胰腺癌和4T1乳腺癌的生長。更重要的是,這種饑餓策略可以通過降低血管密度和血供,阻斷腫瘤的遷移通道,從而抑制腫瘤的轉移和復發,為腫瘤的綜合治療提供了一條頗具前景的途徑。
Kun Zhang, Yan Fang, Yaping He, et al. Extravasculargelation shrinkage-derived internal stress enables tumor starvation therapywith suppressed metastasis and recurrence, Nat. Commun., 2019.
https://www.nature.com/articles/s41467-019-13115-3
15. Nature:通過點擊-功能性肽bundles制備具有受控組裝和剛性的聚合物
生物分子的工程設計是功能強大的精密軟材料設計中的關鍵概念。生物分子具有出廣泛的功能和結構,包括化學識別(例如,酶底物或粘合劑配體的化學識別),精美的納米結構(由肽,蛋白質或核酸組成),以及異常的機械性能(如絲狀強度,剛度,粘彈性和回彈性)。近日,特拉華大學Christopher J. Kloxin,Darrin J. Pochan,賓夕法尼亞大學Jeffery G. Saven等發展了一種物理(非共價)相互作用與“點擊”共價組裝相結合的方法,用于制備肽基聚合物。這些聚合物的納米級單體單元是低分子量肽的同四聚體,α-螺旋bundles。肽bundles單體或bundlemers可以被設計成具有多種化學功能。蛋白質狀結構肽bundles可精確定位不同bundlemers末端之間的共價鍵,從而形成具有有趣且可控制的物理特性的聚合物,例如剛性棒,半柔性或扭結鏈以及熱響應性水凝膠網絡。聚合物剛度可以通過改變連接劑來控制。此外,通過控制bundlemer外圍的氨基酸序列,對特定的氨基酸側鏈進行修飾(包括“點擊”化學功能化),可創建各種各樣的雜化納米材料。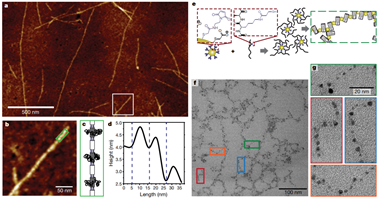
Dongdong Wu, Jeffery G. Saven*, Christopher J. Kloxin,*Darrin J. Pochan*, et al. Polymers with controlled assembly and rigiditymade with click-functional peptide bundles. Nature, 2019.DOI: 10.1038/s41586-019-1683-4https://www.nature.com/articles/s41586-019-1683-4
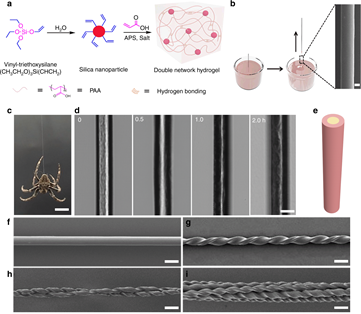
16. Nat.Commun.:超強人造蜘蛛絲
蜘蛛絲具有強度、韌性、延展性和能量吸收的獨特組合。迄今為止,利用非蛋白質方法很難獲得蜘蛛絲般的機械性能。在這里,南開大學劉遵峰教授團隊報道了一種人造蜘蛛絲,由聚丙烯酸和二氧化硅納米顆粒制成的水凝膠纖維在水蒸發誘導下自組裝而成。人造蜘蛛絲由分層的芯鞘結構水凝膠纖維組成,這些纖維通過離子摻雜和加捻得到增強。該纖維的抗張強度為895 MPa,可拉伸性為44.3%,可實現與蜘蛛絲相當的機械性能。該材料還具有370 MJ m-3的高韌性和95%的阻尼能力。當用于減少沖擊的應用時,水凝膠纖維僅顯示出棉紗沖擊力的約1/9,且回彈可忽略不計。這項工作為人造蜘蛛絲的制造開辟了一條途徑,并將其應用于動能緩沖和減震領域。
Dou, Y., Wang, Z., He, W. et al. Artificial spider silk fromion-doped and twisted core-sheath hydrogel fibres. Nat Commun 10, 5293 (2019)doi:10.1038/s41467-019-13257-4https://doi.org/10.1038/s41467-019-13257-4
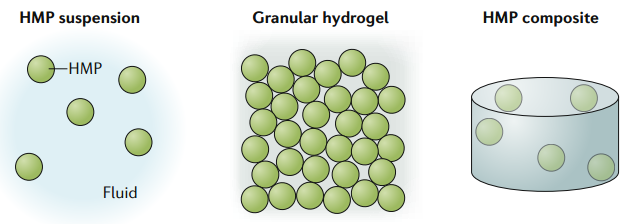
17. Nat. Rev.Mater.:水凝膠微粒的生物醫學應用
水凝膠微粒子(HMPs)在許多的生物醫學領域例如遞送治療藥物、構建組織修復支架和用于3D打印的生物墨水等都有著廣闊的應用前景。HMPs既可以在懸浮液中形成,并作為一種顆粒狀水凝膠的聚合體來形成微孔支架以促進細胞的浸潤;也可以被嵌入大塊水凝膠中以構建多級結構的材料。研究表明,HMP的懸浮液和顆粒狀水凝膠都可用于對生物制品進行微創遞送,并且不同HMP組成也會影響的它們的模塊化特性。杜克大學Tatiana Segura教授和賓夕法尼亞大學JasonA. Burdick教授合作綜述討論了目前用于制造HMPs的相關技術以及HMP體系的多級結構行為和功能特性;也對HMPs在細胞和藥物遞送、支架設計和生物制造等領域的應用進行了討論。
Andrew C. Daly, Tatiana Segura, Jason A. Burdick. et al.Hydrogel microparticles for biomedical applications. Nature ReviewsMaterials. 2019https://www.nature.com/articles/s41578-019-0148-6
18. Nat.Commun.:溶劑-非溶劑快速注射法制備納米水凝膠
由于ABA三嵌段共聚物具有獨特的分子結構,將其引入B嵌段選擇性溶劑后,會經歷特定的自組裝過程,從而形成各種納米結構。雖然ABA三嵌段共聚物自組裝的研究主要集中在平衡態納米結構上,但對非平衡加工條件下納米結構形成的工作相對較少。有鑒于此,賓夕法尼亞州立大學Robert J. Hickey教授和Manish Kumar教授等報道了一種用溶劑-非溶劑快速注射法制備和調控ABA三嵌段共聚物體系的通用定量方法。研究發現,利用這種快速注射技術,含金納米粒子和具有結構色的分級有序水凝膠的等離子體納米復合水凝膠可以在一分鐘內組裝完成。更令人驚訝的是,與傳統的ABA水凝膠相比,快速注射法制備的復合水凝膠具有更好的力學性能。
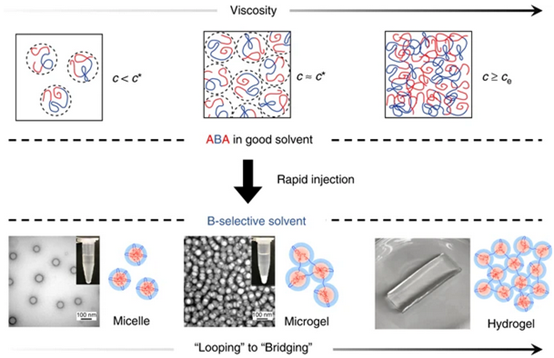
Chao Lang, Jacob A. LaNasa, Nyalaliska Utomo, Yifan Xu,Melissa J. Nelson, Woochul Song, Michael A. Hickner, Ralph H. Colby, ManishKumar & Robert J. Hickey. Solvent-non-solvent rapid-injection forpreparing nanostructured materials from micelles to hydrogels. Nat.Commun.,2019Doi:10.1038/s41467-019-11804-7https://www.nature.com/articles/s41467-019-11804-7
19. NatureMater.評論:推動水凝膠生物材料向4D發展
合成具有時空控制的生物材料一直是該領域的挑戰。近期華盛頓大學的Cole A. DeForest教授課題組開發出一種方法,在不影響生物活性的前提下,利用轉肽酶介導的轉位反應,用位點特異性固定化蛋白可逆地構建細胞負載的水凝膠。他們首先將這些改性蛋白加入PEG水凝膠中,使用環加成反應進行凝膠化,然后用空間控制方法進行光化肟結扎固定蛋白。研究發現,通過鄰硝基芐基酯的化學反應,結合蛋白可以在光的作用下被釋放。這個蛋白質固定和釋放的過程可以在四維空間里可逆的重復。這一研究首次實現了對水凝膠中活性蛋白表達的時空控制。賓夕法尼亞大學的Jason A. Burdick教授高度贊揚了這項新技術。他認為,實現對水凝膠中蛋白質表達的“自上而下”控制可以用來解決一些復雜的生物學問題,并改變細胞行為,尤其是在三維環境中。如果能夠利用這種技術將復雜的細胞信號 (通過時間分子控制)和細胞結構異質性(通過空間控制)與一些生物學問題和應用關聯起來,那么這種技術創造的價值將是無法估量的。
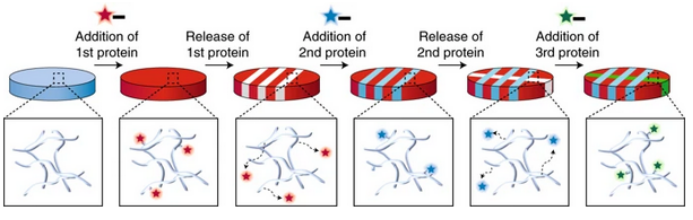
Jonathan H. Galarraga & Jason A. Burdick. Movinghydrogels to the fourth dimension. Nature Materials, 2019DOI: 10.1038/s41563-019-0458-5https://www.nature.com/articles/s41563-019-0458-5
20. 清華大學Nat. Commun.:樹葉啟發光驅動凈水生產
天然維管植物葉片依賴于滲透壓,蒸騰和內臟的差異,以產生大量由陽光驅動的清潔水。受此啟發,清華大學Liangti Qu, Tianbao Ma 和 Chun Li等人報告了一種用于高效水凈化和生產的陽光驅動凈化器。這種陽光驅動的凈化器的特征在于負溫度響應聚(N-異丙基丙烯酰胺)水凝膠(PN)錨定在超親水三聚氰胺泡沫骨架上,并且一層PNIPAm改性石墨烯(PG)濾膜涂在其表面。結果表明,相對剛性的三聚氰胺骨架的超親水性顯著加速了PNPG-F凈化器的膨脹/消溶脹速率。在一個太陽下,這種合理的工程結構提供了4.2 kg m-2 h-1的收集,并且從鹽水進料中獲得單個PNPG-F的離子排斥率>99%。
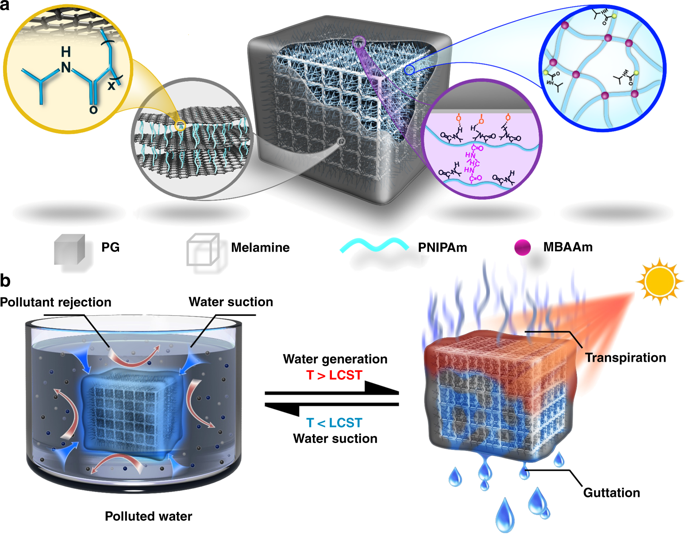
Geng, H.; Xu, Q.; Wu, M.; Ma, H.; Zhang, P.; Gao, T.; Qu,L.; Ma, T.; Li, C. Nat. Commun. 2019, 10, 1512.Doi:10.1038/s41467-019-09535-w.https://doi.org/10.1038/s41467-019-09535-w