
第一作者:程強,魏妥
通訊作者:Prof.Daniel J. Siegwart
通訊單位:美國德克薩斯大學西南醫學中心
CRISPR/Cas介導的基因編輯和基于信使RNA(mRNA)的蛋白質替代療法具有巨大潛力,可以有效治療具有多種細胞起源的致病突變。如果還不太了解的CRISPR/Cas如何起作用的同學,可以出門左轉,點擊今天推送的第三條的科普視頻哦!
非病毒載體具備無傳染性、沒有載體容量限制、材料來源廣泛、化學結構可控制等優點,有著病毒載體不可替代的作用。其中,脂質納米粒(LNPs)可以將治療性核酸遞送至肝臟。現有的研究工作盡管取得了一些進展,但是最大的問題是尚無法預測和合理地設計出選擇性靶向特定組織的納米顆粒,以完成mRNA安全高效的遞送至肝臟以外的其他組織。
近日,美國德克薩斯大學西南醫學中心Daniel J. Siegwart教授課題組報道了一種器官選擇性靶向(SORT)技術,對納米粒子進行系統設計,用于mRNA遞送和CRISPR/Cas基因編輯。這種方法可將mRNA,Cas9 mRNA /單向導RNA(sgRNA)和Cas9核糖核蛋白(RNP)等復合物準確遞送到小鼠的肺、脾和肝臟內(圖1a)。
相關研究成果發表在Nature Nanotechnology上,題為“Selective organ targeting (SORT) nanoparticles for tissue-specificmRNA delivery and CRISPR–Cas gene editing”。另外,NatureNanotechnology雜志同時刊登了Roy van der Meel關于該項工作的評論性文章,題為“Nanotechnology for organ-tunable gene editing”。
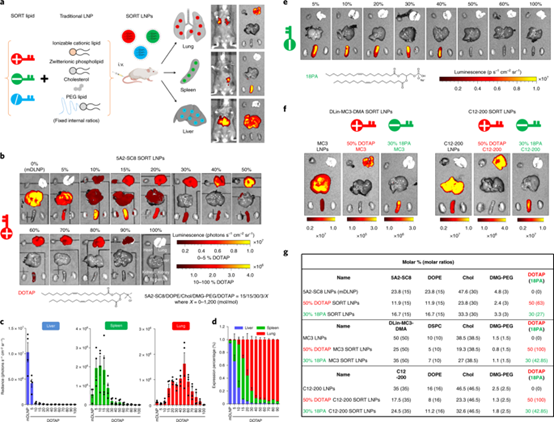
圖1 | SORT技術可將mRNA準確遞送至特定器官
研究亮點:
1.SORT技術提供了可預測地、精確地、快速篩選器官選擇性LNPs的方法,具有廣泛適用性,不依賴于LNPs的類型和脂質的化學結構。
2.SORTLNPs實現了器官特異性mRNA的安全高效遞送和CRISPR/Cas9介導的基因編輯治療,并將極大地推動這些領域的發展。
要點1:SORT技術的發現和發展
一般而言,有效的細胞內遞送材料依賴可電離胺結合和釋放RNA以及納米粒子穩定的疏水性之間的平衡。受該組之前的研究工作的啟發:經過表面電荷調節的mRNA脂質體可以促進免疫單核吞噬細胞向樹突細胞遞送,研究人員推測脂質納米粒內部的電荷可能是調節組織趨向性的關鍵因素。為了驗證這一猜想,研究人員首先在課題組之前建立的LNP體系(mDLNP)中添加了第五種脂質分子(陽離子DOTAP),用來調節內部電荷。在不破壞原有四種組分比例(5A2-SC8 : DOPE: Chol : PEG = 15:15:30:3)的前提下,調節DOTAP的比例從0變化到100%,制成一系列的具有不同DOTAP比例的LNPs。
然后,研究人員通過靜脈注射包含熒光素酶mRNA(0.1mg/kg)的納米粒子來評估SORT效果。他們驚奇地發現,DOTAP的摩爾百分比是調整組織特異性的關鍵因素。隨著DOTAP摩爾百分比的增加,熒光素酶蛋白表達逐漸從肝臟轉移至脾臟,然后轉移至肺部,表現出明顯而精確的器官選擇性遞送趨勢(圖1b)。
具體為:0%DOTAP為最佳肝臟轉染,10-15%適合脾臟轉染,而50%為最佳肺部轉染。為了驗證包含其他分子也可能改變器官選擇性的假設,研究人員接下來引入了陰離子脂質18PA,結果顯示其比例在10%-40%時,LNPs可以完全選擇性地遞送到脾臟。(圖1e)。這些分子通過調節LNPs內部的電荷從而調節靶向器官的選擇性,研究人員將這種技術命名為SORT。SORT分子的化學性質和百分比決定了組織的特異性遞送。
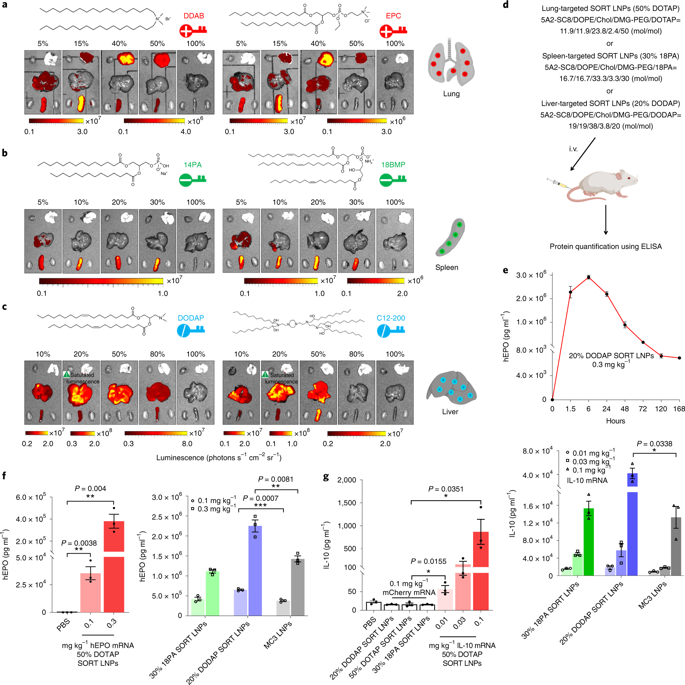
圖2 | SORT技術不依賴于LNPs的類型和脂質的化學結構
要點2:SORT技術廣泛適用于多種LNP類型和分子類別
那么,SORT技術是否同樣適用于其他LNP類型呢?研究人員首先對FDA批準的siRNA標準遞送載體,一種基于DLin-MC3-DMA、DSPC、Chol和DMG-PEG的LNPs,分別引入DOTAP和18PA脂質。結果與預期相符,經過SORT技術優化后的DLin-MC3-DMA LNPs的器官選擇性和mDLNP的一致。此外,研究人員同樣在C12-200 LNPs的研究中觀察到類似的結果。這些結果表明SORT技術廣泛適用于多種LNP類型(圖1f,g)。
然后,研究人員評估了多種陽離子、陰離子、兩性離子和可電離陽離子用作SORT技術脂質的效果。他們選用DOTAP、DDAB、EPC等作為陽離子脂質,18PA、14PA、18BMP作為陰離子脂質,調節其比例進行研究。結果發現,陽離子SORT脂質均使得轉染從肝轉移到脾,然后轉移到肺(圖2a);而陰離子SORT脂質均促進脾臟轉染(圖2b)。這說明該SORT技術與脂質的化學結構和分子類別無關。另外,研究人員還發現SORT可以“激活”原本不活躍的LNPs,即引入可離子化的脂質可以“補充”原本無活性的LNPs,從而選擇性遞送至特定器官,甚至提高轉染效率。
這些結果都表明,SORT技術廣泛適用于多種LNP類型和分子類別,而且具有可控性和可預測性,成為實現器官靶向遞送的一種模塊化的通用策略。
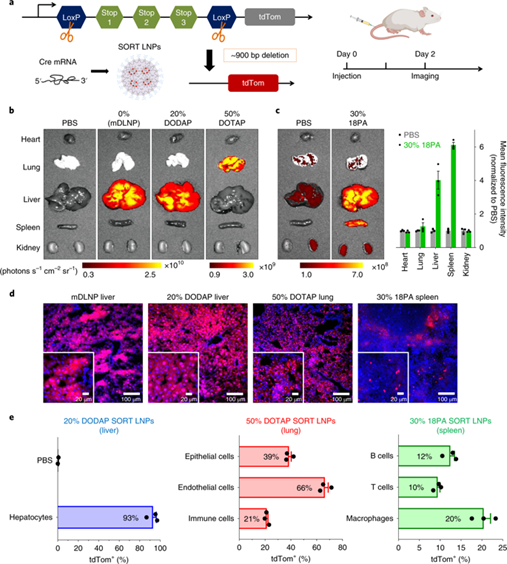
圖3 | SORT LNPs通過Cre mRNA遞送實現特異性tdTom激活
要點3:SORT技術參與基因編輯和器官特異性治療
鑒于SORTLNPs靶向特定器官的能力,研究人員將結果應用于組織特異性基因編輯。他們首先使用以肝、肺和脾為靶向的SORTLNPs遞送Cre mRNA至轉基因的tdTom小鼠中進行基因編輯,該mRNA產生Cre酶并切除終止位以激活tdTom,使其表達紅色熒光(圖3a)。流式結果顯示,單次靜脈注射0.3 mg/kg的Cre mRNA后,肝靶向的SORT LNPs對肝細胞的基因編輯效率高達93%,肺靶向的SORT LNPs對肺的上皮細胞和內皮細胞的基因編輯效率分別達到40%和65%;脾靶向的SORT LNPs對巨噬細胞的編輯效率為20%(圖3e)。由于選擇性的提高,脾靶向的SORT LNPs可用于治療非霍奇金氏B細胞淋巴瘤和其他免疫疾病。盡管該研究最初的重點是單次、小劑量注射,但研究人員注意到通過給予更高劑量或多次注射可以實現更高水平的轉染。
接下來,研究人員研究了SORT LNPs用于CRISPR/Cas9介導的基因編輯的效果,即在單個納米顆粒中同時遞送Cas9 mRNA和sgRNA(圖4a)。在一次靜脈注射肝和肺靶向的SORT LNPs十天后,在mDLNP和20%DODAP SORT LNPs處理的小鼠的肝臟中,以及在50%DOTAP SORT LNPs處理的小鼠的肺中均觀察到強tdTom熒光,所有結果與熒光素酶mRNA遞送結果一致(圖4b,c)。然后,研究人員還測試了SORT LNPs編輯內源性基因(PTEN)的能力。一次靜脈注射包載有Cas9 mRNA和sgPTEN的肝和肺靶向的SORT LNPs十天后,在肝和肺部的基因編輯效率可分別達到13.9%和15.1%!最后,為了確定SORT LNPs可以有效地編輯與治療相關的靶標,研究人員同時遞送Cas9 mRNA和靶向PCSK9的sgRNA(圖4h),結果表明20%的DODAPSORT LNPs的基因編輯效率可達60%(圖4i,j),且肝臟和血清中PCSK9蛋白水平降低約100%(圖4k,l)。
以上結果都表明,SORT技術可以有效實現使用合成載體的器官選擇性基因編輯。
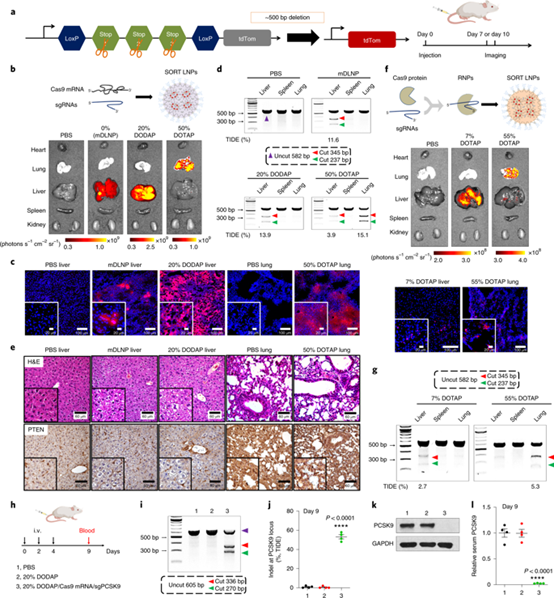
圖4 | SORT LNPs介導器官特異性CRISPR/Cas基因編輯。
小結:
SORT技術的發現實現了將RNA納米顆粒可預測地靶向傳遞到特定器官,有望推動蛋白質替代和基因校正療法的發展。該技術可廣泛應用于現有的多種類型的LNPs和其他納米粒子系統。SORT優化的LNPs實現了器官特異性mRNA的安全高效遞送和CRISPR/Cas9介導的基因編輯治療,預期SORT可以為基因校正療法開辟新的發展途徑。
參考文獻及原文鏈接:
Cheng,Q., Wei, T. et al. Selective organ targeting (SORT) nanoparticlesfor tissue-specific mRNA delivery and CRISPR–Cas gene editing. Nat.Nanotechnol. 2020.
https://doi.org/10.1038/s41565-020-0669-6
通訊作者:

DanielJ. Siegwart是德克薩斯大學西南醫學中心的副教授。他的研究計劃專注于開發先進的基于聚合物和脂質的系統,該系統可精確控制大分子的結構、順序和響應性,以用于藥物輸送、成像、遺傳疾病和癌癥。他是ReCode Therapeutics公司的共同創始人,致力于修飾tRNA負載的納米顆粒,用于糾正引起囊性纖維化和其他疾病的無義突變。
對第一作者專訪:
程強博士和魏妥博士為本文的共同第一作者,他們均是Daniel J. Siegwart課題組的博士后研究員。以下是奇物論編輯部對他們的專訪:
1.請問您的課題組目前主要從事哪些方面的研究?
程強,魏妥:我們目前在西南醫學中心Daniel J. Siegwart教授實驗室從事博士后研究。Siegwart教授實驗室主要從事RNA納米藥物的研究,這些RNA藥物包括siRNA,miRNA和mRNA。簡單來說,首先是通過合理的設計和化學合成得到一系列新型脂質分子,隨后與其他必須的脂質分子及RNA藥物組裝成新型脂質納米顆粒(Lipid Nanoparticles,LNPs),用來進行疾病的治療和預防。siRNA和miRNA用來治療由于某些基因過量表達引起的疾病;mRNA用來治療由蛋白質突變引起的疾病以及通過Cas9 mRNA介導的手段進行基因編輯等。但是臟器選擇性RNA遞送一直都是RNA治療的研發難題,針對這一問題,我們最近通過優化LNPs的方法,研發了SORT技術,從根本上解決了這一技術難題。
2. 您覺得這個研究工作相比于之前的mRNA治療手段的核心優勢在哪里?
程強,魏妥:安全、高效的體內遞送是mRNA有效治療的核心步驟,研發肝臟靶向的LNPs較為成熟,然而突破肝臟以外的靶向遞送亟待解決。當前的研發手段大多是通過化學合成進行高通量篩選,該方法有非常明顯的優點,即有可能發現新型LNPs,實現其他器官的靶向遞送,如,肺和脾;但缺點也非常突出,耗時、耗力、耗錢,同時具有很大的盲目性。SORT技術給出了LNPs器官靶向遞送的通用指導原則,將會簡化這一研發過程,且無需進行大規模體內外篩選。更重要的是,SORT LNPs可以高效遞送mRNA,保證了后續mRNA治療或者基因編輯的效果。
3. 在研究過程中,遇到過什么困難?
程強,魏妥:不偏不倚地說,研發過程比較順利,并沒有遇到過很大的困難。從發現這一現象到完成幾乎全部工作,大概歷時1年半。遇到最大的困難應該是投稿過程過于漫長、充滿了曲折。
4. 該項研究工作,在不遠的將來會不會應用于臨床治療?其可能的優點和問題有些什么?
程強,魏妥:正如前面提到的,SORT技術的發現將會極大程度地促進LNPs的研發,非常有希望在不久的將來應用到臨床治療。最近生物研發公司ReCode利用此項技術完成A輪8000萬美元的融資就是最好的見證。SORT的優點很突出,可以快速實現器官選擇性RNA遞送,從而擴大RNA治療的應用范圍。如,MC3 LNPs在2018年8月獲美國FDA批準用于siRNA藥物靶向肝臟的治療,運用SORT技術可以快速精準的對MC3 LNPs進行改造,有可能加快siRNA或者mRNA在肺和脾臟中的應用;但是任何改造過的LNPs都屬于全新的遞送制劑,都需要從頭到尾的的進行臨床前研究,首要任務便是安全性評估,因此無法預測將會面臨的問題。
5. 做研究的過程中,您有何經驗和心得和大家分享?
程強,魏妥:我們認為對自己研究的課題感興趣最為重要,內在的興趣會督促你不斷的思考和探索,但凡有一點突破就會高興的不能自已,然后促使你進一步探索,形成好的良性循環。
推薦之前對雙電荷納米粒和基因編輯的深度解讀:
1. 雙電荷:夏幼南等點評Nature Nanotech:養虎為患!癌細胞培養無藥納米粒長大卻殺死自身
2. 基因編輯:Science:基因編輯聯合細胞療法,首次進入臨床試驗!











