
最近的很多研究中心的臨床試驗和細胞培養研究表明,已有70年歷史的瘧疾藥物氯喹可能顯示出對COVID-19(2019年冠狀病毒病)的治療效果。COVID-19是一種迅速傳播的病毒,可導致約2.5%的感染者因肺炎死亡。根據初步的臨床試驗結果,氯喹已被納入中華人民共和國COVID-19的治療指南中。
但是,由于臨床試驗仍在進行中且尚未獲得臨時試驗數據,因此在作出過早的解釋時應小心謹慎。鑒于目前缺乏一種已獲批準的有效疫苗用于嚴重急性呼吸系統綜合癥冠狀病毒2(SARS-CoV-2)(引起COVID-19的病毒),因此,評估經過臨床批準的藥物的潛在預防和/或治療效果是非常重要的。氯喹及其衍生物羥基氯喹作為預防瘧疾流行地區的安全、廉價藥物和日常治療自身免疫性疾病的藥物有著悠久的歷史,最常見的副作用是長期使用后對眼睛造成損害。盡管先前的研究已經表明氯喹對病毒有治療作用,包括動物模型中的人冠狀病毒OC43和細胞培養研究中的SARS-CoV,但氯喹的抗病毒機制仍然是推測性的。
氯喹已用于納米醫學領域,用于研究細胞中納米顆粒的攝取,因此,在存在氯喹的情況下,對納米顆粒與細胞相互作用的見解,可能揭示在病毒復制前早期活躍的機制。具體而言,納米醫學研究可能會提供有關氯喹誘導的SARS-CoV-2細胞攝取變化的線索。
氯喹的作用機制
氯喹減輕SARS-CoV-2感染的確切機制令人相當感興趣,因為這一信息可能對確定新的預防和治療候選藥物很有價值。氯喹是一種弱堿性物質,被膜包裹在低pH的細胞器中,阻礙其酸化。在引起瘧疾的瘧原蟲中,氯喹積聚在消化液泡中,在那里它被認為可以阻止血紅素的pH依賴性解毒作用,血紅素是由寄生蟲消耗血紅蛋白獲得游離氨基酸而產生的。這種隔離作用在哺乳動物細胞中也很明顯,氯喹治療可導致溶酶體pH值升高。關于氯喹誘導的抗病毒作用的推測包括:抑制pH依賴性病毒融合/復制,防止病毒包膜糖蛋白和宿主受體蛋白糖基化。
氯喹還可以抑制病毒粒子在內質網-高爾基體中間隔室(ERGIC)樣結構中的組裝。此外,氯喹可能通過抑制促炎癥因子和受體的表達而表現出宿主效應,而這些因子和受體可誘發急性呼吸窘迫綜合征,而急性呼吸窘迫綜合征是冠狀病毒相關死亡的主要原因。
氯喹抑制納米顆粒的內吞作用
已經證明氯喹是一種廣譜的抑制巨噬細胞吞噬納米顆粒的抑制劑。因此,氯喹減少了不同大小(14-2600 nm)和形狀(球形和盤狀)的合成納米顆粒在細胞系中的累積,以及在小鼠單核吞噬細胞系統中對臨床相關劑量氯喹的反應。機理研究表明,氯喹可降低磷脂酰肌醇結合網格蛋白裝配蛋白(PICALM)的表達,網格蛋白裝配蛋白是網格蛋白涂層的凹坑中三種最豐富的蛋白之一。PICALM是一種選擇貨物的網格蛋白銜接子,可感知并驅動膜彎曲,從而調節內吞速率。
之前已有研究表明,消除PICALM可以抑制網格蛋白介導的內吞作用,這是合成納米粒子內吞的主要途徑。值得注意的是,在用氯喹處理的巨噬細胞中,網格蛋白和網格蛋白銜接蛋白2 (AP2)的蛋白水平沒有變化,表明存在典型的細胞毒性效應,而與網格蛋白依賴性內吞作用相關的蛋白水平普遍降低相反。與氯丙嗪(一種眾所周知的網格蛋白依賴性內吞抑制劑)相比,氯喹在阻止巨噬細胞吸收納米顆粒方面更有效,這表明可能涉及網格蛋白介導的內吞抑制以外的其他機制。也可以想象,在非網格蛋白介導的納米粒子攝取中,PICALM可能起次要作用。此外,已知氯喹可防止溶酶體酸化,從而阻礙與內吞囊泡的融合。防止溶酶體融合可能會干擾上游的內吞運輸,造成堵塞,阻礙物質有效地進出細胞膜。
氯喹對SARS-CoV-2的潛在影響
SARS-CoV-2與通常研究的合成納米粒子具有相同的尺寸范圍(60-140 nm)和形狀(球形)。因此,可能是由氯喹介導的抗SARS-CoV-2效應的機制之一是由于PICALM抑制,導致細胞執行網格蛋白介導的納米顆粒內吞作用的能力下降(圖1)。
已有研究表明,其他冠狀病毒科通過受體介導的內吞作用進入宿主細胞,盡管也有與質膜直接融合的報道。例如,2003年鑒定出的SARS-CoV病毒和2004年鑒定出的人冠狀病毒NL63(HCoV-NL63)與血管緊張素轉化酶2(ACE2)受體結合,觸發了內吞作用驅動的細胞進入。SARS冠狀病毒進入人類細胞的機制有兩種,一種是網格蛋白介導的,另一種是網格蛋白/小泡非依賴性的內吞作用。SARS-CoV-2可能使用類似的ACE2介導的細胞進入機制。
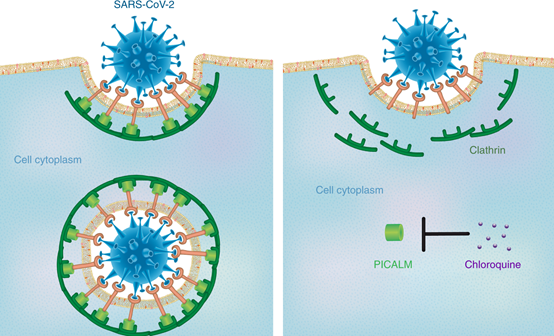
圖1. 氯喹對COVID-19的潛在治療機制
此外,氯喹誘導的內體溶酶體融合的預防可能會干擾一般的內吞運輸,例如膜受體循環,這被認為是SARS-CoV-2細胞進入所必需的。但是,先前的研究表明,氯喹對細胞培養物中的SARS-CoV具有治療活性,但不會改變ACE2的細胞表面水平。另外,治療劑量的氯喹基本上沒有改變SARS-CoV刺突糖蛋白的生物合成或糖基化。相反,ACE2受體的末端糖基化受損,這可能會影響病毒結合。
氯喹已顯示出即使在病毒攝取后給藥時,在細胞培養物中也顯示出抗SARS-CoV活性,表明可能涉及多種有益機制。通過內吞作用進入細胞后,病毒粒子表面的刺突蛋白必須被駐留的內體蛋白酶(例如組織蛋白酶)裂解,該酶在內體酸化后會被激活。這種切割在刺突蛋白中誘導構象變化,使病毒包膜和內體膜結合在一起,從而實現融合。氯喹誘導的內體酸化抑制可能會改變這種融合事件,使病毒停滯在內體中。
未來研究以評估(羥基)氯喹抗COVID-19的潛力
在臨床試驗數據證實了COVID-19患者氯喹活性的初步結果的情況下,將有必要進行進一步的研究,以了解關于例如患者群體、疾病階段和劑量的最優預防和/或治療臨床方案。此外,應對氯喹和羥基氯喹進行比較研究,因為后者被認為具有更好的安全性,最近在細胞培養中顯示出類似的抗SARS-CoV-2作用。此外,臨床前研究將有助于進一步確定潛在的(羥基)氯喹介導的抗SARS-CoV-2機制,包括抑制宿主細胞的內吞作用。帶有SARS-CoV-2尖峰的假型病毒粒子將有利于在簡化的系統中評估細胞進入要求,免疫熒光研究可以確定藥物處理細胞中病毒粒子的位置。然而,應謹慎行事,以避免對臨床前和臨床結果的過早解釋。事實上,氯喹在細胞培養中顯示出對埃博拉病毒的治療活性,但動物研究顯示出相互矛盾的結果。此外,在基孔肯雅病毒的情況下,氯喹在體外顯示了有益的作用,在動物模型中加劇了感染,在臨床研究中缺乏治療作用,同時增加了關節痛的風險。
正在考慮將其他臨床批準的藥物用作COVID-19治療藥物,包括人類免疫缺陷病毒(HIV)蛋白酶抑制劑,例如利托那韋和洛匹那韋。但是,HIV和SARS-CoV-2具有不同的蛋白酶,這使這類藥物在治療COVID-19中的靶標特異性和實用性受到質疑。對于尚未被充分表征的致病性病毒制劑,靶向多種病毒物種之間共享的宿主途徑或病毒機制的治療劑(例如細胞進入或RNA基因組復制)是更可行的選擇。氯喹代表了抑制病毒進入細胞的潛在廣譜實例,而最初針對埃博拉病毒病開發的研究藥物瑞德習韋則代表了廣譜RNA聚合酶抑制劑的實例。
人們謹慎樂觀地認為,(羥基)氯喹可能對COVID-19有預防和/或治療作用,了解這些藥物影響SARS-CoV-2的機制,對于優化和開發預防和治療策略至關重要。
參考文獻:
Insights from nanomedicine into chloroquine efficacyagainst COVID-19. Nature Nanotechnology, 2020.
DOI: 10.1038/s41565-020-0674-9
https://www.nature.com/articles/s41565-020-0674-9











