20世紀90年代后期,人們開始研究能在分子水平上刺激細胞產生特殊應答反應的第三代生物材料。這類生物材料將生物活性材料與可降解材料這兩個獨立的概念結合起來,在可降解材料上進行分子修飾,引起細胞整合素的相互作用,誘導細胞增殖、分化,以及細胞外基質的合成與組裝,從而啟動機體的再生系統,從此生物材料的應用擴展到再生醫學。
再生醫學的優勢在于通過改善再生微環境,患者借助自身的再生修復能力引導再生,再生后的組織是人體自身的一部分。隨著干細胞和材料科學研究的不斷深入,科學家們也嘗試著利用材料來模擬干細胞微環境,并不斷地取得新的進展。
目前,再生醫學所包含的內容主要有四個方面:干細胞與克隆技術、組織工程、組織器官代用品、異種器官移植。
在此,奇物論編輯部精選10篇近期發表于Biomaterials上的關于再生醫學領域的文章,期望可以幫助大家了解再生醫學領域最新研究進展。
1.Biomaterials:分級組裝的納米結構用于基于siRNA的骨和血管再生(點擊查看深度解讀)
骨植入工程為解決當前醫學上許多重大的難題和改善臨床效果提供了重要的幫助。首都醫科大學江青松教授、第四軍醫大學楊國棟和四川大學郭俊凌教授合作利用siRNA修飾的顆粒對臨床使用的鈦植入物進行涂覆,從而構建了一種分級納米結構,并將其用于實現骨骼和血管組織的協同再生。偶聯在納米顆粒上的siRNA可以調節組織蛋白酶。通過調控mRNA的轉錄,該涂覆層可顯著促進與血管化相關的生長因子的釋放。此外,實驗結果也表明該納米涂覆層有助于實現巨噬細胞誘導的骨和血管生長因子上調。動物模型實驗結果也充分證明這種整合有siRNA的納米結構有望高效解決骨再生所面臨的諸多挑戰。
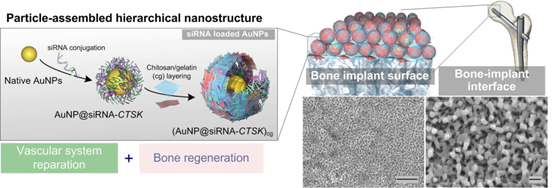
HelinXing, et al. Hierarchical Assembly of Nanostructured Coating for siRNA-BasedDual Therapy of Bone Regeneration and Revascularization. Biomaterials.2020
https://www.sciencedirect.com/science/article/pii/S0142961220300302
2.Biomaterials:近紅外響應性水凝膠局部輸送骨形態發生蛋白-2促進骨組織再生
實現生長因子產生的時空調控仍然是組織工程的主要目標。有鑒于此,拉巴斯-迪帕茲大學醫院的NuriaVilaboa、Francisco M.Martin-Saavedra等研究人員,將誘導轉基因表達和近紅外(NIR)響應水凝膠技術相結合,開發了一個骨再生治療平臺。
本文要點:
1)將熱激活、依賴二聚體的轉基因表達系統導入骨髓間充質干細胞,有條件地控制骨形態發生蛋白2(BMP-2)的產生。
2)基因工程細胞被包裹在基于纖維蛋白和等離激元金納米顆粒的水凝膠中,水凝膠將NIR激光的入射能量轉化為熱量。
3)在二聚體的存在下,光誘導的輕度高溫誘導了NIR反應性細胞構建物中生物活性BMP-2的釋放。
4)在具有免疫能力的小鼠的顱蓋骨中形成的一個臨界大小的骨缺損中充滿了NIR響應水凝膠,這些水凝膠包裹了在熱激活和依賴二聚體的基因電路的控制下表達BMP-2的細胞。
5)在用二聚體治療的動物中,植入物的NIR輻射誘導了骨病變中BMP-2的產生。
誘導在骨骼缺損中有條件表達BMP-2的NIR反應性細胞構建體導致形成新的礦化組織,從而表明該技術平臺的治療潛力。
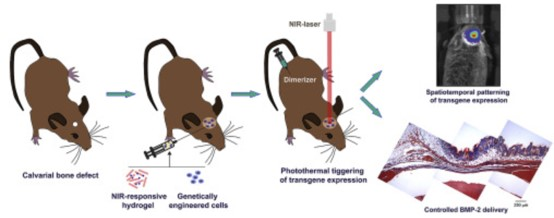
SilviaSanchez-Casanova, et al. Local delivery of bone morphogenetic protein-2 fromnear infrared-responsive hydrogels for bone tissue regeneration. Biomaterials,2020.
DOI:10.1016/j.biomaterials.2020.119909
https://www.sciencedirect.com/science/article/pii/S0142961220301551
3.Biomaterials:氧化鈰納米顆粒用于嚴重肢體缺血后的血運重建和保肢作用
嚴重肢體缺血(CLI)中,活性氧(ROS)的過量產生和新生血管的損害導致肌肉損傷和肢體喪失。氧化鈰納米顆粒(CNP)具有氧調節特性,已在各種疾病模型中顯示出治療作用。在此,韓國檀國大學Jung-HwanLee、Hae-Won Kim等人展示了CNP在小鼠后肢缺血模型中的促血管生成活性,并探討了促血管生成作用的分子機制。
本文要點:
1)股動脈結扎區注射CNP,連續3周監測組織再灌注和后肢修復情況。組織分析顯示,給予CNP后,促血管生成標志物被刺激,血管成熟,肌肉組織重塑。當CNP劑量為0.6 mg時,小鼠后肢血管再灌注,保肢率高,而未治療的小鼠均出現足部壞死或肢體喪失。
2)在體外,CNP通過Ref-1/APE1信號通路促進內皮細胞小管形成,體內免疫活性和免疫缺陷小鼠實驗以及APE1的siRNA敲除證實了該通路參與CNP反應。這些結果表明,CNP通過清除ROS以提高內皮細胞存活率和通過誘導依賴Ref-1/APE1的血管生成使缺血肢體血運重建,為治療ROS過多的CLI提供了一種有效的方法。
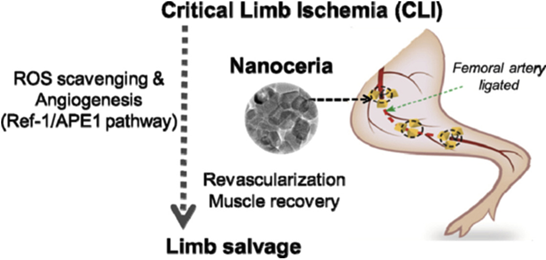
In-SuPark,etal. Revascularization and limb salvage following critical limb ischemia bynanoceria-induced Ref-1/APE1-dependent angiogenesis, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119919
4.Biomaterials:一種功能性支架促進神經干細胞/祖細胞遷移和分化用于脊髓損傷修復
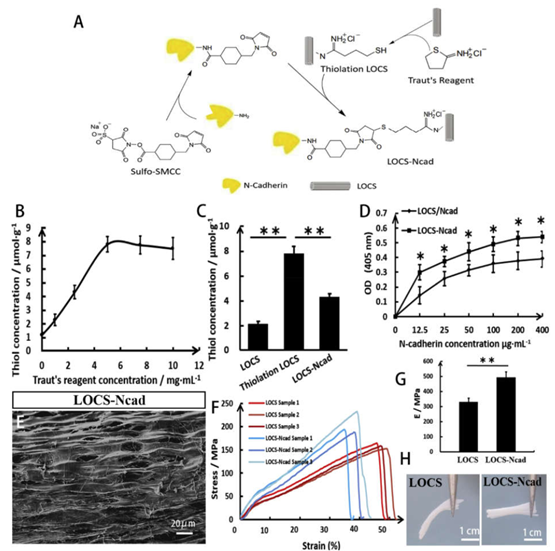
脊髓損傷(SCI)后,損傷節段鄰近神經組織中的內源性神經干細胞/祖細胞(NSPCs)被激活,但很少有細胞遷移到損傷中心并分化為神經元。N-鈣粘附蛋白調節NSPCs之間的機械粘附,并推動NSPCs遷移和促進NSPCs分化。在此,中國科學院遺傳與發育生物學研究所戴建武、趙燕南等人通過巰基和氨基的兩步交聯,用N-鈣粘附蛋白對線性有序膠原支架(LOCS)進行改性。
本文要點:
1)首先通過與LOCS上的巰基反應,將N-鈣粘附蛋白與LOCS偶聯,制備了N-鈣粘附蛋白修飾的線性有序膠原支架(LOCS -Ncad),證明了這種交聯方法的可行性。
2)結果表明,N-鈣粘附蛋白修飾可提高NSPCs在膠原支架上的黏附,促進其向神經元分化。
3)將LOCS-Ncad移植到全橫斷大鼠脊髓后,更多的NSPCs向損傷中心遷移,損傷部位出現更多新生神經元。此外,LOCS-Ncad可促進NSPC向神經元分化和軸突再生,并抑制硫酸軟骨素蛋白多糖(CSPGs)的沉積。
4)與未植入的大鼠相比,植入LOCS-Ncad的大鼠表現出明顯的運動恢復。總而言之, LOCS-Ncad通過招募內源性NSPCs到損傷中心,促進神經元分化,可能是一種促進SCI修復的有前途的治療選擇。
WeiyuanLiu, et al. A functional scaffold to promote the migration and neuronaldifferentiation of neural stem/progenitor cells for spinal cord injury repair,Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119941
5.Biomaterials:納米纖維-水凝膠復合物對脊髓挫傷后神經組織修復再生的影響
髓損傷會導致神經組織的長期丟失,因為損傷部位的內源性神經組織修復和再生是有限的。在此美國約翰·霍普金斯大學Hai-QuanMao、美國西北大學Martin Oudega、中山大學全大萍等人設計了一種具有界面結合的可注射納米纖維-水凝膠復合物(NHC),以提供機械強度和孔隙率,并在成年大鼠脊髓挫傷模型上觀察了其對修復和神經組織再生的影響。
本文要點:
1)在NHC治療28天后,挫傷脊髓節段的寬度是對照組的2倍。與對照組相比,NHC治療組的M2/M1巨噬細胞比率高2倍,血管密度高5倍,未成熟神經元高2.6倍,軸突密度高2.4倍,膠質瘢痕也相似。
2)研究結果表明,NHC為挫傷脊髓提供了機械支持,并在沒有任何外源性因素或細胞的情況下,支持損傷組織中促再生巨噬細胞極化、血管生成、軸突生長和神經再生。這些結果促使NHC和給藥方案進一步優化,以充分發揮NHC用于治療脊髓損傷的獨特特性的潛力。
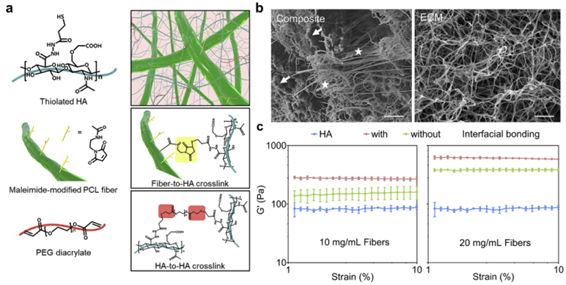
XiaoweiLi, et al. The effect of a nanofiber-hydrogel composite on neural tissue repairand regeneration in the contused spinal cord, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119978
6.Biomaterials:Mg-Nd-Zn-Zr合金髓內釘涂上SrHPO4,既能降解又能誘導成骨
鎂及鎂基合金具有良好的降解性、成骨作用和生物相容性,是一種很有前途的骨科植入物生物材料。然而,這些材料的缺點包括產氫量高,不可預期的耐腐蝕性和機械強度持續時間不足,表面修飾可以保護這些生物材料并誘導成骨。在此,上海交通大學袁廣銀、復旦大學附屬中山醫院閻作勤等人通過化學沉積方法為他們獲得專利的可生物降解Mg–Nd–Zn–Zr合金(簡稱JDBM)開發了SrHPO4涂層。
本文要點:
1)通過體外浸泡、離子釋放和細胞毒性試驗對該涂層進行了表征,結果表明該涂層具有較低的腐蝕速率和良好的細胞活性。
2)SrHPO4包被的JDBM離子釋放試驗提取物處理MC3T3E1細胞后,RNA測序顯示Tlr4升高,隨后激活下游PI3K/Akt信號通路,導致成骨細胞增殖和生長。
3)在大鼠股骨骨折模型上植入髓內釘(IMN),力學測試、放射學和組織學分析表明,有SrHPO4涂層的JDBM與沒有SrHPO4涂層的JDBM相比,具有更優越的力學性能,誘導更多的骨形成,以及降低的降解率。SrHPO4是一種很有前途的JDBM植入物涂層,尤其適用于長骨骨折。

ZheWang, et al. Degradation and osteogenic induction of a SrHPO4-coatedMg–Nd–Zn–Zr alloyintramedullary nail in a rat femoral shaft fracture model, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119962
7.Biomaterials:外泌體模擬物作為工程化基因激活基質誘導原位血管化成骨
外泌體具有良好的生物相容性、高效的細胞內化能力和較大的載藥量,在再生醫學領域被認為是復雜細胞治療和單基因/蛋白質藥物治療的有益補充。然而,其作為基因/藥物載體的潛在應用受到極大限制的一個主要問題是納米級外泌體的低產率。此外,靜脈注射靶向性外泌體可能導致富血器官阻塞。有鑒于此,華中科技大學王江林、張勝民聯合深圳市兒童醫院王斌等人構建了一種特異的外泌體模擬物(EM),用于促進體內血管化成骨。
本文要點:
1)該EM可以實現大規模快速生產,與傳統的外泌體相比,它在大小、形態和膜蛋白標記上都表現出相似的特征。
2)為了避免靜脈注射的風險,提高局部治療的效率,同時應用工程化EM設計了一種基因激活基質(GAM),該基質可以通過將血管內皮生長因子(VEGF)質粒包封并靈活地結合到核殼納米纖維膜上而局部釋放。
3)研究結果表明,精心設計的工程化EM介導的GAM能夠持續遞送VEGF基因,并顯著促進體內的血管化成骨。本項工作不僅可以突破高產,夯實EMs的應用基礎,而且為原位治療提供了一種局部有效的工程化EMs輸送方式。
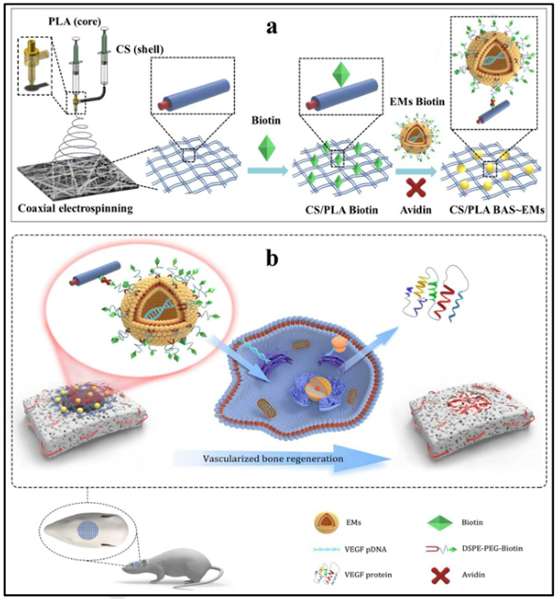
YaoZha, et al. Exosome-mimetics as an engineered gene-activated matrix inducesin-situ vascularized osteogenesis, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.119985
8.Biomaterials:mRNA活化基質編碼轉錄因子作為組織工程細胞分化的引物
編碼關鍵轉錄因子(TF)的基因活化基質(GAMs)是指導組織工程應用中干細胞規范的有力工具。然而,現有的以pDNA激活的TF為基礎的GAMs存在轉染效率低、轉基因表達滯后等問題。在此,西班牙圣地亞哥·德·孔波斯特拉大學MarcosGarcia-Fuentes等人報告了一種由編碼TFs SOX9(軟骨)和MYOD(肌肉)的mRNA激活的GAM技術。
本文要點:
1)實驗發現,與pDNA-GAMs相比,這些mRNA-GAMs誘導了更高和更快的TF表達,特別是在核糖核酸酶抗性mRNA序列的情況下。這種有效的TF表達被轉化為軟骨和肌肉特異性標記物的高度合成,并最終在體外成功地實現了組織規范化。
2)此外還表明,通過改變mRNA-GAM環境的特性,可以進一步調節組織特異性標記物的表達。這些結果突出了這種GAM技術在啟動細胞譜系規范方面的價值,這是未來組織工程設備的關鍵核心。
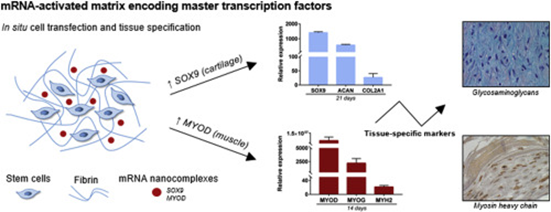
AdrianaM.Ledo, et al. mRNA-activated matrices encoding transcription factors asprimers of cell differentiation in tissue engineering, Biomaterials, 2020.
https://doi.org/10.1016/j.biomaterials.2020.120016
9.Biomaterials:基于微流控技術的心臟外植體來源細胞修復損傷心肌
雖然將細胞包裹在保護性的納米孔凝膠繭中可以增加細胞保留率和促進生存的整合素信號,但繭的大小和囊內細胞-細胞相互作用對治療性修復的影響尚不清楚。有鑒于此,加拿大渥太華大學的DarrylR. Davis等研究人員,使用微流控平臺來分析繭大小和囊內細胞數量對移植心臟外植體來源細胞再生潛力的影響。
本文要點
1)繭大小的確定性增加增加了繭內多細胞聚集體的比例,減少了移植細胞的維管清除,增強了內源修復的刺激。
2)后者可歸因于細胞因子和胞外小泡產生的細胞-細胞刺激,同時也可擴大胞外小泡內miRNA的含量。
3)因此,通過調節繭大小和細胞占有率,可以增強移植細胞的旁分泌信號和保留,促進旁分泌刺激內源性組織修復。
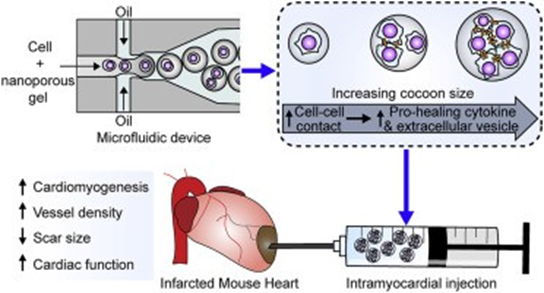
PushpinderKanda, et al. Deterministic paracrine repair of injured myocardium usingmicrofluidic-based cocooning of heart explant-derived cells. Biomaterials,2020.
DOI:10.1016/j.biomaterials.2020.120010
https://www.sciencedirect.com/science/article/pii/S0142961220302568
10.Biomaterials:3D細胞打印腎小管組織類似物
盡管腎組織的發展取得了重大進展,但具有臨床相關細胞異質性的可灌注復合腎小管組織的再修復仍然是一個挑戰。于此,韓國浦項科技大學Dong-Woo Cho和韓國加圖立大學Yong Kyun Kim等人使用同軸3D細胞打印技術,提出了微流控空心管,以實現腎小管上皮細胞和內皮細胞組成的管狀/血管腎實質。研究人員開發了一種功能性雜交生物墨水,該生物墨水繼承了具有快速交聯特性的血管化天然腎組織的微環境,以優化細胞功能并保留預定的空心管狀結構。此外,新穎的生物墨水和3D同軸細胞打印技術提供了一種復雜的管,該管在打印管的整個長度上具有可調整的單層和雙層結構特征。通過原型制造血管化腎近端腎小管器官芯片,研究人員展示了其對新型微流控腎組織模型的適用性。空心管腎囊下移植顯示了移植腎的長期存活和腎小管結構的體內治療能力,為其在再生醫學中的應用奠定了基礎。
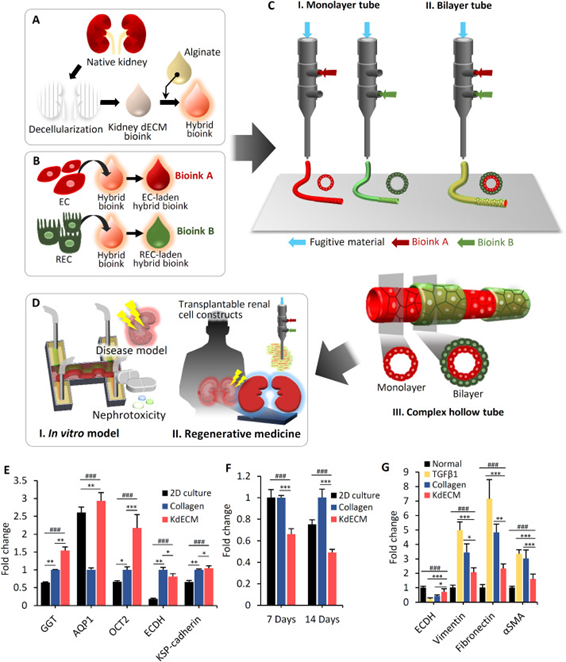
SinghNK, et al. Three-dimensional cell-printing of advanced renal tubular tissueanalogue. Biomaterials. 2019:119734.
https://doi.org/10.1016/j.biomaterials.2019.119734











