癌癥研究快速發(fā)展的領(lǐng)域中的最新發(fā)展使我們有理由對(duì)未來(lái)充滿(mǎn)希望。這本來(lái)自Science期刊家族五大成員雜志的研究論文集,著重介紹了在改善免疫療法,增強(qiáng)藥物遞送,確定新的治療靶標(biāo),了解腫瘤微環(huán)境以及改善患者反應(yīng)方面的進(jìn)展。奇物論編輯部對(duì)該特刊的全部10篇論文進(jìn)行簡(jiǎn)要解讀,以供大家學(xué)習(xí)和交流。1. Science:疫苗聯(lián)合CAR-T細(xì)胞攻克實(shí)體瘤治療瓶頸
嵌合抗原受體(CAR)-T細(xì)胞免疫療法在治療某些血液癌方面非常成功。然而,這種方法對(duì)于實(shí)體瘤一直是挑戰(zhàn),部分是因?yàn)殡y以將功能改造的T細(xì)胞靶向腫瘤部位。麻省理工學(xué)院Darrell J. Irvine等人設(shè)計(jì)了一種疫苗策略,通過(guò)直接在天然淋巴結(jié)微環(huán)境中重新刺激CAR來(lái)提高CAR-T細(xì)胞的功效。注射的“amph-配體”疫苗可促進(jìn)合成抗原的呈遞,并導(dǎo)致CAR-T細(xì)胞活化,擴(kuò)增和增加的腫瘤殺傷力。該系統(tǒng)可能會(huì)應(yīng)用于增強(qiáng)任何CAR-T細(xì)胞。
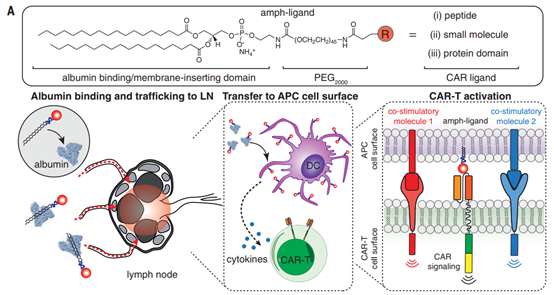
Ma L, et al. Enhanced CAR–T cell activity against solidtumors by vaccine boosting through the chimeric receptor. Science.2019;365(6449):162-8.DOI:10.1126/science.aav8692https://science.sciencemag.org/content/365/6449/1622. Science:癌癥通過(guò)DNA突變來(lái)逃避靶向治療

治療細(xì)菌感染的醫(yī)生和治療癌癥的醫(yī)生通常面臨一個(gè)共同的挑戰(zhàn):耐藥性的發(fā)展。眾所周知,當(dāng)細(xì)菌暴露于抗生素時(shí),它們會(huì)暫時(shí)增加其突變率(自適應(yīng)變異性),從而增加了后代抗生素抗性細(xì)胞出現(xiàn)的機(jī)會(huì)。那么,癌細(xì)胞是否也利用類(lèi)似的機(jī)制來(lái)確保自身在藥物暴露后而存活下來(lái)呢?因?yàn)槠毡榈挠^點(diǎn)認(rèn)為,腫瘤耐藥性是既成事實(shí):即當(dāng)治療開(kāi)始時(shí),癌癥已經(jīng)含有耐藥突變細(xì)胞。有鑒于此,意大利坎迪奧洛癌癥研究所Alberto Bardelli和Mariangela Russo等人研究了人類(lèi)結(jié)直腸癌(CRC)細(xì)胞是否同樣利用類(lèi)似細(xì)菌的適應(yīng)性易變性來(lái)逃避治療壓力。他們發(fā)現(xiàn)表皮生長(zhǎng)因子受體(EGFR)/BRAF抑制劑下調(diào)了錯(cuò)配修復(fù)(MMR)和同源重組DNA修復(fù)基因,同時(shí)上調(diào)了耐藥(persister)細(xì)胞中易出錯(cuò)的聚合酶。在治療過(guò)程中,MMR蛋白在患者來(lái)源的異種移植物和腫瘤標(biāo)本中也被下調(diào)了。EGFR/BRAF抑制劑導(dǎo)致DNA損傷,易變性增強(qiáng),并觸發(fā)微衛(wèi)星不穩(wěn)定性。因此,像細(xì)菌一樣,癌細(xì)胞也可以通過(guò)增強(qiáng)其可變性來(lái)適應(yīng)治療壓力。
RussoM, Crisafulli G, Sogari A, Reilly NM, Arena S, Lamba S, et al. Adaptivemutability of colorectal cancers in response to targeted therapies. Science.2019;366(6472):1473-80.DOI:10.1126/science.aav4474https://doi.org/10.1126/science.aav44743. Science Advances:高效腫瘤選擇性納米顆粒用于腫瘤免疫雙靶向治療

盡管免疫療法在對(duì)抗癌癥方面具有廣闊的前景,但由于免疫抑制性腫瘤微環(huán)境和全身毒性所致的有限療效,阻礙了癌癥免疫療法的廣泛應(yīng)用。于此,臺(tái)灣國(guó)立清華大學(xué)陳韻晶和臺(tái)灣國(guó)家衛(wèi)生研究院Shu-Yi Lin等人報(bào)道了一種組合免疫療法,該療法使用高效且具有腫瘤選擇性的基因載體來(lái)提高抗癌功效并規(guī)避全身毒性。在這項(xiàng)研究中,設(shè)計(jì)了具有胸腺嘧啶功能化樹(shù)狀大分子的腫瘤靶向脂質(zhì)樹(shù)狀大分子磷酸鈣(TT-LDCP)納米顆粒(NPs),該納米粒通過(guò)激活干擾素基因的刺激因子(STING)cGAS途徑,不僅顯示出增強(qiáng)的基因傳遞能力,而且還具有免疫佐劑特性。TT-LDCP NPs向肝細(xì)胞癌(HCC)傳遞針對(duì)免疫檢查點(diǎn)配體PD-L1和免疫刺激性IL-2編碼質(zhì)粒DNA的siRNA,增加了腫瘤浸潤(rùn)和CD8+ T細(xì)胞的活化,增強(qiáng)了癌癥疫苗免疫療法的效力,并抑制了HCC生長(zhǎng)。該工作提出了納米技術(shù)實(shí)現(xiàn)的siRNA和質(zhì)粒DNA雙重遞送,可選擇性靶向和重編程免疫抑制腫瘤微環(huán)境以改善癌癥免疫治療。

HuangK-W, et al. Highly efficient and tumor-selective nanoparticles fordual-targeted immunogene therapy against cancer. Science Advances.2020;6(3):eaax5032.DOI:10.1126/sciadv.aax5032https://advances.sciencemag.org/content/6/3/eaax50324. Science Advances:追蹤細(xì)胞外囊泡表型變化可以監(jiān)測(cè)黑色素瘤的治療情況

實(shí)時(shí)監(jiān)測(cè)針對(duì)癌癥患者的靶向治療可以提供有關(guān)耐藥性發(fā)展和改善治療結(jié)果的重要信息。細(xì)胞外囊泡(EVs)最近已成為有希望的癌癥生物標(biāo)志物,并且EV表型顯示出監(jiān)測(cè)治療反應(yīng)的巨大潛力。于此,澳大利亞昆士蘭大學(xué)Matt Trau和麥考瑞大學(xué)Yuling Wang等人展示了使用多重EV表型分析儀芯片(EPAC)監(jiān)測(cè)基于血漿EV表型演變的患者治療反應(yīng)的可行性。EPAC結(jié)合了納米混合增強(qiáng)微芯片和多重表面增強(qiáng)拉曼散射(SERS)納米標(biāo)簽系統(tǒng),用于直接EV表型分析,無(wú)需EV富集。在臨床前模型中,研究人員觀察到EV表型異質(zhì)性和對(duì)治療的不同表型反應(yīng)。此外,研究人員成功地從黑素瘤患者血漿中檢測(cè)出了癌癥特異性的EV表型。縱向監(jiān)測(cè)了八名接受靶向治療的黑色素瘤患者的EV表型演變,并發(fā)現(xiàn)了與耐藥性發(fā)展有關(guān)的特定EV譜,反映了EV表型監(jiān)測(cè)治療反應(yīng)的潛力。
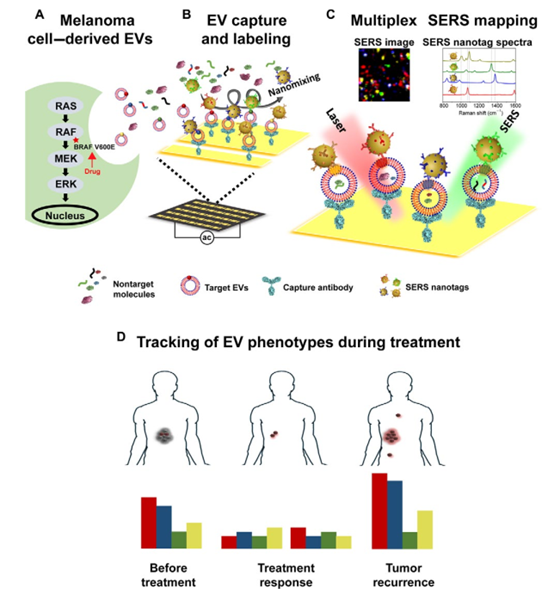
WangJ, et al. Tracking extracellular vesicle phenotypic changes enables treatmentmonitoring in melanoma. Science Advances. 2020;6(9):eaax3223.DOI:10.1126/sciadv.aax3223https://advances.sciencemag.org/content/6/9/eaax32235. Science Immunology:髓樣細(xì)胞中PD-1的靶向缺失可誘導(dǎo)抗腫瘤免疫


針對(duì)可以逆轉(zhuǎn)T細(xì)胞耗竭的程序性細(xì)胞死亡蛋白1(PD-1)的免疫療法已經(jīng)徹底改變了癌癥的治療。PD-1是T細(xì)胞檢查點(diǎn)受體,是癌癥免疫療法的靶標(biāo),也可在髓樣細(xì)胞上表達(dá)。目前尚不清楚髓樣特異性與T細(xì)胞特異性PD-1消融在抗腫瘤免疫中的作用,因?yàn)榇蠖鄶?shù)研究都使用了PD-1阻斷抗體或完整的PD-1 KO小鼠。于此,通過(guò)產(chǎn)生Pdcd1 floxed小鼠并有條件地刪除T細(xì)胞或骨髓細(xì)胞中的PD-1,哈佛大學(xué)醫(yī)學(xué)院Vassiliki A. Boussiotis等人發(fā)現(xiàn)了以前沒(méi)有被認(rèn)識(shí)到的PD-1在髓樣細(xì)胞上表達(dá)的抑制抗腫瘤免疫的作用。他們發(fā)現(xiàn)在髓樣細(xì)胞中選擇性切除PD-1與限制PD-1的缺失一樣有效地限制了腫瘤的生長(zhǎng),并且已經(jīng)證明PD-1在調(diào)節(jié)髓樣細(xì)胞的發(fā)育和功能中的重要性。盡管該研究并未質(zhì)疑PD-1在T細(xì)胞耗竭中的作用,但研究結(jié)果要求人們重新思考以PD-1為中心的療法如何發(fā)揮作用。
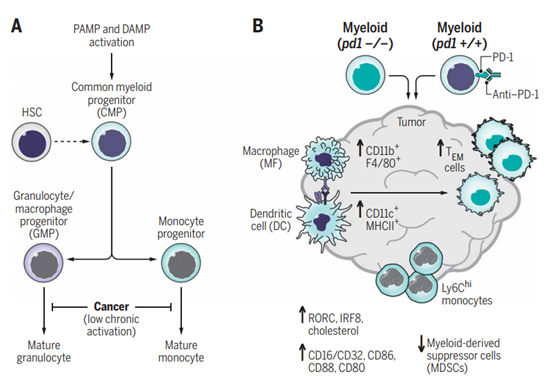
Strauss L, et al. Targeted deletion of PD-1 in myeloid cellsinduces antitumor immunity. Science Immunology. 2020;5(43):eaay1863.DOI:10.1126/sciimmunol.aay1863https://immunology.sciencemag.org/content/5/43/eaay18636. Science Immunology:揭示CAR-T療法引起炎癥因子風(fēng)暴的機(jī)理

細(xì)胞因子釋放綜合征(CRS)是與癌癥患者的嵌合抗原受體(CAR)T細(xì)胞療法相關(guān)的并發(fā)癥。觸發(fā)CRS的機(jī)制尚不清楚,但中國(guó)醫(yī)學(xué)科學(xué)院基礎(chǔ)醫(yī)學(xué)研究所黃波教授等人描述了在腫瘤細(xì)胞焦亡過(guò)程中,成孔蛋白Gasdermin E(GSDME)的作用,這有助于CRS。CART細(xì)胞釋放出顆粒酶B,顆粒酶B激活半胱天冬酶3并切割靶腫瘤細(xì)胞中的GSDME并引起細(xì)胞焦亡。GSDME引起的細(xì)胞焦亡導(dǎo)致巨噬細(xì)胞中caspase 1和GSDMD的激活,這對(duì)于觸發(fā)CRS至關(guān)重要。癌癥患者中GSDME水平升高與CRS嚴(yán)重程度呈正相關(guān)。此外,CAR T細(xì)胞誘導(dǎo)細(xì)胞焦亡的能力與釋放的穿孔素和顆粒酶B的水平有關(guān)。
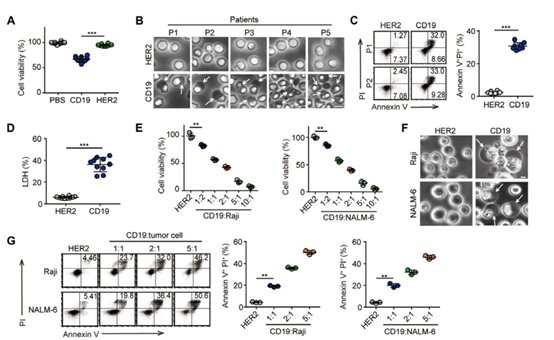
LiuY, et al. Gasdermin E–mediated target cell pyroptosis by CAR T cells triggerscytokine release syndrome. Science Immunology. 2020;5(43):eaax7969.DOI:10.1126/sciimmunol.aax7969https://immunology.sciencemag.org/content/5/43/eaax79697. Science Signaling:針對(duì)靶向治療的KRAS突變體等位基因特異性反應(yīng)的系統(tǒng)機(jī)制

表達(dá)KRAS G13D突變體的結(jié)直腸癌(CRC)患者通常對(duì)生長(zhǎng)因子受體EGFR的阻斷有反應(yīng),而具有所有其他KRAS突變體的CRC患者則沒(méi)有。因?yàn)樵谝阎腅GFR-RAS生物學(xué)背景下這種治療起作用的原因尚不清楚,所以臨床實(shí)踐通常拒絕將其用于所有KRAS突變CRC患者。但是,美國(guó)索爾克生物研究所Edward C. Stites等人使用綜合計(jì)算和生物化學(xué)方法顯示,與其他KRAS突變蛋白相比,KRAS G13D與蛋白NF1的相互作用太弱而不能競(jìng)爭(zhēng)性地抑制它;因此,KRAS G13D細(xì)胞中的野生型RAS仍然依賴(lài)于EGFR的活化和用于腫瘤生長(zhǎng)。這些發(fā)現(xiàn)揭示了為什么精準(zhǔn)醫(yī)學(xué)將從更多的系統(tǒng)級(jí)別而不是基因組級(jí)別的患者受益。
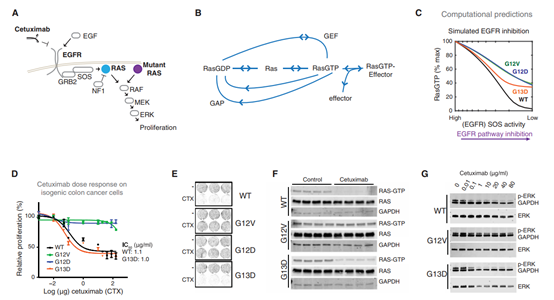
McFallT, et al. A systems mechanism for KRAS mutant allele–specific responses totargeted therapy. Science Signaling. 2019;12(600):eaaw8288.DOI:10.1126/scisignal.aaw8288https://stke.sciencemag.org/content/12/600/eaaw82888. Science Signaling:脂肪細(xì)胞可觸發(fā)腫瘤轉(zhuǎn)移

在黑色素瘤患者的樣本中,腫瘤似乎在皮膚上表皮層的外側(cè)增生期中生長(zhǎng),但是當(dāng)它們生長(zhǎng)到存在脂肪(脂肪)的較深層時(shí),則轉(zhuǎn)變?yōu)榇怪钡慕?rùn)期。以色列特拉維夫大學(xué)Carmit Levy等人研究了黑素瘤細(xì)胞和脂肪細(xì)胞的共培養(yǎng),并確定了脂肪細(xì)胞在這種轉(zhuǎn)移轉(zhuǎn)換中的直接作用。作者發(fā)現(xiàn),脂肪細(xì)胞分泌細(xì)胞因子,通過(guò)黑素瘤細(xì)胞上的受體發(fā)出信號(hào),從而抑制了那些促進(jìn)增殖和抑制侵襲性表型的microRNA的表達(dá)。microRNA還抑制生長(zhǎng)因子TGF-β的受體表達(dá),該因子與轉(zhuǎn)移性疾病有關(guān),并在真皮層豐富。阻斷TGF-β信號(hào)傳導(dǎo)阻止了培養(yǎng)的黑色素瘤細(xì)胞的侵襲性轉(zhuǎn)換,因此可以抑制患者的轉(zhuǎn)移。
Golan T, et al. Adipocytes sensitize melanoma cells toenvironmental TGF-β cues by repressing the expression of miR-211. ScienceSignaling. 2019;12(591):eaav6847.DOI:10.1126/scisignal.aav6847https://stke.sciencemag.org/content/12/591/eaav68479. Science Translational Medicine:抗癌藥物可能不會(huì)像我們認(rèn)為的那樣起作用

97%在腫瘤臨床試驗(yàn)中測(cè)試的藥物適應(yīng)癥配對(duì)從未獲得美國(guó)食品和藥物管理局的批準(zhǔn)。雖然缺乏療效和劑量限制性毒性是試驗(yàn)失敗的最常見(jiàn)原因,但為何這么多新藥會(huì)遇到這些問(wèn)題的原因尚不清楚。利用CRISPR-Cas9突變技術(shù),美國(guó)冷泉港實(shí)驗(yàn)室ason M. Sheltzer等人在臨床試驗(yàn)的不同階段,研究了一系列抗癌藥物和藥物靶點(diǎn)。確定了導(dǎo)致該問(wèn)題的一個(gè)潛在原因,表明臨床開(kāi)發(fā)中的某些化合物實(shí)際上并未靶向最初認(rèn)為它們靶向的致癌基因。然后,研究人員確定了多種存在類(lèi)似問(wèn)題的藥物,并找到了其中一種藥物的正確靶標(biāo),這表明在將其推向臨床之前,需要更多的研究和更嚴(yán)格的方法來(lái)驗(yàn)證潛在藥物的靶標(biāo)。
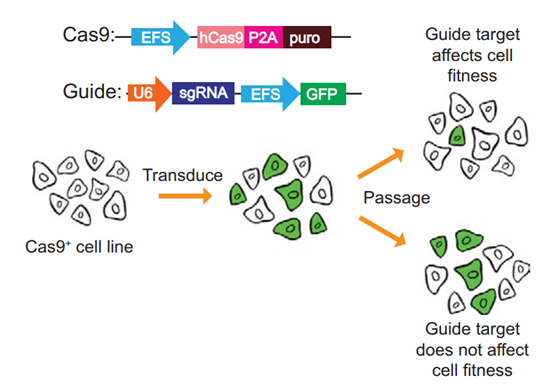
Lin A, et al. Off-target toxicity is a common mechanism of action ofcancer drugs undergoing clinical trials. Science Translational Medicine.2019;11(509):eaaw8412.DOI: 10.1126/scitranslmed.aaw8412https://stm.sciencemag.org/content/11/509/eaaw841210. ScienceTranslational Medicine:人乳腺中先天性Vδ1+ γδ T細(xì)胞或有助于緩解三陰性乳腺癌

已知特定的γδ T細(xì)胞亞群可填充諸如皮膚和腸道等組織。為了確定γδ T細(xì)胞參與乳腺癌監(jiān)測(cè),英國(guó)倫敦國(guó)王學(xué)院Adrian Hayday等人從人乳腺組織的網(wǎng)格培養(yǎng)物中分離出細(xì)胞。他們?cè)诮】档娜祟?lèi)乳腺組織和腫瘤組織中觀察到了溶細(xì)胞的先天性Vδ1+ T細(xì)胞。對(duì)一小群三陰性乳腺癌婦女的分析表明,這些Vδ1+ T細(xì)胞與病情緩解和總生存率相關(guān)。這些結(jié)果表明,人類(lèi)組織駐留的γδ T細(xì)胞可能影響乳腺癌的進(jìn)展。這些細(xì)胞可能是現(xiàn)有或未來(lái)免疫療法干預(yù)的關(guān)鍵。
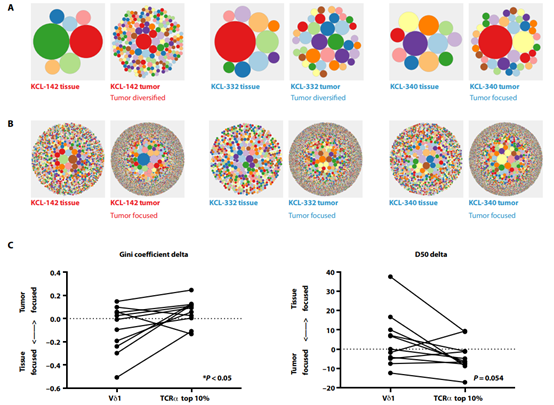
Wu Y, et al. An innate-like Vδ1+ γδ T cell compartment in thehuman breast is associated with remission in triple-negative breast cancer. ScienceTranslational Medicine. 2019;11(513):eaax9364.DOI: 10.1126/scitranslmed.aax9364https://stm.sciencemag.org/content/11/513/eaax9364

http://promo.aaas.org/images/Publishing/Journals/2020/Booklet/AACR20_Cancer_Booklet_Online-Final.pdf
















































